代谢型谷氨酸受体1阻滞剂LY367385对NMDA所致神经元损伤的保护作用
杨军兰 赵天智 谢云*
(1西北妇女儿童医院医学检验中心,陕西 西安 710061; 2空军军医大学唐都医院神经外科,陕西 西安 710038)
谷氨酸(glutamate, Glu)是中枢神经系统中最重要的一种兴奋性神经递质,在中枢神经系统的许多生理和病理过程扮演了重要角色[1]。然而,谷氨酸的过度释放可以通过与离子型(ionotropic glutamate receptors, iGluRs)和代谢型谷氨酸受体(metabotropic glutamate receptors, mGluRs)的作用,直接引起兴奋性神经毒性,这一过程也参与了脑外伤、中风、帕金森病等多种神经系统疾病的病理过程[2-4]。目前,在代谢型谷氨酸受体家族中,研究最广泛的是亚型1和5。已有研究表明,激活代谢型谷氨酸受体1(mGluR1)可以导致大鼠癫痫发作的频率显著增加[5-6],并且抑制mGluR1对沙鼠脑缺血损伤有保护作用[7]。此外,mGluR5可以通过与突触后致密蛋白95(postsynaptic density 95, PSD95)相互作用,从而调控下游的一系列信号分子[8]。然而,mGluR1调控谷氨酸信号转导的具体机制尚未明确。本实验利用N-甲基-D-门冬氨酸(N-methyl-D-aspartic acid, NMDA)激活突触后膜的NMDA受体,以获取兴奋性神经元损伤模型,用mGluR1特异性阻滞剂LY367385 [(+)-2-甲基-4-羟基苯甘氨酸]抑制mGluR1的作用,进而了解其在神经元兴奋性损伤中的具体作用。
材料与方法
一、试剂
孕16 d清洁级SD大鼠,由空军军医大学实验动物中心提供。改良伊格尔培养基(Dulbecco modified Eagle medium, DMEM)高糖培养基和胎牛血清(Hyclone公司),羟乙基哌嗪乙硫磺酸(4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid, HEPES)(Farco公司),PSD95抗体(美国Cell Signaling Technology公司),GluN2B抗体(美国NeuroMab公司),NMDA(美国Sigma公司),细胞裂解液(上海碧云天生物科技研究所),喹啉酸蛋白浓度测定试剂盒(北京博奥森生物技术有限公司),二抗(美国Santa Cruz Biotechnology)。
二、神经元细胞分离及培养
解剖孕16 d SD大鼠,取出胎鼠,分离脑皮质组织,剪碎,0.25%胰酶37 ℃消化30 min后,加入完全培养液终止消化,离心后去上清,培养液洗涤一次后再次离心,去上清,加2 mL完全培养液轻轻吹打形成细胞悬液,通过200目滤网过滤,以5×105/孔的密度接种于多聚赖氨酸包被的24孔板。完全培养液:DMEM高糖培养基13.4 g/L,碳酸氢钠2 g/L,青霉素G 100 U/mL,链霉素100 μg/mL,HEPES 1.19 g/L,N2添加剂13.4 g/L,胎牛血清10%。神经元随机分为3组:对照组:不做任何处理;NMDA组:10 μM NMDA 处理;NMDA+LY367385组:50 μM LY367385预处理1 h后,再加入10 μM NMDA处理,各组均为5。
三、细胞活性测定
将细胞按2×103个/孔接种于96孔培养板,设置6个平行孔及空白对照,分别进行相应处理后每孔加入20 μL甲基噻唑基四唑(methyl thiazolyl tetrazolium, MTT)溶液(5 mg/mL),继续培养4 h后,弃去培养基,加入150 μL二甲基亚砜(dimethyl sulphoxide, DMSO),震荡15 min,酶标仪490 nm波长下测定各孔吸光度值(optical density, OD),绘制细胞增殖曲线。
四、细胞培养基乳酸脱氢酶(lactate dehydrogenase, LDH)含量测定
神经元进行相应处理后,收集上清,依据试剂盒说明测定LDH含量。
五、转移酶介导的三磷酸脱氧鸟苷-生物素刻痕末端标记(transferase-mediated deoxyuridine triphosphate-biotin nick end labeling, TUNEL)法检测细胞凋亡
4%多聚甲醛固定细胞,用磷酸缓冲液(phosphate buffer solution tween, PBST)冲洗后按照检测试剂盒说明书操作,4', 6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)染色观察细胞核形态,计算平均阳性细胞率,即凋亡指数(apoptosis index, AI)。
六、免疫共沉淀
神经元经过相应处理后,提取蛋白并与Protein A/G beads和GluN2B抗体或PSD95抗体孵育过夜。样品经Western blot检测。
七、蛋白质免疫印迹法(Western blot)检测
神经元经过相应处理后,RIPA法裂解细胞,提取细胞总蛋白,BCA法定量。在12%聚丙烯凝胶中电泳,转至硝酸纤维素膜,5%脱脂奶粉室温封闭2 h,配制适当浓度一抗4 ℃孵育过夜。PBST漂洗后,加入用辣根过氧化物酶标记的相应二抗,室温封闭2 h,PBST漂洗后加发光液显影。
八、统计学分析
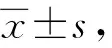
结 果
一、mGluR1阻滞剂LY367385对NMDA所致的神经元损伤有保护作用
分别用浓度为1 μM、10 μM、50 μM和100 μM的LY367385处理神经元1 h后,向培养基中加入10 μM NMDA造成神经元细胞兴奋性损伤,24 h后测定细胞活性。同样方法处理细胞后,收集细胞培养基上清,测定细胞培养基中LDH含量。我们发现,与NMDA损伤组相比,10 μM、50 μM和100 μM LY367385预处理后,细胞活性明显增加,并且LDH含量明显降低(P<0.05)。见图1。为深入探讨LY367385的作用,我们选取50 μmol/L的LY367385进行进一步实验。

图1 mGluR1阻滞剂LY367385对NMDA所致的神经元损伤有保护作用
Fig 1 The mGluR1 antagonist LY367385 protects against NMDA-induced neuronal injury
A: Cell viability; B: LDH release.
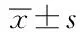
aP< 0.05,vsControl group;bP<0.05,vsNMDA group.
二、mGluR1阻滞剂LY367385可以抑制NMDA造成的神经元凋亡
用10 μM NMDA 处理神经元细胞24 h后,AI值(39.08%±8.36%,P<0.05)与对照组(5.42%±2.59%,P<0.05)相比显著升高(P<0.05)。50 μM LY367385预处理1 h后,再加入10 μM NMDA处理细胞24 h,AI值(19.96%±8.71%,P<0.05)较NMDA处理组显著降低(P<0.05)。见图2。表明NMDA可以造成的神经元凋亡,而mGluR1阻滞剂LY367385可以减轻神经元凋亡,对NMDA引起的神经元损伤有保护作用。
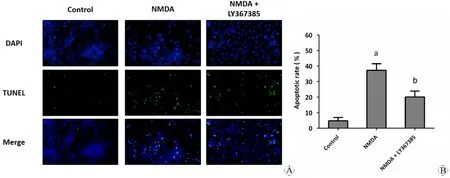
图2 mGluR1阻滞剂LY367385可以抑制NMDA造成的神经元凋亡
Fig 2 The mGulR1 antagonist LY367385 inhibits NMDA-induced neuronal apoptosis
A: TUNEL staining; B: Apoptotic rate.
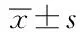
aP<0.05,vsControl group;bP<0.05,vsNMDA group.
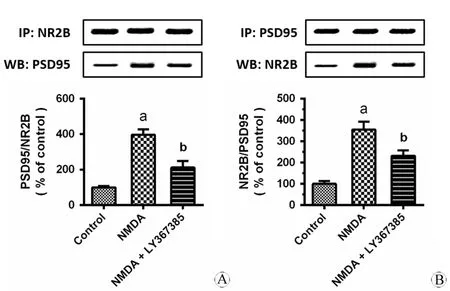
图3 LY367385可以抑制NMDA造成的NR2B-PSD95表达增加
Fig 3 LY367385 attenuates the formation of NR2B-PSD95 complex
A: Co-IP of NR2B with PSD95; B: CO-IP of PSD95 with NR2B.
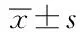
aP<0.05,vsControl group;bP<0.05,vsNMDA group.
三、LY367385可以抑制NMDA造成的GluN2B-PSD95表达增加
应用免疫共沉淀分析GluN2B-PSD95相互作用结果,以进一步分析mGluR1与PSD95在体外是否相互作用。以GluN2B的抗体进行免疫沉淀,在免疫沉淀产物中检测PSD95,再以PSD95的抗体进行免疫沉淀,在沉淀产物中检测GluN2B,结果提示,GluN2B与PSD95存在内源性的相互作用。见图3。
讨论
mGluRs广泛分布于中枢神经系统,是一个G蛋白偶联受体家族,目前已知有8种亚型。根据其结构同源性、药理学特性和传导通路分成3组,目前研究最为广泛的主要是第一组mGluRs,包括mGluR1和mGluR5[9]。mGluRs被激活后,通过激活磷脂酶C(phospholipase C, PLC)引起磷脂酰肌醇(phosphoinositide, PI)水解,产生二酰基甘油(diacylglcerol, DAG)和三磷酸肌醇(inositol triphosphate, IP3),从而引起胞质内Ca2+增加,产生一系列的生理和病理反应。本实验观察了mGluR1特异性阻滞剂LY367385对NMDA引起的神经元细胞兴奋性损伤的作用,发现LY367385对减轻NMDA引起的神经元细胞凋亡有一定的作用,并且可以影响GluN2B-PSD95复合体的表达。
突出后致密物(postsynaptic density, PSD)是位于中枢神经系统突出后膜下的高电子密度特化区,主要由谷氨酸受体及相关的支架蛋白及信号通路蛋白组成[10]。PSD95是其中一种主要的蛋白成分,参与了多条信号通路的表达和作用。NMDA受体是iGluRs家族中重要的类型,也是PSD的重要组成部分。NMDA受体可以通过NR2亚基的C末端与PSD95的PDZ1结构域直接连接,形成NMDAR-PSD95复合体。PSD95还可与其他突触后结构蛋白相连,如GKAP和Shank,后者还可以间接与mGluRs胞内末端连接[11-12]。由PSD95连接的这种复杂的突触后细胞网络有可能参与和调控了多种胞内信号通路的作用。在NMDA损伤的神经元中,用LY367385阻断mGluR1后,GluN2B-PSD95复合体的表达显著减少。因此,mGluR1可能通过与突触后致密物质PSD95的相互作用影响NMDA受体功能,从而减轻细胞兴奋性损伤,发挥神经保护作用。
LY367385对抗NMDA所致的神经元损伤的作用表明,mGluR1在神经系统兴奋性损伤中起了重要作用,mGluR1的阻滞剂有望成为新的神经保护剂。