纳米铁–生物质炭复合材料对苋菜吸收累积菲的影响①
沈连舟,蔡 月,孙昭玥,蒲丽蓉,施维林,高 娟*
纳米铁–生物质炭复合材料对苋菜吸收累积菲的影响①
沈连舟1,2,蔡 月2,孙昭玥2,蒲丽蓉2,施维林1*,高 娟2*
(1 苏州科技大学环境科学与工程学院,苏州 215009;2中国科学院南京土壤研究所,南京 210008)
本文探究了纳米铁–生物质炭复合材料(nZVIBC)及其两种组成成分纳米零价铁(nZVI)和纳米生物质炭(nBC)添加到菲污染土壤后对土壤理化性质、苋菜生理功能以及菲在土壤–植物系统中迁移转化的影响。结果表明:nZVIBC的添加使土壤总有机碳含量提高为对照组的1.38倍,显著提高了土壤中菲的非解吸态占比(41.1%),显著降低苋菜根对土壤菲的生物富集系数(85.7%),抑制了土壤中菲的迁移能力;同时,nZVIBC的添加造成土壤中菲的残留量增至对照组的8.6倍,使苋菜地上和地下部分菲的积累量分别显著增加了42.9% 和37.9%;此外,nZVIBC添加造成苋菜地下部分Fe含量上升42.0%,Mn含量显著降低74.9%。由于Fe元素和菲含量增加而导致的氧化胁迫,苋菜生物量显著降低了55.8%,但生物膜并未受到严重损伤。研究结果表明,nZVI会对苋菜正常生理功能和抗氧化能力带来不利影响,而nBC能够引起土壤有机质及菲含量形态的改变。nZVIBC作为多环芳烃(PAHs)污染修复材料可以有效降低土壤PAHs的迁移转化,适合用于土壤有机污染的原位化学修复,具有良好的应用前景。
多环芳烃;生物可利用性;生态效应;迁移转化;氧化应激
多环芳烃(Polycyclic Aromatic Hydrocarbons, PAHs)是一类具有“三致效应”的持久性有机污染物[1-2],环境中的PAHs主要来源于石油或化石燃料的不完全燃烧。农田土壤中PAHs累积主要通过污泥农用、污水灌溉和大气沉降等方式[1]。2014年土壤调查公报结果显示,我国农田土壤PAHs点位超标率达1.4%。土壤中的PAHs可被植物吸收和累积,并通过食物链传递和生物放大作用造成生态环境污染并威胁人体健康[3]。因此,开发绿色的土壤PAHs污染修复技术、选择环境友好的农田有机污染原位修复材料具有重要意义。
纳米零价铁(Nanoscale Zero-Valent Iron, nZVI)是指至少一个维度达到纳米尺寸(1 ~ 100 nm)的零价铁颗粒,兼具纳米材料特有的小尺寸效应和ZVI高效的活化性能[4],可以用于活化过硫酸盐产生高活性自由基(SO4•–和•OH)降解有机污染物[5-6],或者直接施用于农田,利用其高脱氯活性降解污染物,在农田PAHs污染修复领域潜力巨大。但nZVI颗粒易氧化团聚[7],进而导致电子传递效率及活化性能的减弱[8];同时,nZVI自身具有一定生物毒性,会直接损伤植物根系或阻碍其对营养物质的吸收,在土壤中能够构造高Fe环境从而引发根部细胞内活性氧物质的过量产生[9],造成生物膜、蛋白质及核酸的损伤,在土壤修复中易造成二次污染。为此,研究者尝试以无机非金属材料负载的方式弥补nZVI在实际应用中的不足[10-11]。生物质炭(BC)是生物质不完全燃烧形成的固体富碳材料,其原料来源广泛,可由秸秆、木屑、畜禽粪质等多种农林废物或咖啡渣等餐厨垃圾为原料生产制备[12-14],且仅需简单的热解过程即可制备,便于量产,因此常被作为土壤改良剂而广泛使用[15-16]。BC比表面积大,表面存在大量含氧官能团,能够加强土壤中阴阳离子的交换能力,从而降低土壤中金属离子的溶出[17-18],是负载nZVI的优良选择。在土壤有机污染的原位修复中,金属负载型生物质炭能发挥出积极作用,Gao等[19]的研究表明Fe、Mn浸渍生物质炭有效降低了污染土壤中邻苯二甲酸酯(Phthalate Esters, PAEs) 的生物有效性,Li等[20]研究提出了Fe浸渍生物质炭活化过硫酸铵可以在降解PAHs的同时提高生菜产量,对金属负载型生物质炭的研究正快速向实际应用发展。
以ZVI和BC为原料并通过球磨法制备的纳米铁–生物质炭复合材料(Nanoscale Zero-Valent Iron Biochar, nZVIBC)主要成分是nZVI和纳米生物质炭(Nanoscale Biochar, nBC),具有产量大、修复效果好的特点,近年来受到广泛关注[21-22]。当金属负载型生物质炭和污染物在土壤环境中共存时,BC的高迁移率和金属离子的生物毒性可能导致环境风险的增加[23]。目前对此研究主要集中于生物质炭负载金属材料在水污染修复中的应用,对nZVIBC在土壤污染修复中的研究较少,特别是其在农田土壤中与有机污染物共存下的环境风险研究[24-25],因此有关nZVIBC施入PAHs污染土壤后对土壤–作物系统的影响亟需开展。本研究选择菲作为PAHs的代表污染物,选择苋菜为模式植物,分别添加nZVIBC、nZVI和nBC作为试验材料,开展盆栽试验。对土壤理化性质、PAHs在土壤与植物间的迁移累积、植物生理指标与抗氧化能力进行了考察,进而评价了nZVIBC作为土壤修复材料对土壤–作物系统的影响,以期为农田土壤有机污染修复技术和土壤污染修复材料安全性评价提供科学数据与支持。
1 材料与方法
1.1 供试土壤
供试土壤采自南京市横溪村农田(118.7834612°E,31.7259186°N)表层,其属于黄棕壤,基础理化性质:pH 6.85,有机质含量10.2 g/kg,黏粒、粉粒和砂粒含量分别为144、721和135 g/kg。
供试土壤样品中菲的本底值低于检测限。供试土壤去除石子和植物根后风干,研磨过筛(10目)。取2 kg土样加入500 mL 0.4% 菲的丙酮溶液,搅拌混合均匀待丙酮挥发至干得到菲污染土壤一级母体,随后将一级母体用清洁土壤逐级稀释至目标浓度,老化14 d后测得菲在土壤中的浓度为9.16 mg/kg。土壤pH测定参照HJ 962—2018[26],选择土水比1∶2.5(∶),采用电位法进行测定;总有机碳含量使用总有机碳/总氮分析仪(Multi N/C 3100,德国耶拿)进行测定。
1.2 材料制备与表征
参照本实验室前期研究[27],利用行星式球磨仪进行nZVIBC、nZVI和nBC的制备。具体操作如下:使用两个25 L球磨罐进行制备,每个球磨罐装入直径为8、10、12和16 mm的钢珠各2 kg,向每个球磨罐中加入1︰1的BC和ZVI粉末(︰),使用吊装卸料一体机(DZ-25L,长沙天创粉末技术有限公司)吊装球磨罐至球磨仓内并固定。设定球磨程序如下:运行温度25 ℃,转速120 r/min,运行时间5 min,间歇时间2 min,开启反转功能,单次运行时间6 h。停止后使用吊装卸料一体机将球磨罐移动至自身振动筛分卸料位置并固定,将球磨罐盖更换为仪器配套的筛分卸料盖,转动旋转臂至球磨罐倒置后固定插栓,启动振动筛分开关进行卸料,取筛下物为所制备材料。nZVI或nBC的制备与nZVIBC相同,原料分别单独加入工业铁粉或BC。此外,为避免材料混杂,每种材料球磨制备后应更换相同规格球磨珠并对球磨罐进行清洁。
3种材料的形貌结构表征委托测试狗平台采用Zeta电位及纳米粒度分析(DLS,Litesizer 500,美国安东帕)和X射线光电子能谱仪(XPS,ESCALAB Xi+,美国赛默飞)进行测试,使用XPSpeak(4.1,郭炳联,香港中文大学)进行分峰拟合,使用紫外可见分光光度计(UV-2700,日本岛津),采用邻菲罗啉比色法[28]对3种材料的含Fe量进行测定。
1.3 盆栽试验
盆栽试验采用2% 的材料添加量,每45 kg菲污染土壤或无污染土壤分别与0.9 kg nZVIBC、nZVI或nBC混合搅拌均匀,制得6份材料混合土。另称取45 kg菲污染土与无污染土各一份,作为无材料添加土壤。老化14 d后,称取2.5 kg无材料添加土壤或2.55 kg有材料混合土壤,加入M20加仑盆(上径× 底径× 高 = 20 cm × 16 cm × 14 cm)用于苋菜种植。试验处理组设计如表1所示。
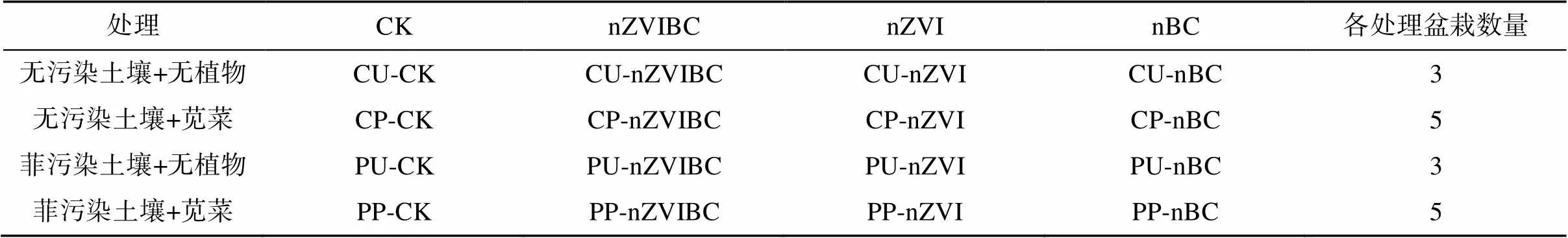
表1 苋菜盆栽试验设计
使用10% H2O2溶液(/)对苋菜种子消毒30 min,去离子水冲洗3次后撒播在两个32孔穴盘中,并将孔穴盘置于25 ℃培养箱(PRX-600D,宁波赛福实验仪器有限公司)育苗培养,15 d后间苗至每穴5株,幼苗平均高度达到10 cm后选取长势较为一致的5株幼苗移栽至各处理组花盆中。每盆代表一种处理,每种处理设置5个平行。移苗定植后将苋菜盆栽移植温室大棚中培育,棚内温度为24 ~ 32 ℃。所有盆栽随机放置于大棚内,每3 d随机交换盆栽位置。每2 d浇水至所有盆栽保持田间持水量的60%,培育75 d后收获。
1.4 植物生理生化指标测试
收获后的苋菜用去离子水冲洗,以去除表面附着的土壤与材料颗粒,擦净表面去离子水后把苋菜样品分为地上部分与地下部分,用电子天平称量并记录样品鲜物质量。
本研究以总抗氧化能力及丙二醛(MDA)含量作为判断植物抗氧化活性强弱的指标。定量准确称取新鲜苋菜地上及地下部分,按1/9(/)的比例加入生理盐水,冰水浴匀浆后离心取上清液作为待测液。总抗氧化能力以铁离子还原/抗氧化力测定法(Ferric Reducing/Antioxidant Power assay, FRAP)测定,参照Benzie和Strain[29]的方法:取适量待测液,加入2,3,5-triphenyltetrazolium chloride(TPTZ)工作液,混匀后37 ℃水浴反应10 min,采用酶标仪(Sunrise RC TS TC,奥地利Tecan公司)于593 nm测定吸光度,并以FeSO4·7H2O标准溶液绘制标准曲线。MDA含量采用总蛋白和MDA试剂盒进行测定,用酶标仪分别于562 nm及532 nm处测定吸光度并根据FeSO4·7H2O标准曲线计算含量。
植物样品真空冷冻干燥48 h,取出后加液氮研磨制成粉末。植物干样经湿法消解[30]后采用电感耦合等离子体原子发射光谱仪(ICP-AES)对植物体内Fe和Mn元素进行测定,具体操作如下:称取0.05 g冻干植物样品粉末放于50 mL锥形瓶中,加入8 mL H2SO4和2 mL H2O2,混匀并置于通风橱内,在室温下冷消解过夜,置于通风橱内的消化炉上,保持170 ℃至溶液无色透明;升温至220 ℃至溶液蒸发近干,冷却并定容至10 mL,过滤后用ICP-AES对Fe和Mn进行测定分析。
1.5 植物及土壤中PAHs的提取与测定
称取0.05 g植物干样,装入25 mL玻璃离心管中,加注0.5 mL 2.5 mg/kg芘的丙酮溶液作为内标。向玻璃离心管中加入6 mL混合提取液(正己烷/二氯甲烷=1/1,/),在25 ℃避光条件下以200 r/min振荡提取2 h,并于0 ℃冰水浴超声萃取30 min,取出后以4 000 r/min离心25 min,转移上清液,上述步骤重复3次。将3次植物提取液混合,在40 ℃下旋转蒸发浓缩至2 mL,将浓缩液转移并通过固相萃取柱(SPE柱),SPE柱从下至上依次填充玻璃纤维筛板、0.5 g无水硫酸钠、1.0 g改性磺化硅胶、1.0 g无水硫酸钠、玻璃纤维筛板,并预先由5 mL二氯甲烷和5 mL正己烷活化。提取液通过SPE柱后以15 mL混合淋洗液(正己烷/二氯甲烷=1/1,/)将菲与芘(内标物质)从柱中进行洗脱。收集淋洗液并在40 ℃下旋转蒸发至干,用二氯甲烷复溶并定容至终体积1 mL,使用气相色谱–质谱联用仪(GC-MS)分析提取液中菲和芘的浓度。土壤样品使用外标法测定,称取量为0.2 g,并用二氯甲烷作为提取剂,提取步骤与植物样品相同。植物和土壤样品的回收率分别为73.9% ~ 112.9% 和90.3% ~ 101.4%。
根据Reid等[31]和Gao等[32]的方法,对采收后各处理组土壤中菲进行分形态提取测定。
解吸态:取0.2 g土壤样品于25 mL玻璃离心管中,加入8 mL 提取液(超纯水配置,50 mmol/L含0.05% NaN3的羟丙基-β-环糊精溶液),避光在25 ℃下200 r/min振荡12 h,4 000 r/min离心25 min。取上清液5 mL加入3 mL二氯甲烷,200 r/min振荡2 h后,取1 mL上层有机相过无水硫酸钠和0.22 μm有机滤膜,用GC-MS进行测定分析。
非解吸态:将解吸态提取后的下层土样用15 mL超纯水涡旋清洗10 s,再次离心分离,共进行两次。将土壤颗粒真空冻干,然后加入5 mL混合提取剂(二氯甲烷/丙酮=1/1,/),超声提取30 min,通过离心将有机相转移到旋蒸瓶中,重新加入混合提取剂,重复2次。旋转蒸发至干,用二氯甲烷定容至1 mL,过无水硫酸钠和0.22 μm有机滤膜净化,用GC-MS进行测定分析。
结合残余态:将非解吸态提取后的下层土样风干,加入10 mL 2 mol/L的氢氧化钠溶液,100 ℃水浴2 h后去除冷却,然后离心并取上清液,加入6 mol/L的盐酸溶液至混合液pH<2.0,冷却至室温,加入5 mL二氯甲烷后超声30 min进行液–液萃取,取2 mL有机相旋转蒸发至干,用二氯甲烷定容至1 mL,过无水硫酸钠和0.22 μm有机滤膜净化,用GC-MS进行测定分析。
气相色谱–质谱联用仪分析条件:SH-Rxi-5SiL MS(30 m × 0.25 mm × 0.25 μm)色谱柱,250 ℃进口温度,不分流进样;1 min进样时间,1.00 mL/min柱流量。程序升温如下:初始温度60 ℃;以 10℃/min升至260 ℃并保持1 min,再以 15℃/min升至300 ℃并保持 3 min。质谱条件离子源:电子轰击离子源,200 ℃离子源温度,250 ℃接口温度,离子扫描(SIM)模式,菲与芘的定量离子分别确定为178与202。
1.6 生物富集因子和转移系数计算
地下部分生物富集因子(RCF)可以表明植物地下部分对土壤中污染物吸收富集能力的强弱,转移系数(TF)是植物地上部分和地下部分污染物的含量比值,对RCF与TF的计算有助于我们更全面地评价材料对土壤菲在植物中吸收积累量的影响。本试验中RCF采用Khan等[33]的方法进行计算,TF采用Bose和Bhattacharyya[34]的方法进行计算:

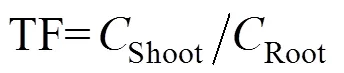
1.7 质量控制和统计分析
土壤及植物各指标数据结果均以均值 ± 标准差表示,采用Excel 2019和Origin 2017进行数据处理及作图,采用SPSS 26.0构建一般线性模型并用Duncan法进行显著性分析,以<0.05为判断显著差异的标准。
2 结果与讨论
2.1 材料表面元素组成
本研究制备的nZVIBC中粒径小于100 nm的颗粒占比为44.1%,达到纳米材料尺度范围(1 ~ 100 nm)。nZVIBC、nZVI及nBC含Fe量分别为57.7%、83.0% 和13.5%,与制备过程中的材料投加比例相符。实验室的前期研究对材料的形貌进行了测量与表征[27],本研究对3种材料的XPS谱图进行了比较,进一步探讨材料中元素形态占比对材料功能及安全性的影响。图1显示了3种材料的XPS谱图,结合能为706.6、710.5和712.5 eV处的峰表明Fe0、Fe2+和Fe3+的存在[35-36](图1A);位于530.0、531.4、532.0和533.2 eV处的峰分别代表Fe-O、Fe-OH、C-O和C=O[37-38](图1B);位于284.7、286.0和288.0 eV处的峰表明C-C、C-O和C=O的存在(图1C)。结果显示,在nZVI的Fe 2p轨道中,Fe2+的特征峰面积的相对占比为83.3%,并未出现Fe0的特征峰,而在nZVIBC 中Fe0的峰面积相对占比为19.6%。这一现象表明nZVI表面的Fe0在制备或储存过程中会被氧化为Fe2+,同时小尺寸ZVI的强聚集特性增强了核壳间及颗粒间Fe0与Fe2+的电子传递,导致颗粒表面Fe0近乎全部氧化[39],使Fe在材料表面以Fe2+的氧化物为主要存在形式。而在nZVIBC中,通过与nBC共球磨负载到其孔隙结构间的nZVI颗粒在团聚性与电子传递能力上都有了明显的降低,这有利于Fe0在环境中稳定存在并有效发挥其在污染物降解中的优势[40]。另外,在O1s范围内仅nZVI检测到Fe-O峰(67.4%),进一步证明了nZVI在nZVIBC中能够更稳定地存在。

图1 nZVI、nZVIBC和nBC在Fe 2p(A)、O 1s(B)和C 1s(C)轨道的XPS谱图
2.2 铁碳复合材料对土壤理化性质的影响
本研究中3种材料添加到土壤后,对苋菜种植75 d时根际土壤理化性质进行检测(表2)。相对PP-CK组,添加nZVIBC、nZVI和nBC均使苋菜根际土壤pH升高,由6.85分别增至6.96、7.13和7.01,其中nZVI组pH最高(<0.05);nBC施入土壤后使土壤总有机碳含量显著增加了38.00%(<0.05)。Mar Gil-Díaz等[41]和Alkan等[42]研究表明,在土壤孔隙水中nZVI与氧气和水发生热力学反应会产生OH–,提高土壤pH;nZVI氧化溶解形成的Fe2+可以进一步水解消耗H+并产生OH–。此外,Wang等[43]报道了BC的石灰效应,即生物质炭中有机阴离子的脱羧作用会消耗质子,从而造成土壤pH的升高。
2.3 铁碳复合材料对根际土壤菲生物可利用性的影响
盆栽试验经过75 d后,PP-CK与PU-CK组土壤中残留菲含量仅有0.505 mg/kg和0.717 mg/kg(图2A)。这是由于菲具有挥发性,可以向大气迁移,同时残留在土壤中的菲会被微生物和植物吸收累积或降解。PP-nZVI组土壤菲残留量与PP-CK组差异不显著,而PP-nZVIBC和PP-nBC组中的菲的残留量是PP-CK的8.59倍和15.0倍(<0.05)。这说明nZVIBC和nBC的添加可以吸附固定菲,这一结果和Chiou等[44]的研究一致。Zhang等[45]认为BC官能团中的π电子会通过π-π作用与PAHs本身芳环中的π电子相互结合;吴成等[46]的研究表明PAHs进入BC细小孔隙后会被限制迁移。在无污染组的比较中(图2B),发现nZVIBC和nBC添加组土壤菲含量显著高于CK和nZVI组(<0.05),这与nBC对大气中菲的吸附作用或nBC自身带入的多环芳烃有关[47]。这也解释了PU-nZVIBC和PU-nBC组菲含量超过初始菲污染浓度的现象(图2A)。种植苋菜的盆栽组,土壤中菲的含量降低,尤其是添加nZVIBC和nBC的处理差异显著(<0.05),PP-CK、PP-nZVIBC、PP-nZVI和PP-nBC组的土壤中菲含量与无植物组相比分别降低29.63%、47.42%、57.07% 和20.04%(图2A)。表明种植苋菜会促进菲在土壤中的迁移转化,降低土壤中菲的固定量,这一结果与Kipopoulou等[48]的研究结果类似。这主要是因为植物根系的作用,苋菜能够通过根系吸收土壤中的菲,并在体内累积;此外,植物的根系为微生物提供了良好的附着场所,根系分泌的低分子量有机酸能够促进PAHs结合残余态的释放[49]和根际微生物的生长[50-51],有利于土壤中菲通过微生物降解和植物吸收等方式降解转化。

表2 不同处理组土壤理化性质
注:表中同行数据小写字母不同表示处理间差异达<0.05显著水平。

(A、B为土壤残留菲总量;C、D为3种形态菲占比。图中小写字母不同表示处理间差异达P<0.05显著水平,下同)
土壤中菲的形态占比可以反映其生物可利用性,其主要有3种赋存形态,分别为解吸态、非解吸态和结合残余态,其生物可利用性依次降低。在PP-CK组中,菲3种形态所占比例分别为50.4%、25.0% 和24.6%(图2C)。当nZVIBC和nBC添加后,土壤中菲的非解吸态比例显著增加(图2C、2D,<0.05),PP-nZVIBC和PU-nZVIBC组非解吸态的占比分别提高了41.1% 和26.6%,PP-nBC和PU-nBC组非解吸态的占比分别提高了46.3% 和35.9%,nZVI添加的影响不显著。非解吸态菲难以被生物利用,表明nZVIBC和nBC的添加降低了土壤中菲的生物有效性。
2.4 铁碳复合材料对苋菜生物量的影响
图3为铁碳复合材料处理对苋菜生物量的影响。PP-CK、PP-nZVIBC、PP-nZVI和PP-nBC组苋菜鲜生物量分别为4.16、1.84、1.97和5.71 g/plant,与无污染土壤中相同材料投加组相比,分别提高87.6%、144%、180%和18.6%,除nBC组外均差异显著(<0.05)(图3A)。除PP-nBC组地下部分鲜生物量略有减少,各污染组地下部分和地上部分与无污染组相比均表现出一定的增加,增幅为26.7% ~ 177%(图3B)。该结果与洪有为和袁东星[52]的研究结果一致,低浓度多环芳烃在土壤暴露中可以刺激植物根系活力,促进植物地上及地下部分的增长。
对不同添加材料进行比较,PP-nZVIBC和PP-nZVI组的苋菜鲜生物量比PP-CK组显著减少了55.7% 和52.6%,而PP-nBC组显著增加了37.3% (<0.05)(图3A),无污染组也具有相同趋势。这表明nZVI的添加对苋菜的生长造成了不利影响。前人研究已证实了nZVI的生物毒害效应,Wang等[53]发现nZVI会吸附在根系表面进而影响营养元素的吸收和转运;Ma等[9]提出nZVI可以直接进入植物根部细胞对其造成损伤;Wu等[54]的研究表明,nZVI会引起细胞内活性氧物质的增加,造成脂质过氧化、蛋白质变性或线粒体受损等严重损伤。在nZVIBC组成物质中,虽然nBC可以通过改善土壤理化性质促进植物的生长[15],但其中nZVI对植物的毒害作用较大,这导致nZVIBC的添加表现出对苋菜生物量的抑制。对各处理组苋菜地上部分的比较中发现,nZVI的添加也会使植物地上部分受到胁迫(图3B)。
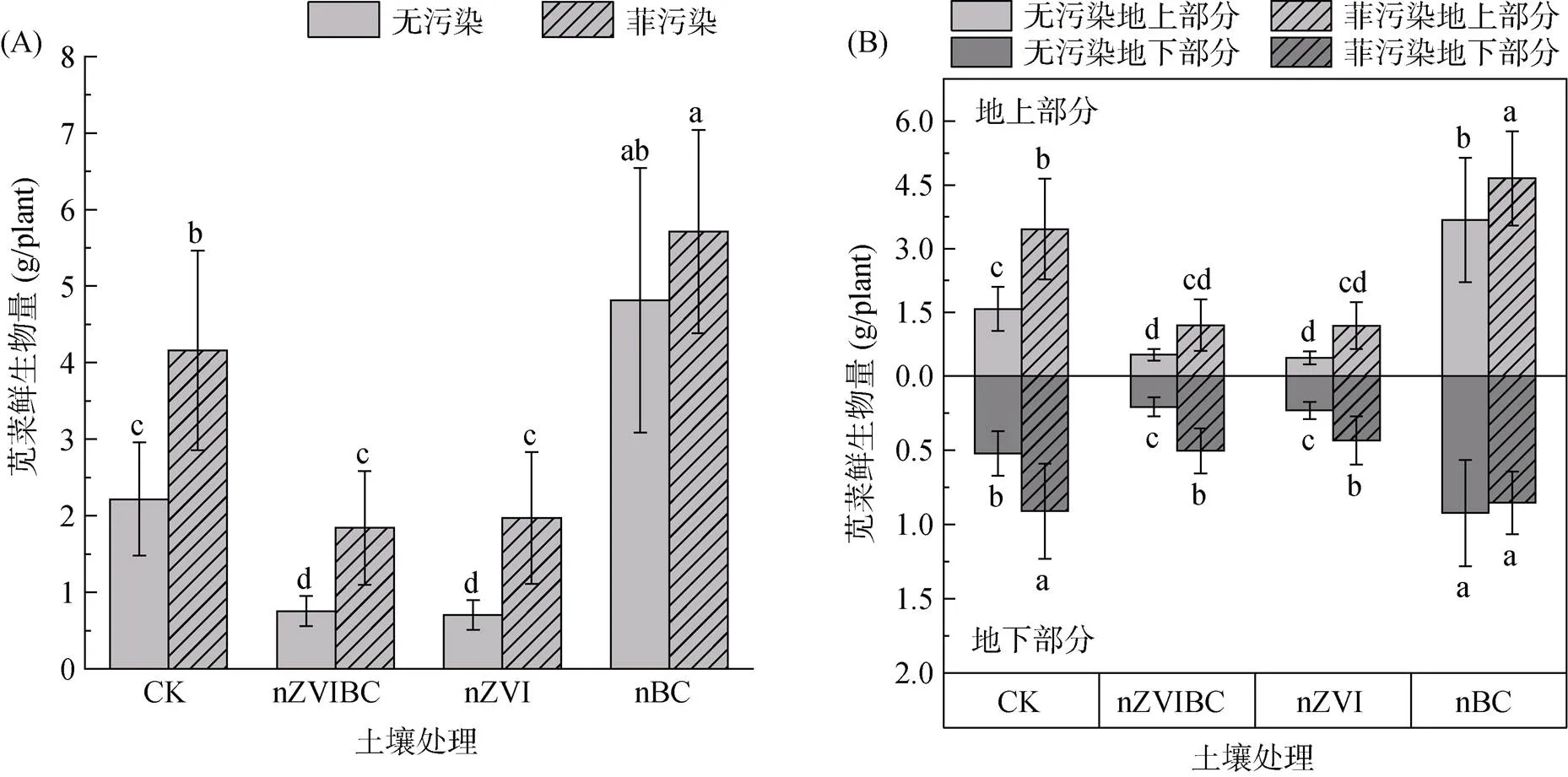
图3 不同处理组苋菜总体(A)与地上、地下部分(B)的鲜生物量
2.5 铁碳复合材料对苋菜菲积累的影响
植物对污染物的吸收累积量能够同时反映污染物归趋和植物生理状况,是考察材料添加造成影响的重要指标。在菲污染处理中,与PP-CK相比,PP-nZVIBC组和PP-nBC组菲在苋菜中的含量分别显著增加了42.9% 和79.2%(<0.05),而PP-nZVI组无显著性差异(图4A)。通过对苋菜RCF的计算(图4B),发现PP-nZVIBC组和PP-nBC组的RCF分别为0.58和0.63,仅为PP-CK组(4.05)的14.3% 和15.6%,而PP-nZVI组与PP-CK组无显著性差异。nZVIBC和nBC的添加可以通过促进菲由解吸态向非解吸态转化的方式降低其生物有效性(图2),从而表现为RCF的显著降低(<0.05)。被BC固定的菲难以挥发迁移或降解转化,在PP-nZVIBC和PP-nBC盆栽土壤中长期大量残留,即使RCF较低也能够被植物大量吸收积累。对各处理组土壤和地下部分菲含量的对比显示,菲在盆栽土壤中残留量与其在植物体内积累量具有正相关,表明nZVIBC中的BC部分会增加土壤菲的残留量,进而造成植物体内菲含量的增加,nZVI对植物体内菲含量无显著影响。
无污染处理组中,各组苋菜地上部分菲含量无显著性差异,且平均含量较低,仅有0.538 mg/kg,推测主要从空气中吸收。此外,在无污染组中,各材料添加组中植物地下部分菲的含量均显著高于其在地上部分的含量(<0.05)。前人已开展诸多有关PAHs在植物体内纵向运输的研究,Wild等[55]提出PAHs在植物体内的纵向运输主要依赖于植物体内自下而上的蒸腾流。PAHs在植物根系暴露56 d后很难由根尖转运到达根基[56],有研究表明在土壤菲暴露下仅2% 的红车轴草地上部分检测出菲[57],以上研究均表明PAHs在植物体内纵向转运能力较弱,本试验结果也符合这一结论。

(B图中散点图上方不同小写字母表示土壤处理间生物富集系数差异达P<0.05显著水平)
污染土壤中的菲会向大气中挥发迁移,并能够在无污染组土壤中积累(图2B)进而通过叶面或根际在植物体内积累。CP-nZVIBC和CP-nBC组中nBC对大气中PAHs的强吸附能力造成其土壤菲残留量相比CP-CK组显著增加(图2),这也导致其地下部分菲含量(1.65和1.52 mg/kg)显著增加(<0.05)。由于菲在植物体内纵向转运能力较弱,无污染组植物地上部分的菲主要来源于叶面吸收,各无污染处理组间大气菲浓度相近,故各组地上部分菲含量无显著性差异。
2.6 铁碳复合材料对苋菜营养元素含量的影响
Fe和Mn是植物体内两种基本元素,Mn是光合蛋白和线粒体超氧化物歧化酶的重要组成元素,在植物抗氧化系统中发挥着重要作用[58-59]。Fe参与了植物体内众多与氧化还原平衡相关的代谢过程,是植物体维持正常生理功能必需的微量元素。对Fe和Mn含量的测定有助于了解植物体在胁迫下发生的生理功能及抗氧化能力的变化。
在植物体内Fe含量的比较中(图5A),仅PP-CK组地上部分与CP-CK相比显著增加了75.1% (<0.05),而其余同一材料添加菲污染组和无污染组相比均无显著性差异,这表明土壤菲暴露对苋菜中Fe的吸收积累影响较小。苋菜根中,PP-nZVIBC、PP-nZVI和PP-nBC组的Fe含量分别为488、558和205 mg/kg,其中,PP-nZVIBC和PP-nZVI组较PP-CK组提高41.95%、62.10%,而PP-nBC较PP-CK组降低40.43%。nZVIBC添加到土壤后,nZVI氧化释放Fe2+在土壤中形成高Fe环境,使植物体内Fe含量超过正常范围(6 ~ 600 mg/kg)[60],因此nZVIBC和nZVI添加的试验组中植株相比其他处理组较矮小,生物量较低(图3A)。
在植物体内Mn含量的比较中(图5B),PP-nZVIBC、PP-nZVI和PP-nBC组地上和地下部分Mn含量较PP-CK组显著降低74.86% ~ 51.67% (<0.05)。与无污染组相比,仅nZVIBC的添加会造成显著性差异,PP-nZVIBC组的地上与地下部分Mn含量分别增加71.02% 和86.15%(<0.05)。这表明nZVIBC的添加抑制植物体吸收和积累Mn,而菲在nZVIBC添加的条件下能够促进Mn元素在植株体内的累积,也有研究报道Fe、Mn之间存在强烈的相互作用[61],Fe供应水平的增加会减少Mn的吸收和累积[62]。
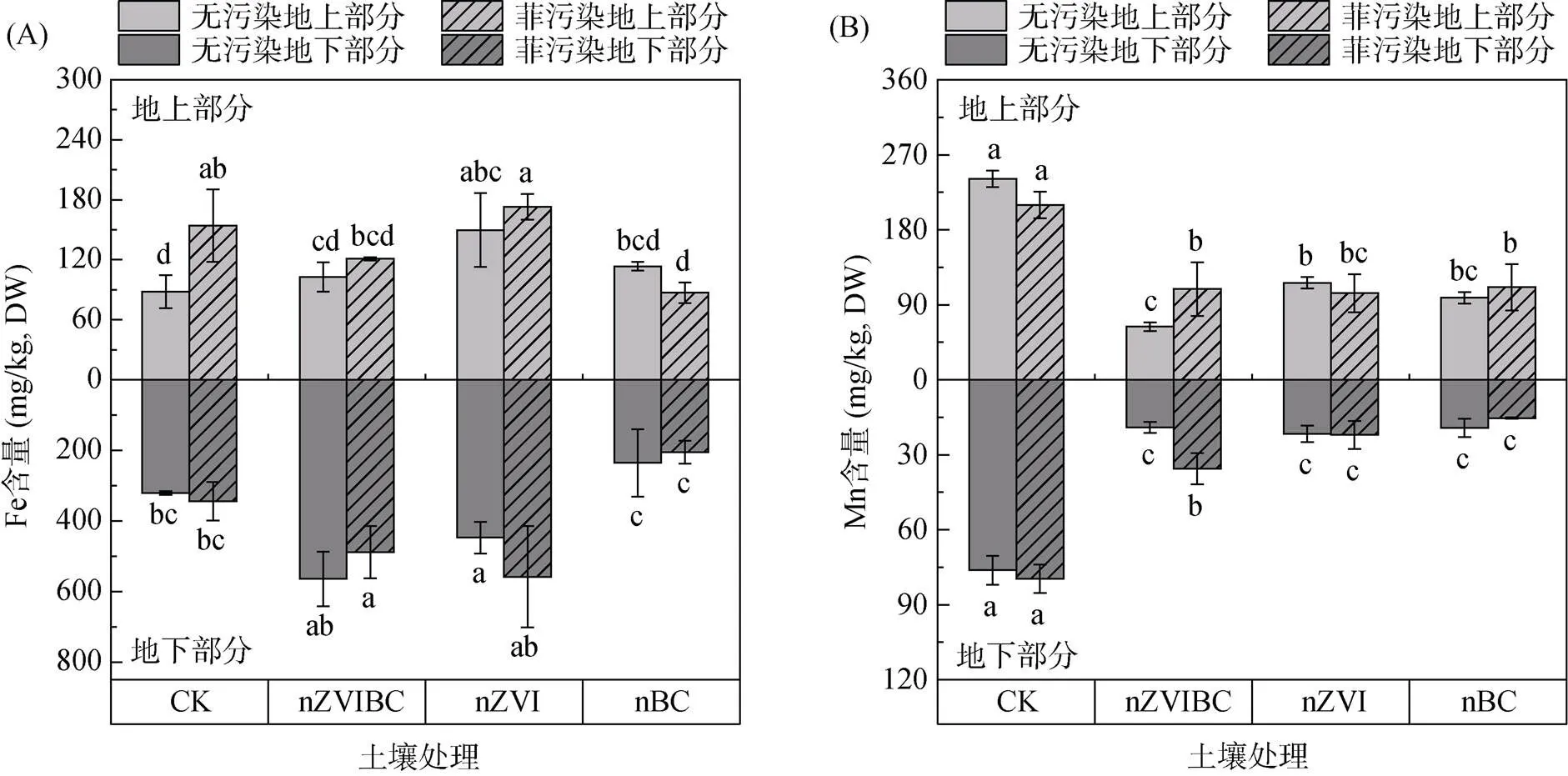
图5 不同处理苋菜地上及地下部分的Fe(A)、Mn(B)含量
此外,有研究[63]表明植物自身具有一定的抗逆性,能够将过量吸收的Fe积累或分隔在地下部分以减弱其对地上部分的毒性,维持地上部分的正常生理功能;而Mn作为植物体内的必需元素,在吸收积累量减少的情况下也会被迅速大量地向地上部分传输。本研究中出现了类似的结果,含有nZVI的处理组地下部分与地上部分相比都有较高的Fe含量;而Mn的总吸收量虽然有显著降低,地上部分含量却高于地下部分。
2.7 铁碳复合材料对苋菜抗氧化能力的影响
FRAP法是利用待测物中亚铁离子与TPTZ生成蓝紫色复合物的原理来测定样品抗氧化能力的方法[29],其值的改变表明植物体内氧化还原平衡的改变。MDA是植物体受到氧化胁迫后,生物膜中脂质过氧化的主要产物,其含量高低可以用来表示植物体膜损伤的程度[64]。菲和添加材料的土壤暴露都会引起植物的氧化应激。PP-nZVI组地上部分FRAP值相比CP-nZVI组降低了10.7%,而其余菲污染组地上部分FRAP值均增加,增加量为40.8% ~ 59.5%。在地下部分的对比中,PP-CK、PP-nZVIBC、PP-nZVI和PP-nBC与无污染处理相比变化幅度分别为27.5%、30.3%、1.95% 和–17.2%,差异不显著。这表明在本研究浓度下菲的胁迫会在一定程度上影响植物的抗氧化能力,引起植物的氧化应激。菲对植物地上和地下部分造成的氧化胁迫呈现出相同的趋势。土壤菲能够挥发进入大气[65],导致植株地上部分通过对菲的叶面吸收积累量增加(图4),从而造成自身的氧化损伤。
CP-nZVI组地上部分FRAP值(3.86 TE/g, FW)较CP-CK组(2.46 TE/g, FW)显著提高了57.2%(<0.05) (图6A)。在地下部分无污染处理组中,CP-nZVI组和CP-nBC组FRAP值(0.48、0.52 TE/gFW)与CK组(0.29 TE/gFW)相比分别提高了61.7% 和77.8%(<0.05)。有研究表明,nZVI和nBC都能够对植物根系造成一定的损伤[66-67]并引起地下部分抗氧化能力的增加。Aguirre和Culotta[61]提出Fe与Mn在植物体内可以分别看作相互拮抗的氧化物与抗氧化物。本研究中,nZVI的添加提高了植物地上地下部分的Fe含量并显著降低了Mn含量(图5A),进而造成植物地上部分的氧化应激,但对生物膜的损伤有限。而在植物地上部分中,相同投加量的nZVIBC没有造成CP-nZVIBC组Fe含量的显著增加(图5A),因此并未给植物地上部分带来显著的氧化损伤。而在PP-CK及PP-nBC组地上部分抗氧化能力增强的同时发现MDA活性降低。

图6 不同处理苋菜地上、地下部分的FRAP(A)和MDA(B)含量
3 结论
nZVIBC添加到菲污染土壤后,一方面能够将菲有效固定在土壤中,降低其生物有效性;另一方面也会影响苋菜对Fe、Mn元素的吸收并带来一定的氧化损伤。nZVIBC的添加提高了菲污染土壤中的有机碳含量,增加了菲在土壤中的固定量及非解吸态比例,可以降低苋菜地下部分对土壤菲的生物富集系数,从而有效抑制土壤菲的迁移转化,对菲在土壤中的原位修复带来积极影响。然而,nZVIBC的添加也造成了植物体内Fe含量的增加和Mn含量的减少,且大量菲在土壤中的固定会导致其在植物体内吸收积累量的增加,最终植物体内过量积累的Fe和菲共同作用对植物体造成了一定程度的氧化胁迫,带来一定毒害效应,导致其鲜生物量的降低。nZVIBC添加到菲污染土壤后两种组分发挥了不同作用,其反应活性主要来自nZVI,会对土壤pH及植物对营养元素的吸收累积造成影响;nBC作为nZVI的负载物,具有吸附污染物和稳定nZVI的作用,添加到土壤后会增加土壤碳质含量并引起土壤菲含量和形态的改变。
[1] Włóka D, Placek A, Rorat A, et al. The evaluation of polycyclic aromatic hydrocarbons (PAHs) biodegradation kinetics in soil amended with organic fertilizers and bulking agents[J]. Ecotoxicology and Environmental Safety, 2017, 145: 161–168.
[2] Sun Z Y, Wang X H, Liu C, et al. Persistent free radicals from low-molecular-weight organic compounds enhance cross-coupling reactions and toxicity of anthracene on amorphous silica surfaces under light[J]. Environmental Science & Technology, 2021, 55(6): 3716–3726.
[3] 倪妮, 宋洋, 王芳, 等. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 53(3): 561–571.
[4] 高园园, 周启星. 纳米零价铁在污染土壤修复中的应用与展望[J]. 农业环境科学学报, 2013, 32(3): 418–425.
[5] Kim C, Ahn J Y, Kim T Y, et al. Activation of persulfate by nanosized zero-valent iron (NZVI): Mechanisms and transformation products of NZVI[J]. Environmental Science & Technology, 2018, 52(6): 3625–3633.
[6] Wang A Q, Chen Z, Zheng Z K, et al. Remarkably enhanced sulfate radical-based photo-Fenton-like degradation of levofloxacin using the reduced mesoporous[email protected]xmicrospheres[J]. Chemical Engineering Journal, 2020, 379: 122340.
[7] Mu Y, Jia F L, Ai Z H, et al. Iron oxide shell mediated environmental remediation properties of nano zero-valent iron[J]. Environmental Science: Nano, 2017, 4(1): 27–45.
[8] 王艳龙, 林道辉. 纳米零价铁与土壤组分的相互作用及其环境效应[J]. 化学进展, 2017, 29(9): 1072–1081.
[9] Ma X M, Gurung A, Deng Y. Phytotoxicity and uptake of nanoscale zero-valent iron (nZVI) by two plant species[J]. Science of the Total Environment, 2013, 443: 844–849.
[10] Su H J, Fang Z Q, Tsang P E, et al. Stabilisation of nanoscale zero-valent iron with biochar for enhanced transport andremediation of hexavalent chromium in soil[J]. Environmental Pollution, 2016, 214: 94–100.
[11] Yan J C, Han L, Gao W G, et al. Biochar supported nanoscale zerovalent iron composite used as persulfate activator for removing trichloroethylene[J]. Bioresource Technology, 2015, 175: 269–274.
[12] Cao X D, Ma L N, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology, 2009, 43(9): 3285–3291.
[13] Woolf D, Amonette J E, Street-Perrott F A, et al. Sustainable biochar to mitigate global climate change[J]. Nature Communications, 2010, 1: 56.
[14] Ma X D, Ouyang F. Adsorption properties of biomass-based activated carbon prepared with spent coffee grounds and pomelo skin by phosphoric acid activation[J]. Applied Surface Science, 2013, 268: 566–570.
[15] Melo T M, Bottlinger M, Schulz E, et al. Plant and soil responses to hydrothermally converted sewage sludge (sewchar)[J]. Chemosphere, 2018, 206: 338–348.
[16] Gul S, Whalen J K, Thomas B W, et al. Physico-chemical properties and microbial responses in biochar-amended soils: Mechanisms and future directions[J]. Agriculture, Ecosystems & Environment, 2015, 206: 46–59.
[17] 李桥, 高屿涛, 姜蔚, 等. 紫外辐照改性生物炭对土壤中Cd的稳定化效果[J]. 环境工程学报, 2017, 11(10): 5708–5714.
[18] Cho D W, Kim S, Tsang D C W, et al. Contribution of pyrolytic gas medium to the fabrication of co-impregnated biochar[J]. Journal of CO2Utilization, 2018, 26: 476–486.
[19] Gao M L, Chang X P, Xu Y L, et al. Effects of Fe-Mn impregnated biochar on enzymatic activity and bacterial community in phthalate-polluted brown soil planted with wheat[J]. Environmental Pollution, 2021, 284: 117179.
[20] Li X Y, Yu Z, Chen Q C, et al. Kill three birds with one stone: Iron-doped graphitic biochar from biogas residues for ammonium persulfate activation to simultaneously degrade benzo[a]pyrene and improve lettuce growth[J]. Chemical Engineering Journal, 2022, 430: 132844.
[21] Xiang W, Zhang X Y, Chen K Q, et al. Enhanced adsorption performance and governing mechanisms of ball-milled biochar for the removal of volatile organic compounds (VOCs)[J]. Chemical Engineering Journal, 2020, 385: 123842.
[22] Zhou S, Ni X, Zhou H L, et al. Effect of nZVI/biochar nanocomposites on Cd transport in clay mineral-coated quartz sand: Facilitation and rerelease[J]. Ecotoxicology and Environmental Safety, 2021, 228: 112971.
[23] Wang D J, Zhang W, Hao X Z, et al. Transport of biochar particles in saturated granular media: Effects of pyrolysis temperature and particle size[J]. Environmental Science & Technology, 2013, 47(2): 821–828.
[24] Zhou Y Z, Wang T, Zhi D, et al. Applications of nanoscale zero-valent iron and its composites to the removal of antibiotics: A review[J]. Journal of Materials Science, 2019, 54(19): 12171–12188.
[25] Wang S S, Zhao M Y, Zhou M, et al. Biochar-supported nZVI (nZVI/BC) for contaminant removal from soil and water: A critical review[J]. Journal of Hazardous Materials, 2019, 373: 820–834.
[26] 生态环境部. 土壤pH值的测定电位法:HJ962—2018[S]. 北京: 中国环境科学出版社, 2018.
[27] 丁英志. 铁碳纳米复合材料活化过硫酸盐降解对羟基联苯的机制与应用研究[D]. 北京: 中国科学院大学, 2021.
[28] Yang Z C, Yan Y, Yu A Q, et al. Revisiting the phenanthroline and ferrozine colorimetric methods for quantification of Fe(II) in Fenton reactions[J]. Chemical Engineering Journal, 2020, 391: 123592.
[29] Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70–76.
[30] 赵永强, 孙晓薇, 胡岗, 等. 火焰原子吸收法测定木耳中锌、镁、铁、锰的含量[J]. 湖北农业科学, 2012, 51(9): 1872–1873.
[31] Reid B J, Stokes J D, Jones K C, et al. Nonexhaustive cyclodextrin-based extraction technique for the evaluation of PAH bioavailability[J]. Environmental Science & Technology, 2000, 34(15): 3174–3179.
[32] Gao Y Z, Zeng Y C, Shen Q, et al. Fractionation of polycyclic aromatic hydrocarbon residues in soils[J]. Journal of Hazardous Materials, 2009, 172(2/3): 897–903.
[33] Khan S, Lin A J, Zhang S Z, et al. Accumulation of polycyclic aromatic hydrocarbons and heavy metals in lettuce grown in the soils contaminated with long-term wastewater irrigation[J]. Journal of Hazardous Materials, 2008, 152(2): 506–515.
[34] Bose S, Bhattacharyya A K. Heavy metal accumulation in wheat plant grown in soil amended with industrial sludge[J]. Chemosphere, 2008, 70(7): 1264–1272.
[35] Nurmi J T, Tratnyek P G, Sarathy V, et al. Characterization and properties of metallic iron nanoparticles: Spectroscopy, electrochemistry, and kinetics[J]. Environmental Science & Technology, 2005, 39(5): 1221–1230.
[36] Wang J, Shen M, Gong Q, et al. One-step preparation of ZVI-sludge derived biochar without external source of iron and its application on persulfate activation[J]. The Science of the Total Environment, 2020, 714: 136728.
[37] Kim E J, Kim J H, Azad A M, et al. Facile synthesis and characterization of Fe/FeS nanoparticles for environmental applications[J]. ACS Applied Materials & Interfaces, 2011, 3(5): 1457–1462.
[38] Wang W B, Gong T T, Li H, et al. The multi-process reaction model and underlying mechanisms of 2, 4, 6-trichlorophenol removal in lab-scale biochar-microorganism augmented ZVI PRBs and field-scale PRBs performance[J]. Water Research, 2022, 217: 118422.
[39] Zhou Y M, Gao B, Zimmerman A R, et al. Biochar- supported zerovalent iron for removal of various contaminants from aqueous solutions[J]. Bioresource Technology, 2014, 152: 538–542.
[40] Li Z, Sun Y Q, Yang Y, et al. Biochar-supported nanoscale zero-valent iron as an efficient catalyst for organic degradation in groundwater[J]. Journal of Hazardous Materials, 2020, 383: 121240.
[41] Mar Gil-Díaz M, Pérez-Sanz A, Ángeles Vicente M, et al. Immobilisation of Pb and Zn in soils using stabilised zero-valent iron nanoparticles: Effects on soil properties[J]. CLEAN - Soil, Air, Water, 2014, 42(12): 1776–1784.
[42] Alkan M, Demirbaş Ö, Dogˇan M.potential of unexpanded and expanded perlite samples in various electrolyte media[J]. Microporous and Mesoporous Materials, 2005, 84(1/2/3): 192–200.
[43] Wang L, Butterly C R, Wang Y, et al. Effect of crop residue biochar on soil acidity amelioration in strongly acidic tea garden soils[J]. Soil Use and Management, 2014, 30(1): 119–128.
[44] Chiou C T, Peters L J, Freed V H. A physical concept of soil-water equilibria for nonionic organic compounds[J]. Science, 1979, 206(4420): 831–832.
[45] Zhang X K, Sarmah A K, Bolan N S, et al. Effect of aging process on adsorption of diethyl phthalate in soils amended with bamboo biochar[J]. Chemosphere, 2016, 142: 28–34.
[46] 吴成, 张晓丽, 李关宾. 黑碳制备的不同热解温度对其吸附菲的影响[J]. 中国环境科学, 2007, 27(1): 125–128.
[47] Mastral A M, García T, Callén M S, et al. Removal of naphthalene, phenanthrene, and pyrene by sorbents from hot gas[J]. Environmental Science & Technology, 2001, 35(11): 2395–2400.
[48] Kipopoulou A M, Manoli E, Samara C. Bioconcentration of polycyclic aromatic hydrocarbons in vegetables grown in an industrial area[J]. Environmental Pollution, 1999, 106(3): 369–380.
[49] Gao Y Z, Ren L L, Ling W T, et al. Desorption of phenanthrene and pyrene in soils by root exudates[J]. Bioresource Technology, 2010, 101(4): 1159–1165.
[50] Aprill W, Sims R C. Evaluation of the use of prairie grasses for stimulating polycyclic aromatic hydrocarbon treatment in soil[J]. Chemosphere, 1990, 20(1/2): 253–265.
[51] Urana R, Dahiya A, Sharma P, et al. Effects of plant growth promoting rhizobacteria on phytoremediation of phenanthrene contaminated sodic soil[J]. Polycyclic Aromatic Compounds, 2021, 41(5): 1020–1029.
[52] 洪有为, 袁东星. 秋茄()幼苗对菲和荧蒽污染的生理生态效应[J]. 生态学报, 2009, 29(1): 445–455.
[53] Wang J, Fang Z Q, Cheng W, et al. Higher concentrations of nanoscale zero-valent iron (nZVI) in soil induced rice chlorosis due to inhibited active iron transportation[J]. Environmental Pollution, 2016, 210: 338–345.
[54] Wu H H, Yin J J, Wamer W G, et al. Reactive oxygen species-related activities of nano-iron metal and nano-iron oxides[J]. Journal of Food and Drug Analysis, 2014, 22(1): 86–94.
[55] Wild E, Dent J, Thomas G O, et al. Direct observation of organic contaminant uptake, storage, and metabolism within plant roots[J]. Environmental Science & Technology, 2005, 39(10): 3695–3702.
[56] Verkleij J A C, Golan-Goldhirsh A, Antosiewisz D M, et al. Dualities in plant tolerance to pollutants and their uptake and translocation to the upper plant parts[J]. Environmental and Experimental Botany, 2009, 67(1): 10–22.
[57] Chiapusio G, Desalme D, Pujol S, et al. Two biochemical forms of phenanthrene recovered in grassland plants (L. andL.) grown in 3 spiked soils[J]. Plant and Soil, 2011, 344(1): 295–303.
[58] Babcock G T, Wikström M. Oxygen activation and the conservation of energy in cell respiration[J]. Nature, 1992, 356(6367): 301–309.
[59] Åhrling K A, Smith P J, Pace R J. Nature of the Mn centers in photosystem II. modeling and behavior of the= 4 resonances and related signals[J]. Journal of the American Chemical Society, 1998, 120(50): 13202–13214.
[60] Reeves R D, Baker A J M. Metal-accumulating plants//Paskin I, Ensley B D. Phytoremediation of toxic metals[M]. Hoboken, USA: John Wiley & Sons. 2000: 193–229.
[61] Aguirre J D, Culotta V C. Battles with iron: Manganese in oxidative stress protection[J]. The Journal of Biological Chemistry, 2012, 287(17): 13541–13548.
[62] 陈春宏, 张耀栋, 张春兰, 等. 铁、锰相互作用及其对植物生理生化的影响[J]. 土壤肥料, 1992(6): 9–12.
[63] Peiter E, Montanini B, Gobert A, et al. A secretory pathway-localized cation diffusion facilitator confers plant manganese tolerance[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(20): 8532–8537.
[64] Liu C F, Xiao R B, Dai W J, et al. Cadmium accumulation and physiological response ofL. under soil and atmospheric stresses[J]. Environmental Science and Pollution Research International, 2021, 28(11): 14041–14053.
[65] 刘国卿. 珠江三角洲地区多环芳烃的区域地球化学初步研究[D]. 广州: 中国科学院广州地球化学研究所, 2005.
[66] Liu G C, Zheng H, Jiang Z X, et al. Formation and physicochemical characteristics of nano biochar: Insight into chemical and colloidal stability[J]. Environmental Science & Technology, 2018, 52(18): 10369–10379.
[67] Gong X M, Huang D L, Liu Y G, et al. Stabilized nanoscale zerovalent iron mediated cadmium accumulation and oxidative damage of(L.) gaudich cultivated in cadmium contaminated sediments[J]. Environmental Science & Technology, 2017, 51(19): 11308–11316.
Effects of Nanoscale Zero-Valent Iron Biochar on Uptake and Accumulation of Phenanthrene inL.
SHEN Lianzhou1,2, CAI Yue2, SUN Zhaoyue2, PU Lirong2, SHI Weilin1*, GAO Juan2*
(1 School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou, Jiangsu 215009, China; 2 Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
In this study, pot experiments of amaranth were carried out with phenanthrene-polluted soils separately mixed with nanoscale zero-valent iron (nZVI), nanoscale biochar (nBC) and nanoscale zero-valent iron biochar (nZVIBC) to investigate the effects of materials on soil physicochemical properties, amaranth physiological function and the migration and transformation of phenanthrene in soil-plant system. The results indicate that the application of nZVIBC increases the SOM to 1.38 times that of the control group and significantly increases non-desorbing fraction of phenanthrene (by 41.1%), while decreases roots bioconcentration factor of amaranth to phenanthrene (by 85.7%), which evidences the migration capability of soil phenanthrene is inhibited. Nevertheless, the addition of nZVIBC causes the residual amount of soil phenanthrene increase to 8.6 times that of material-free soil and increase the uptake and accumulation of phenanthrene in shoots and roots of amaranth by 42.9% and 37.9%, respectively. In addition, nZVIBC results in a raise of Fe content (42.0%) and a drop of Mn content (74.9%) in roots of amaranth, and finally reduces its fresh biomass significantly (55.8%), which is linked to the oxidative stress due to increased Fe and phenanthrene content. Two components in composite caused different effects, nZVI adversely affects the normal physiological function and antioxidant capacity of amaranth, while nBC induces alterations in SOM and phenanthrene content patterns. As a contamination remediation material of PAHs, nZVIBC effectively decreases the migration and transformation of soil phenanthrene and is suitable for in-situ chemical remediation of soil organic contamination.
PAHs; Bioavailability; Biotoxicity; Migration; Oxidative stress
X53
A
10.13758/j.cnki.tr.2023.04.019
沈连舟, 蔡月, 孙昭玥, 等. 纳米铁–生物质炭复合材料对苋菜吸收累积菲的影响. 土壤, 2023, 55(4): 848–859.
国家自然科学基金项目(41991331)、国家重点研发计划项目(2017YFA0207000)和江苏省重点研发计划(社会发展)面上项目( BE2020789)资助。
(weilin-shi@163.com;juangao@issas.ac.cn)
沈连舟(1998—),男,山东威海人,硕士研究生,主要研究方向为土壤修复理论与技术。E-mail: lianzhou_shen@163.com

