急性温度胁迫对红耳龟消化、免疫功能的影响及维生素E 的干预效应
朱天生,李亦婷,傅丽容 ,史海涛
(海南师范大学生命科学学院,热带岛屿生态学教育部重点实验室,海口 571158)
龟类的生长发育受诸多外界环境因素的影响,水温直接关系其摄食、代谢、生长、发育、繁殖等生命过程。极端的天气现象、台风后养殖池遭雨水入侵、高温运输引起中暑或是引入地和养殖地之间温差过大等原因,均会引起龟鳖的应激反应(曹鑫盛等,2019)。中国急性温度变化多发生于5—10 月,6、7 月尤为集中(Zhanget al.,2015)。急性低温胁迫可对中华鳖Pelodiscus sinensis不同肠段的肠道黏膜结构造成不同程度损伤,导致大肠黏膜的机械屏障功能下降,消化吸收功能减弱(邢潇等,2019),且随着急性温度胁迫的程度加剧和时间延长,中华鳖的血浆抑菌效果和免疫力会降低(申思仙,2018;申思仙等,2018);急性低温胁迫亦可损伤虹鳟Oncorhynchus mykiss肝脏,导致其代谢能力下降(管标等,2014),造成中华鲟Acipenser sinensi(管敏等,2019)、银鲳Pampus argenteus幼鱼(谢明媚等,2015)体内产生大量活性氧自由基,从而造成细胞和组织损伤。冬眠状态下的黄喉拟水龟Mauremys mutica遭受急性高温胁迫时会产生一定程度的氧化损伤(陈威等,2019)。由此可见,急性温度胁迫会严重影响水产动物的体质健康和生长发育。
如何采取有效抗应激措施已引起人们的关注。维生素E(vitamin E,VE),又被称为生育酚、生殖维生素等(王磊,2021),具有抗氧化、提高生育能力、增强免疫力、维持细胞呼吸等多重功能(夏兆飞,2003),常作为免疫佐剂添入饲料中以提高动物的生产性能和抗应激能力。VE在缓解温度应激带来的不利影响方面具有良好效果。饲料中添加适量的VE 可显著提高冷应激下笼养蛋鸭(陈鑫等,2008)和罗非鱼Oreochromis niloticus幼鱼(Xuet al.,2020)的生长性能,增加体重,降低饲料转化率;亦可显著降低日本鹌鹑Coturnix coturnix japonica血清中丙二醛和胆固醇水平(Sahinet al.,2003),在冷胁迫下罗非鱼幼鱼中同样发现VE 显著降低肝脏、肌肉和血清中的丙二醛含量,并伴随超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶、总抗氧化力的显著上升(Xuet al.,2020)。VE 对缓解高温胁迫的作用在禽类养殖中被广泛研究。Calik 等(2022)研究发现,高温应激下VE 与硒连用显著降低了HSPs、TLR2、TNFa、IFNg 等多种与氧化应激、免疫和肠道完整性相关基因的mRNA 丰度,减轻了高温造成的不利影响。Pirgozliev 等(2020)的研究发现,VE 改善了高温应激导致的肝脏和脾脏重量降低,这可能与VE 增加胃肠道中的饲料通过率,进而提高消化酶活性有关。Gouda 等(2020)在饲料中添加200 IU·kg-1VE显著提高了40日龄日本鹌鹑的体重、采食量,降低了饲料转化率,血液总抗氧化能力、过氧化氢酶和超氧化物歧化酶也得到了显著改善。Mazur-Kuśnirek 等(2019)同样报道了饲料添加200 mg·kg-1VE对高温应激ROSS 308肉仔鸡氧化损伤的缓解。在龟鳖动物中,250 mg·kg-1是提高机体抗应激能力的适宜剂量(Zhouet al.,2004;雷金洪等,2022)。
红耳龟Trachemys scripta elegans个体大、生长快、生命力强,因饲养成本低受到养殖户的青睐而被大规模养殖,在国内龟鳖养殖类市场中占据了绝对的数量优势(李韶清,2016;周鹏,2020)。本研究聚焦环境温度急剧升高和降低对红耳龟肠道消化酶和血清抗氧化指标的影响,探索温度急性变化影响龟鳖动物消化功能和免疫功能的作用机理,并采取日粮中添加VE 的干预方式,研究VE 对急性温度变化引起应激反应的防御作用,为龟鳖养殖过程中缓解应激、减少损失提供理论参考和实践指导。
1 材料与方法
1.1 实验材料
红耳龟幼龟购自海南省海口市东山泓旺养殖场,饲养于龟鳖研究室,饲养箱长48 cm×宽36 cm×高21 cm,30 ℃室温下暂养,每2 d 于18∶00 定时投喂1 次,4 h 后清理剩余饲料。所用饲料为佛山市顺德区海皇实业有限公司生产的鳖(甲)鱼配合饲料(表1),将饵料添加少量水和成面团后投喂,投喂量保证每次有剩余。暂养2周,待试验用龟充分适应环境后,挑选健康个体开始试验。

表1 基础日粮主要营养成分及其含量Table 1 Approximate nutritional ingredient and contents of basal diet
1.2 实验设计
选取112 只健康红耳龟幼龟个体,体重为108.58 g±19.06 g,随机均分成未添加VE 组和添加VE 组,每组分为室温组(30 ℃,n=8)、急性高温胁迫组(35 ℃,n=24)和急性低温胁迫组(17 ℃,n=24),组间个体体重差异不显著(P>0.05)。在30 ℃下驯化饲养4 周,胁迫前禁食24 h,将装有幼龟的养殖箱放入恒温培养箱中,使养殖箱中水体温度在2 h内达到胁迫温度。
1.3 处理与采样
室温组直接取样,急性高温胁迫组与急性低温胁迫组分别于达到胁迫温度后0 h、6 h、12 h 采样。每个温度胁迫组随机选取8只幼龟,断颈法迅速处死并采血。血样4 ℃中静置2 h,4 ℃ 3 500 r·min-110 min,取上清液-80 ℃保存。另取适量小肠用SCIENTZ-48高通量组织研磨机制备成10%的组织匀浆,4℃ 10 000 r·min-110 min,取上清液-80 ℃保存。
1.4 消化酶及抗氧化酶活性的测定
试验选用南京建成生物研究所生产的试剂盒,测定血清中的SOD、CAT 活性和谷胱甘肽(GSH)含量,以及组织匀浆上清液中的胃蛋白酶、淀粉酶和脂肪酶活性。具体操作方法严格按照各说明书进行。
1.5 数据处理
实验测得数据用Excel 2010 整理,酶活性均用xˉ±SE 表示。采用F检验各组方差齐性,采用SPSS 19.0进行单因素方差分析,不同处理间多重比较采用LSD 法进行差异显著性检验,并利用Origin 2019b绘图。
2 实验结果
2.1 不同处理对红耳龟肠道消化酶活性的影响
2.1.1 急性温度胁迫对胃蛋白酶活性的影响及VE 的干预效应未添加VE 组中,急性低温胁迫组各时段胃蛋白酶活性与室温组均无显著差异(P>0.05);急性高温胁迫组随胁迫时间延长,胃蛋白酶活性表现为先升后降,6 h 时最高(P<0.01)(图1:A)。
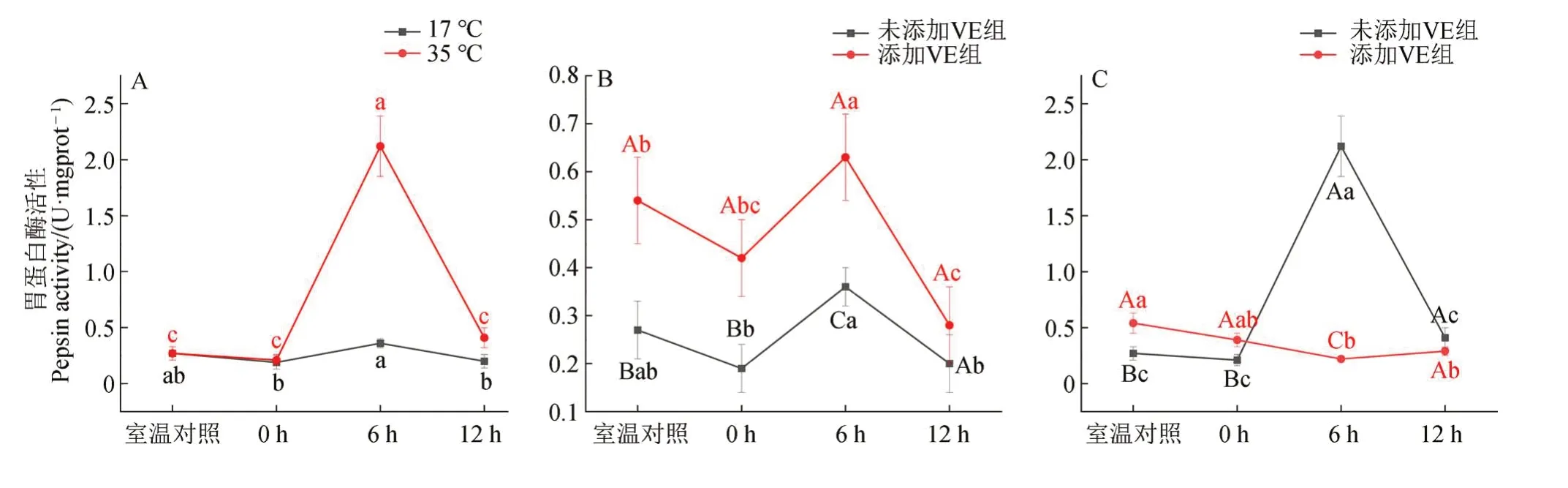
图1 不同处理下红耳龟胃蛋白酶活性Fig. 1 Pepsin activity in Trachemys scripta elegans under different treatment conditions
添加VE 组在室温下的胃蛋白酶活性显著高于未添加VE 组(P<0.05);在急性低温胁迫下的变化与未添加VE 组的趋势一致,随时间增加,呈先上升后下降的趋势,且各时段明显高于未添加VE 组,6 h 时的差异极显著(P<0.01),12 h 时的差异不显著(P>0.05)(图1:B)。在急性高温胁迫下,添加VE 组胃蛋白酶0 h 时的活性高于未添加VE 组(P<0.05),随后下降,各时段变化不明显,添 加VE 组6 h 时未出现突增高 峰(P<0.01)(图1:C)。
2.1.2 急性温度胁迫对淀粉酶活性的影响及VE的干预效应未添加VE 组中,急性低温胁迫组的淀粉酶活性逐渐上升,至12 h 时显著高于室温组;急性高温胁迫组的淀粉酶活性稍有波动,但与室温组间的差异均不显著(P>0.05)(图2:A)。

图2 不同处理下红耳龟淀粉酶活性Fig. 2 Amylase activity in Trachemys scripta elegans under different treatment conditions
添加VE 组的淀粉酶活性在急性低温胁迫下表现为先上升后下降,从30 ℃降温到17 ℃时,活性升至最高(P<0.05),随着胁迫时间延长,活性下降,6 h 后,低于未添加VE 组(P>0.05)(图2:B)。在急性高温胁迫下,添加VE 组的淀粉酶活性先下降后上升,从30 ℃升温到35 ℃时,活性下降,随后逐渐升高,12 h 时显著高于未添加VE 组(P<0.05)(图2:C)。
2.1.3 急性温度胁迫对脂肪酶活性的影响及VE的干预效应在急性低温胁迫过程中,未添加VE组各时段的肠道脂肪酶活性均高于室温组,其中胁迫6 h时的差异显著(P<0.05)。急性高温胁迫组的脂肪酶活性较室温组均略有上升,但差异不显著(P>0.05)(图3:A)。

图3 不同处理下红耳龟脂肪酶活性Fig. 3 Lipase activity in Trachemys scripta elegans under different treatment conditions
急性低温胁迫过程中,添加VE 组的脂肪酶活性变化趋势与未添加VE 组相似,且各时段均低于未添加VE 组,6 h 时的组间差异显著(图3:B)。在急性高温胁迫下,添加VE 组的脂肪酶活性呈上升趋势,均高于未添加VE 组,但差异不显著(P>0.05)(图3:C)。
2.2 不同处理对红耳龟抗氧化功能的影响
2.2.1 急性温度胁迫对SOD活性的影响及VE的干预效应未添加VE 组经过急性低温胁迫和急性高温胁迫处理后的SOD 变化趋势相似,均表现为先上升后下降(图4:A)。急性低温胁迫组各时段的SOD 活性均与室温组的差异不显著。急性高温胁迫组从开始至胁迫12 h,SOD 活性均显著高于室温组(P<0.05),6 h 后稍有下降,但仍高于室温组。

图4 不同处理下红耳龟超氧化物歧化酶活性Fig. 4 Superoxide dismutase (SOD) activity in Trachemys scripta elegans under different treatment conditions
添加VE 组的SOD 活性在急性低温胁迫和急性高温胁迫下略低于未添加VE 组,急性低温胁迫下的组间差异不显著(P>0.05);急性高温胁迫下,SOD 活性在0 h 和6 h 时,添加VE 组显著低于未添加VE组(P<0.05)(图4:B,C)。
2.2.2 急性温度胁迫对血清CAT 活性的影响及VE 的干预效应同一急性温度处理内未添加VE组的血清CAT 活性稍有波动,但相互间无显著差异(P>0.05)(图5:A)。急性低温、高温胁迫下添加VE 组的CAT 活性均略高于不添加VE 组,差异不显著(P>0.05)(图5:B,C)。
2.2.3 急性温度胁迫对GSH 含量影响及VE 的干预效应未添加VE组在急性低温、高温胁迫下,GSH 含量均明显低于室温组(P<0.05)(图6:A)。在室温下,添加VE 组的GSH 含量显著低于未添加VE 组(P<0.05),急性低温胁迫导致添加VE 组的GSH 含量上升,且接近未添加VE 组,至无显著差异(P>0.05)(图6:B);急性高温胁迫6 h 时,添加VE 组的GSH 含量上升,显著高于未添加VE 组(P<0.05),胁迫12 h 下降,显著低于未添加VE 组(P<0.05)(图6:C)。

图6 不同处理下红耳龟血清中的谷胱甘肽含量Fig. 6 Glutathione (GSH) content in the serum of Trachemys scripta elegans under different treatment conditions
3 讨论
3.1 急性温度胁迫对红耳龟消化酶活性的影响及VE的干预效应
养殖温度的急剧变化深刻影响着动物体的各项生理机能(Zhouet al.,2010)。急性低温胁迫可降低水产动物的摄食量和酶活性,亦可导致肝脏损伤和生长相关基因表达下降,从而降低代谢速率和生长速度(管标等,2014;刘玲等,2018);急性高温胁迫可使体内酶失活,摄食量不稳定,破坏消化、排泄系统,进而影响正常生理功能(刘玲等,2018;张晨光等,2021)。管敏等(2019)的研究发现,急性低温胁迫导致中华鲟子二代个体肠道淀粉酶活性显著降低,而脂肪酶和胃蛋白酶活性没有显著变化。本研究中,急性低温胁迫使红耳龟的肠道脂肪酶和淀粉酶的活性升高,并分别在胁迫6 h 和12 h 时达到显著差异水平。红耳龟的温度耐受性较强(李贵生,唐大由,2001),推测其在受到急性低温胁迫时,机体淀粉酶和脂肪酶活性上调,增强了糖类和脂类的氧化分解,从而保证能量供应。虽然急性低温胁迫过程中胃蛋白酶活性与室温组间始终无显著差异,但胁迫6 h 时酶活性显著高于胁迫0 h 和12 h,提示急性低温亦可能影响胃蛋白酶活性。张晨光等(2021)报道,急性高温胁迫6 h 时,翘嘴鳜Siniperca chuatsi幼鱼胃蛋白酶活性显著降低,脂肪酶活性显著升高,而淀粉酶活性没有变化,但在胁迫48 h 后,胃蛋白酶和淀粉酶的活性显著升高,脂肪酶活性显著降低。本研究结果表明,红耳龟胃蛋白酶活性在急性高温胁迫6 h 较室温组有极显著升高,12 h 又恢复到室温水平。刘丹(2011)报道红耳龟幼龟偏好动物性食物,且饲料中蛋白质占比较高,据此推测胃蛋白酶活性的增强更利于其消化食物和提供能量以应对环境胁迫。淀粉酶和脂肪酶活性在急性高温胁迫下无显著变化,可能是其在应对此胁迫中不起主要作用,也可能由于胁迫周期较短未能观察到之后的变化。
VE 可通过提高动物采食量和饲料利用率、增强肠道生长发育、提高消化酶活性等途径提高生长性能(罗辉,2006)。日粮添加VE 后,中华鳖的抗应激能力有所提高,机体生长加快(周显青等,2003;Zhouet al.,2004)。雷金洪等(2021)研究发现,长期高温胁迫下饲料添加VE 可显著提高红耳龟胃蛋白酶活性,抑制脂肪酶活性,并提高特定生长率。本研究中急性低温胁迫下,饲料添加VE 组的蛋白酶活性显著升高,而脂肪酶活性则有降低的趋势,提示在应对急性低温胁迫时,VE可通过增强红耳龟的蛋白质消化吸收增加能量供给。Liu等(2019)在对七彩鱼Symphysodon haraldi的研究中同样观察到添加VE 组胃蛋白酶的升高和脂肪酶的降低;He 等(2017)报道,饲料添加50 mg·kg-1或100 mg·kg-1VE 能显著提高斑点叉尾Ictalurus punctatus的脂肪酶活性。这可能是不同物种对膳食中VE 的响应机制不同,导致消化酶活性的具体变化不一致。面临急性高温胁迫时,添加VE 组的胃蛋白酶活性极显著低于未添加VE 组,淀粉酶活性显著高于未添加VE 组,脂肪酶活性较室温组显著升高,推测受急性高温胁迫时,VE提高了红耳龟肠道淀粉酶和脂肪酶在抗应激中的作用,减少了蛋白质的损耗。这与雷金洪等(2021)的实验结果不同,可能是急性胁迫和长期胁迫机体供能机制有所不同,在长期高温应激下VE 能持续有效保护和修复红耳龟受损肠道,加强绒毛上皮细胞吸收,而以提高饲料中蛋白质利用率的方式提供更多能量以适应长期高温胁迫(罗辉,2006)。就消化酶而言,急性高、低温度胁迫造成的生理影响不同,饲喂VE 的改善效果与作用方式亦不同,其机理有待进一步研究。
3.2 急性温度胁迫对红耳龟抗氧化功能的影响及VE干预效应
抗氧化酶是生物体内保护预防相关的酶类,机体内的CAT 和SOD 活力能够反映出机体清除自由基的能力(洪美玲等,2007)。外界温度突然变化会引起龟鳖类动物的应激反应,刺激其体内的活性氧增多(Zhanget al.,2017)。面对急性高温胁迫,黄喉拟水龟北种群组织中SOD 活力升高,过氧化氢酶活力不受温度处理影响(陈威等,2019),与本研究结果相似,故推测,面对急性高温胁迫,CAT可能在清除自由基的过程中不起主导作用,而SOD对缓解急性高温应激较为重要。在急性低温胁迫下,红耳龟的SOD 和CAT 活性均无显著变化,但CAT 活性出现下降趋势(P>0.05),可能是低温对CAT 活性有一定的抑制作用。而管敏等(2019)研究报道,急性低温胁迫造成子二代中华鲟的CAT活性显著升高,但SOD 活性无显著变化,可能是实验物种的不同导致了反应模式存在差异(Mourenteet al.,2002)。本研究中未添加VE 组的GSH 含量在急性高、低温度胁迫情况下均显著降低,推测由于胁迫引起氧化损伤,造成红耳龟体内活性氧增多,血清中大量GSH 被用于活性氧的清除而被消耗。同时急性温度胁迫还可能影响谷胱甘肽过氧化物酶、谷胱甘肽还原酶和谷胱甘肽转移酶的活性进而间接影响GSH含量(管敏等,2019)。
相关研究表明,日粮中添加适量的VE 可以在满足水产动物生长发育需要的同时提高机体的抗氧化能力(许友卿等,2011),还可作为免疫调节物增强体液、细胞免疫和吞噬作用(夏兆飞,2003;曹国弟,赵恒寿,2007)。在对中华绒鳌蟹Eriocheirsinensis幼体进行亚硝酸盐胁迫时,虽然添加VE 后没有完全阻止SOD 活性的上升,但其上升幅度减小,与本研究结果相似。在受到胁迫产生活性氧时,机体可通过酶促和非酶促抗氧化防御机制,以及抗氧化剂清除氧自由基(Suraiet al.,2019)。本研究结果表明,VE 对红耳龟抗氧化酶活性影响较小,其提高红耳龟抗应激能力、减少超氧阴离子产生的效果可能主要是通过VE 的抗氧化剂特性实现,进而减缓了SOD 响应应激的强度(洪美玲,2007)。饲料添加VE 造成急性高、低温度胁迫红耳龟血清CAT 活性上升,但变化不显著,这与谢盛兰(2020)的研究结果一致,进一步说明了红耳龟应对急性温度胁迫造成的氧化损伤时,CAT可能并不起主导作用,也可能是因为实验添加的VE 量尚不是最适宜的,无法大幅提高红耳龟的抗氧化能力,有待后续实验验证。VE使急性高、低温度胁迫下GSH 含量升高,这与李鹏飞等(2016)结果一致,在常温下,VE 可能作为非酶抗氧化因子存在于幼龟血液中,使血清中GSH 含量低于正常水平,但在面对急性温度胁迫时又可迅速引起非酶抗氧化系统的反应,引起GSH 含量的上升,而高水平的GSH可以迅速消除任何形式的活性氧(Joneset al.,1981),对经受氧化应激的生物体而言十分重要。
4 结论
急性高、低温胁迫均可导致红耳龟发生应激反应,龟体肠道消化酶活性和血液抗氧化酶活性也会发生不同程度的变化以应对胁迫,尽可能维持龟体内环境稳定,而饲料添加适宜剂量的VE 可能优化了龟体应对急性温度胁迫的酶策略,进一步节省自身能量、缓解氧化应激,更有利于保持体质健康和生长发育。因而,在红耳龟养殖生产、运输等过程中应当尽量避免急剧的温度变化,减少龟体应激,同时在日常喂食适宜剂量的VE 以增强龟体的抗逆性能。

