免疫检查点抑制剂致大疱性类天疱疮:基于真实世界的药物警戒研究
郎晓琴,郑明昱,马 欢,谷文睿(陆军军医大学第一附属医院药剂科,重庆 400038)
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是一种单克隆抗体,可对抗细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte antigen 4,CTLA-4)、程序性细胞死亡蛋白(programmed cell death 1,PD-1)及其配体(programmed cell death ligand 1,PD-L1),以消除癌细胞和恢复免疫控制[1]。目前经美国食品药品监督管理局(Food and Drug Administration,FDA)批准临床常用的7种ICIs,包括PD-1抑制剂(塞米普利单抗、纳武利尤单抗、帕博利珠单抗)、PD-L1抑制剂(阿替利珠单抗、阿维鲁单抗、德瓦鲁单抗)以及CTLA-4 抑制剂(伊匹木单抗),现广泛用于晚期恶性肿瘤如黑色素瘤、非小细胞肺癌、肾细胞癌、尿路上皮癌、霍奇金淋巴瘤等的治疗[2-5]。随着ICIs在临床的广泛使用,关于ICIs 诱导大疱性类天疱疮(bullous pemphigoid,BP)的报道不断增加,BP 不仅影响患者的生活质量、临床治疗进程,甚至可能危及生命[6-9]。目前与ICIs 相关BP 的研究多见于临床试验或临床研究中有限的病例报道[10-13],此类研究大多有严格的纳入和排除标准以及有限的样本量和随访时间,在评估ICIs与罕见不良反应方面存在一定局限性,因此迫切需要通过上市后的药物警戒数据进一步了解其毒性特征。本文基于FDA 不良事件报告系统(FDA Adverse Event Reporting System,FAERS)数据库,利用openvigil 2.1对数据库中的病例进行回顾性分析,探讨目前临床常用的7种ICIs及联用方案与BP的关联性、发病规律及临床特征,以期为临床安全用药提供参考。
1 资料与方法
1.1 数据收集与处理
本研究使用openvigil 2.1 在线工具对2004 年1 月-2022 年6 月FAERS 数据库中病例进行回顾性研究,以7 种ICIs(阿替利珠单抗、阿维鲁单抗、塞米普利单抗、德瓦鲁单抗、伊匹木单抗、纳武利尤单抗、帕博利珠单抗)作为药物检索词;根据国际医学词典(medical dictionary for drug regulatory activities,MedDRA)23.0 版的首选术语(preferred term,PT),以“pemphigus foliaceous”、“pemphigus”、“dermatitis bullous”、“pemphigoid”作为不良反应检索词,提取Raw_data 中患者的基本信息,包括“ISR”、“case_ID”、“drug name”、“event”、“outcome”、“indication”、“gender”、“reporter country”、“age_in_report”、“role_code”、“date received”。提取Raw_data数据后,根据FDA 推荐的方法进行去重处理[14],筛选保留“role_code”中主要怀疑(primary suspect,PS)药品和次要怀疑(secondary suspicion,SS)药品数据。经筛选去重后的数据通过“ISR”搜索原始病例报告,逐一核对报告内容,进一步去除重复病例,记录患者ICIs单独或联合使用情况:ICIs单药治疗指报告中ICIs作为PS或SS,同一报告中SS、伴随和相互作用药物中均不含其他ICIs;ICIs联合治疗指ICIs作为PS或SS,同一报告中在SS或伴随或相互作用药物中含有另一种ICIs[15];记录原始病例报告中患者发病时间,剔除其中数据缺失和录入错误信息[14]。
1.2 统计分析
采用SPSS 25.0统计软件,描述性分析FAERS数据库中ICIs导致BP患者的临床特征,其中年龄、上报国家、适应证等分类变量用频数和百分比表示,发病时间符合偏态分布以中位数和范围表示。采用具有计算简便、灵敏度高且受对照组选择偏倚影响小特点的报告比值比(reporting odds ratio,ROR)和比例报告比(proportion report ratio,PRR)两种方法进行信号检测,ROR 与95%CI、PRR 与χ2计算方法均基于比例失衡测量法四格表。信号评价标准:ROR 中目标药物的目标不良事件报告数≥3 且95%CI 下限> 1,表示一个阳性信号;RPP 中目标药物的目标不良事件报告数≥3,同时PRR ≥2 且χ2≥4,定义为一个阳性信号,当ROR、PRR 两项检测结果均为阳性时,则判定为可疑信号。ROR、PRR 值越大,则信号关联度越高[16-17]。
2 结果
2.1 临床特征
通过openvigil 2.1提取2004年1月-2022年6月FAERS数据库中7种ICIs相关不良事件报告共87 079例,经筛选去重后,与BP相关的报告共437例。ICIs导致BP 的药物主要为纳武利尤单抗(248/437,56.75%),其次为帕博利珠单抗(95/437,21.74%)、伊匹木单抗+纳武利尤单抗(40/437,9.15%)。报告主要来自亚洲(178/437,40.73%),其次为美洲(133/437,30.43%)、欧洲(116/437,26.55%)、大洋洲(10/437,2.29%)。自2013 年接收首例报告以来,2015-2022 年ICIs 相关BP 的年报告数分别为3、9、23、42、93、53、128、85 例,总体呈逐年上升趋势。ICIs 相关BP 患者中男性(59.96%)多于女性(27.00%),年龄≥70 岁的老年人(170/437,38.90%)占比较高。ICIs 导致BP 发病平均年龄为(68.49±11.10)岁,中位年龄为69.62(14~93)岁;发病时间的中位数为131.50(0~1185)d,但需注意纳武利尤单抗、伊匹木单抗、帕博利珠单抗在首次使用时就有可能发生。在适应证方面,主要发生于皮肤肿瘤(30.43%),其次为呼吸系统肿瘤(24.03%)、泌尿生殖系统肿瘤(13.96%)。ICIs导致BP的患者中有18例(4.12%)死亡,109例(24.94%)住院。具体临床特征见表1。
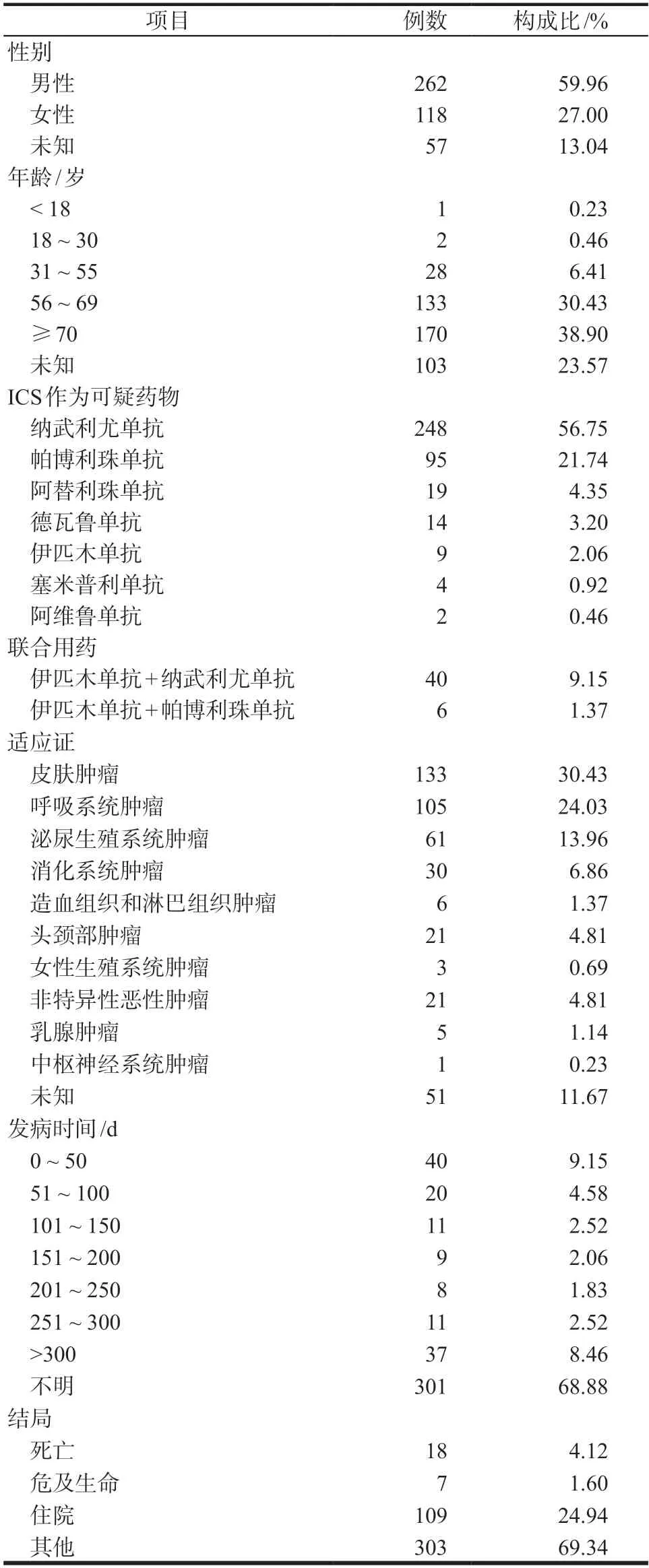
表1 ICIs相关BP不良事件报告的临床特征Tab 1 Characteristics of adverse event reports submitted for ICIs related BP
2.2 ICIs与BP关联性分析
根据ROR 及PRR 两种方法对7 种单药ICIs 及两种ICIs联合治疗方案进行关联性评价,除伊匹木单抗与阿维鲁单抗外,其余五种ICIs及两种联用方案均检测到阳性信号,其中以伊匹木单抗+帕博利珠单抗联合治疗方案信号最强,详见表2。

表2 不同ICIs发生BP的信号强度Tab 2 Signal strength for ICIs alone and combination related BP
3 讨论
3.1 ICIs与BP的关联性及临床特征
本研究中CTLA-4 抑制剂伊匹木单抗未检测到BP 相关阳性信号,这与既往研究[8,11]阐述的相较于CTLA-4抑制剂,PD-1/PD-L1抑制剂发生BP 风险更高相符。导致这一差异的机制尚不明确,有研究[18]认为可能与药物通过阻断PD-1/PD-L1 通路导致CD4+、CD25+、Foxp3+调节性T细胞耗竭,进而导致分泌自身抗体的B细胞克隆增殖,由此增加针对半脂体蛋白BP180自身抗体产生有关。另一个PD-L1抑制剂阿维鲁单抗也未检测到BP相关阳性信号。考虑到该药物上市时间较短,与BP 发生是否相关需更多数据证实。
本研究结果显示,在FAERS数据库中,自2004-2022年ICIs导致BP的上报例数总体呈上升趋势,这可能与ICIs临床广泛使用及其诱发的BP认识度不断增加有关。有研究[6]显示,在种族背景中,ICIs 相关的BP 以白种人为主,本研究中有近一半报告来自亚洲,但数据库中仅有上报国家,缺乏种族和基因等细节信息,且FAERS 数据库受上报国家及人员因素影响,因此ICIs 诱导的BP 是否存在种族差异仍需进一步研究。在临床特征方面,本研究结果显示ICIs 导致BP 患者中男性(59.96%)多于女性(27.00%),而在目前的随机对照试验中,接受ICIs 治疗的患者性别本身存在偏倚,以男性居多[13,19-20],因此要明确ICIs 导致的BP 是否存在性别差异仍需进一步探讨。本研究结果显示,ICIs 导致BP 发生的平均年龄为(68.49±11.10)岁,中位年龄为69.62(14~93)岁,发病的平均年龄稍低于以往研究报道的70~80岁[13,21-22]。在适应证方面,本研究中与ICIs 相关BP 多发生于皮肤肿瘤(32.25%),其次为呼吸系统肿瘤(24.03%)、泌尿生殖系统肿瘤(13.96%),与既往研究报道的多发生于黑色素瘤等皮肤肿瘤以及非小细胞肺癌等呼吸系统肿瘤结论相似[23]。一方面,这可能与目前临床中ICIs 主要用于皮肤、呼吸、泌尿系统肿瘤有关[5],另外“共享抗原理论”推测,BP180蛋白除了分布于基底膜区外,还在黑色素瘤、非小细胞肺癌等肿瘤细胞中表达,启动免疫治疗时,T细胞靶向杀伤肿瘤细胞时,针对基底膜区的免疫原性也被激活,从而引发BP[9]。基于本研究及目前的资料,笔者建议70 岁及以上患有皮肤、呼吸系统、泌尿生殖系统肿瘤的患者,尤其是黑色素瘤、非小细胞肺癌患者,使用PD-1/PD-L1抑制剂治疗前,可提前告知BP的发生风险,使用过程中注意监测瘙痒、湿疹、荨麻疹、水疱等BP相关症状[13]。
3.2 ICIs导致BP的发病时间及治疗建议
本研究结果显示,ICIs 导致BP 发病时间的中位数为131.50(0~1185)d,与既往研究的中位发病时间基本相符[6,13],但需警惕纳武利尤单抗、伊匹木单抗及帕博利珠单抗均有首剂给药后发生BP的病例报告,使用以上药物治疗时在首次给药就应密切监护。另外纳武利尤单抗最早发病时间早于伊匹木单抗+纳武利尤单抗联用方案,与目前研究报道的ICIs联用方案比单独使用任何一种ICIs导致irAEs发病更早结论不符[23],但该领域目前尚缺乏相关文献资料,这也为临床提供了新的研究方向。基于本研究,ICIs导致BP多于长疗程治疗后出现,但使用纳武利尤单抗、伊匹木单抗或帕博利珠单抗治疗的患者,首次给药时就应警惕BP的发生。
2022年NCCN 免疫治疗相关毒性管理指南[24]指出,对于接受免疫治疗后出现BP 的患者,建议紧急皮肤科会诊,对于轻度(G1)BP 患者,暂停免疫治疗,并针对受累区域使用强效外用类固醇激素;中度(G2)BP 患者,应暂停免疫治疗直至严重程度<G1,同时使用泼尼松或甲泼尼龙0.5~1 mg·kg-1·d-1治疗,若3 d后无改善,可考虑加用利妥昔单抗;而重度(G3)或危及生命(G4)BP 患者,建议永久终止免疫治疗,予以泼尼松或甲泼尼龙1~2 mg·kg-1·d-1,若治疗3 d后无改善,可考虑加用利妥昔单抗或静脉用免疫球蛋白。
3.3 本研究局限性
本研究基于FAERS 数据库,因此受到数据库本身局限性的影响。首先,数据库由各种职业人员自发呈报,可能存在漏报,以及不完整、不准确和不精确的报告[15]。其次,由于数据库中仅有发生不良事件的患者数量,缺乏使用ICIs 患者总数,因此无法确定ICIs 导致BP 的实际发病率。另外,本研究通过openvigil 2.1在线工具提取相关数据,该工具在提取和筛选过程中可能导致重要病例报告删除或报告重复的情况。本研究针对初步筛选去重后的病例报告,通过输入“ISR”查找并逐一核对原始病例报告,进一步做去重处理,以减少重复病例的影响。尽管存在以上局限性,FARES数据库仍是极具价值的大型真实数据库来源,本研究结果可对ICIs上市后安全用药数据进行补充,亦可为临床医务工作者安全使用ICIs提供参考。
综上,相较于CTLA-4 抑制剂,PD-1/PD-L1 抑制剂发生BP 风险更高,且在年龄≥70 岁,涉及皮肤、呼吸及泌尿生殖系统肿瘤,尤其是黑色素瘤、非小细胞肺癌的患者中更为常见,对于此类患者,使用PD-1/PD-L1抑制剂治疗前,可提前告知BP的发生风险。不同ICIs 导致BP 的发病时间存在差异,建议临床针对不同ICIs的特点进行个体化监护,以提高临床治疗的安全性。

