家庭肠内营养对食管癌术后并发肌肉减少症的影响
马千云,田文泽,徐达夫,韦欣琪,蒋 超
(南京医科大学附属淮安第一医院 1.消化内科;2.胸外科;3.肿瘤内科,江苏 淮安 223300)
食管癌是我国高发的癌症之一,其发病率和病死率均位居我国消化道恶性肿瘤的第四位[1]。外科手术是临床早中期食管癌患者首选的治疗方案[2]。围手术期的营养支持已成为食管癌术后快速康复的关键[3]。肌肉减少症是一类代表机体肌肉质量和功能损失的疾病,好发于食管癌、胃癌等消化道肿瘤患者,且与肿瘤预后密切相关[4]。食管癌患者术后并发的吻合口狭窄、食管返流以及术后的辅助放化疗等都会影响患者术后正常进食,极有可能导致肌肉减少症的发生。最新研究发现,出院后延续的家庭肠内营养支持能够改善食管癌患者出院后短期的营养状况[5-6];但其对于食管癌患者术后肌肉减少症发生的影响暂不明确。本研究旨在通过出院后继续保留鼻空肠营养管、家庭延续肠内营养支持,探讨家庭肠内营养对食管癌患者术后肌肉减少症发生率的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2021年1~12月于南京医科大学附属淮安第一医院行微创食管癌根治术的食管鳞癌患者222例纳入研究。纳入标准:①病理类型为食管鳞癌;②年龄≥65岁;③手术方式为胸腹腔镜联合食管癌根治术;④术中留置鼻空肠营养管,术后行肠内营养支持;⑤术前及术后6个月于我院行腹部CT检查。排除标准:①术前合并肌肉减少症;②术前接受新辅助治疗;③术前合并肝硬化、严重低蛋白血症;④住院期间出现吻合口瘘、重症肺炎等严重并发症以及意外拔除营养管、胃管等情况;⑤出院后出现迟发性吻合口瘘;⑥合并其他恶性肿瘤或精神病史。根据出院前是否保留鼻肠营养管分为家庭肠内营养组(研究组,术后2个月拔除营养管)63例和传统营养组159例(对照组,术后12 d内拔除营养管)。本研究经医院伦理委员会批准,两组患者的基本资料差异均无统计学意义(P>0.05),见表1。
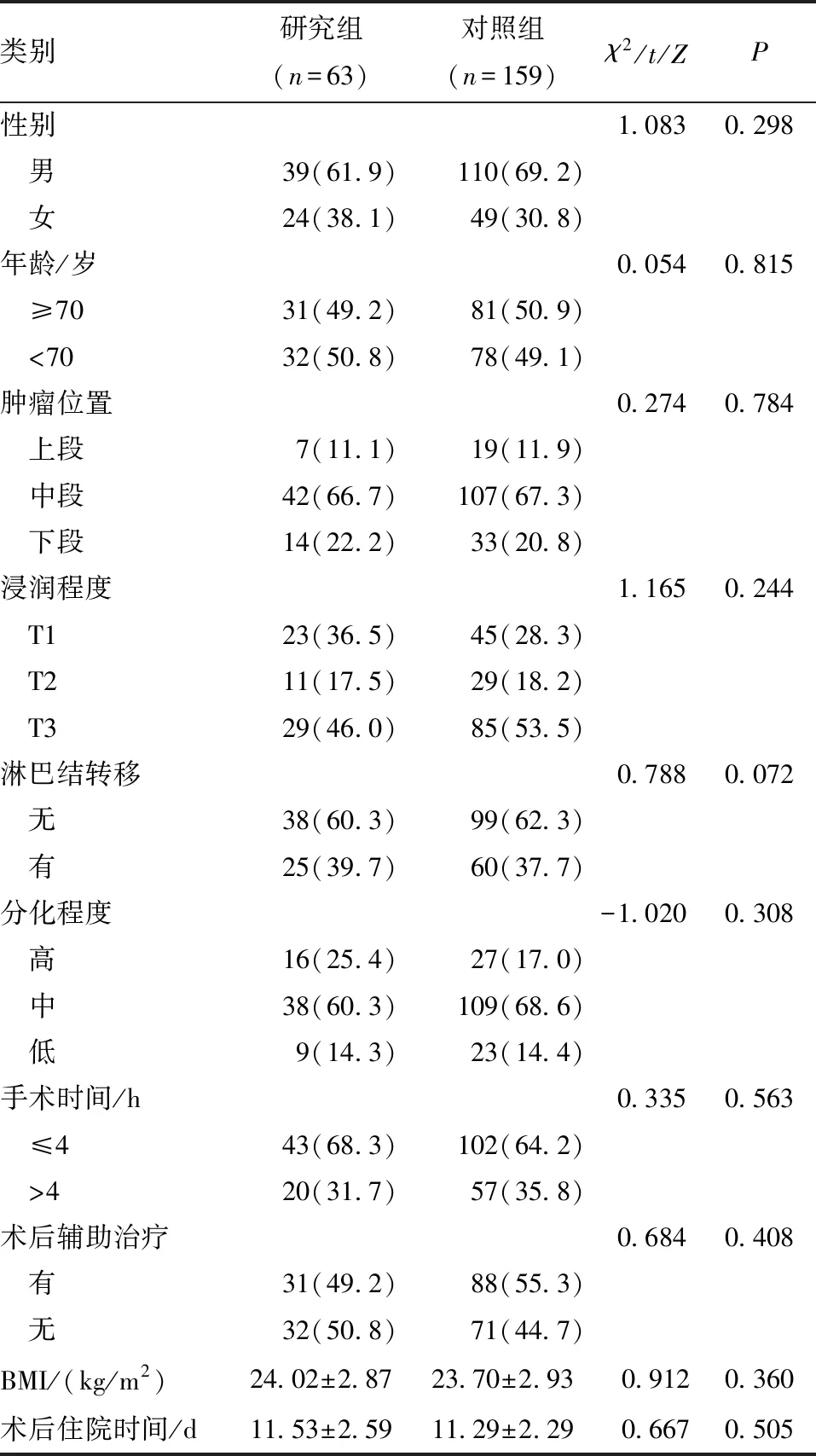
表1 两组患者临床资料的比较[n(%)]
1.2 营养支持方式 对照组:患者术中常规留置鼻空肠营养管和胃管;术前及术后持续对患者及其家属进行肠内营养实施的指导;术后24 h后逐渐开放肠内营养支持;术后第7天排除吻合口瘘后,拔除胃管并开始经口进水逐渐过渡到流质、半流质,逐渐减少营养管内鼻饲;术后12 d左右经评估可完全经口进食后拔除鼻空肠营养管。出院后做好营养指导宣教,建议半流质为主逐渐过渡到软食,1个月后正常进食,少吃多餐、加强活动等。
研究组:患者术后前7 d内处理同对照组;术后第8天排除吻合口瘘后拔除胃管,保留鼻空肠营养管,开始经口进水逐渐过渡到流质、半流质,期间逐渐减少营养管内鼻饲量至保留每日1瓶百普力;出院后每周进行电话随访,根据患者经口进食量判断是否增加肠内营养,患者术后留置鼻空肠营养管并持续肠内营养支持至术后2个月,根据情况确定是否拔除鼻空肠营养管,改完全经口进食。
1.3 肌肉减少症的诊断及观察指标 根据腹部CT L3双侧横突层面骨骼肌横截面面积(包括腰大肌、竖脊肌、腰方肌、腹横肌、腹外斜肌、腹内斜肌)除以身高的平方从而获得L3骨骼肌质量指数(L3 skeletal muscle index,L3 SMI)。以男性L3 SMI≤40.8 cm2/m2、女性L3 SMI≤34.9 cm2/m2,作为诊断肌肉减少症的依据[7]。测量患者术前及术后6个月的L3 SMI。
实验室检查包括术前和术后第8天静脉血测量血红蛋白、白蛋白、前白蛋白等营养指标,统计出院后患者接受辅助放化疗情况以及辅助治疗不良事件的例数。其中辅助治疗不良事件包括放化疗延迟、药物剂量改变或计划中断。

2 结果
2.1 两组患者营养指标的比较 两组患者术前血红蛋白、白蛋白及前白蛋白水平差异均无统计学意义(P>0.05)。两组患者术后第8天的血红蛋白、白蛋白和前白蛋白均较术前出现下降(P<0.05),但手术前后变化幅度差异均无统计学意义(P>0.05)。见表2。
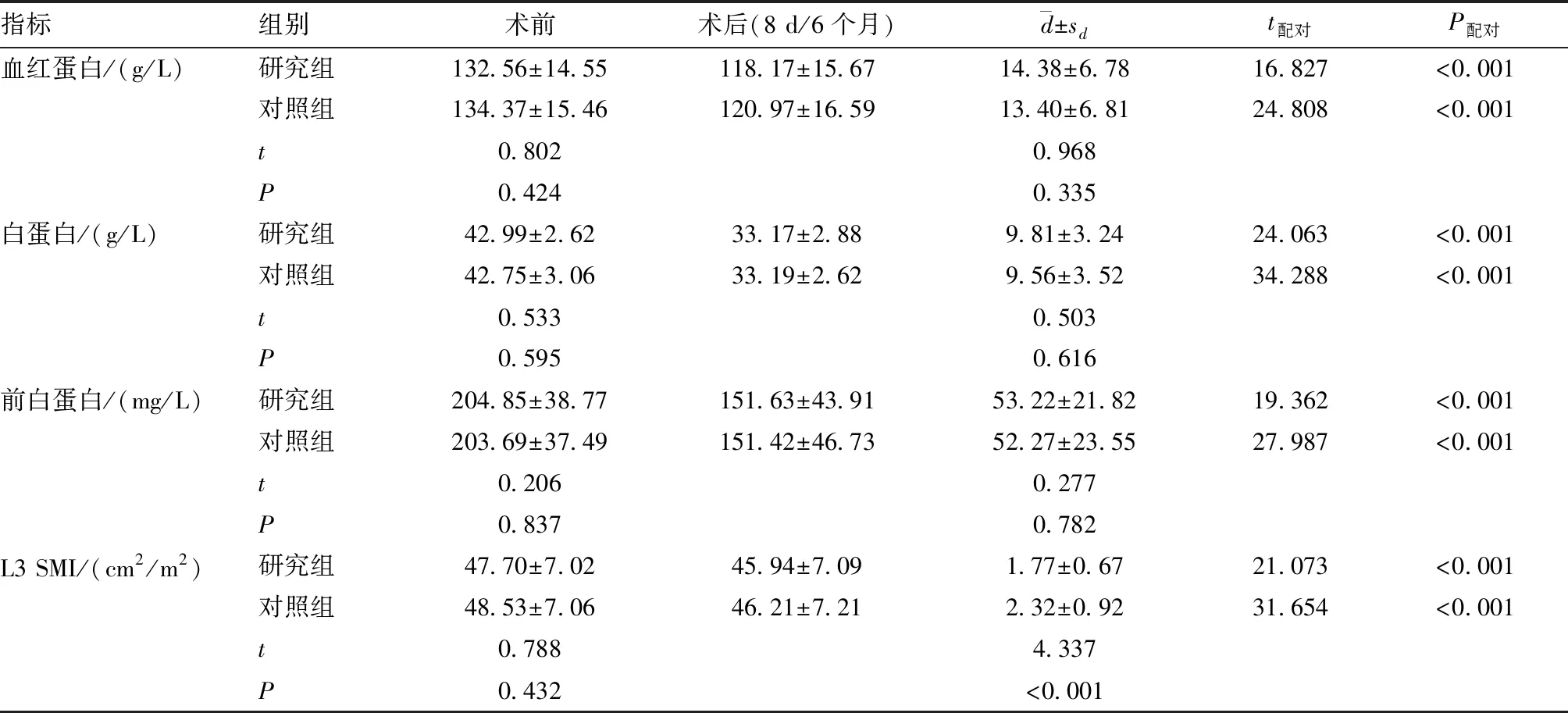
表2 两组患者相关指标的比较
2.2 两组患者肌肉减少症相关比较 两组患者术前L3 SMI水平差异无统计学意义(P>0.05)。两组患者术后6个月的L3 SMI均较术前出现下降(P<0.05),但研究组手术前后L3 SMI水平下降幅度低于对照组(P<0.05)(见表2)。基于术后6个月L3 SMI结果,研究组肌肉减少症的发生率[9.52%(6/63)]低于对照组[21.38%(34/159)](χ2=4.297,P=0.038)。
2.3 食管癌患者术后6个月并发肌肉减少症的单因素分析 以食管癌患者术后6个月并发肌肉减少症为因变量,将家庭肠内营养、性别、年龄、肿瘤位置、浸润程度、淋巴结转移、分化程度、手术时间、辅助治疗和BMI作为自变量分别进行单因素分析。结果提示家庭肠内营养、年龄、辅助治疗、BMI是食管癌患者术后6个月并发肌肉减少症的影响因素(P<0.05),见表3。
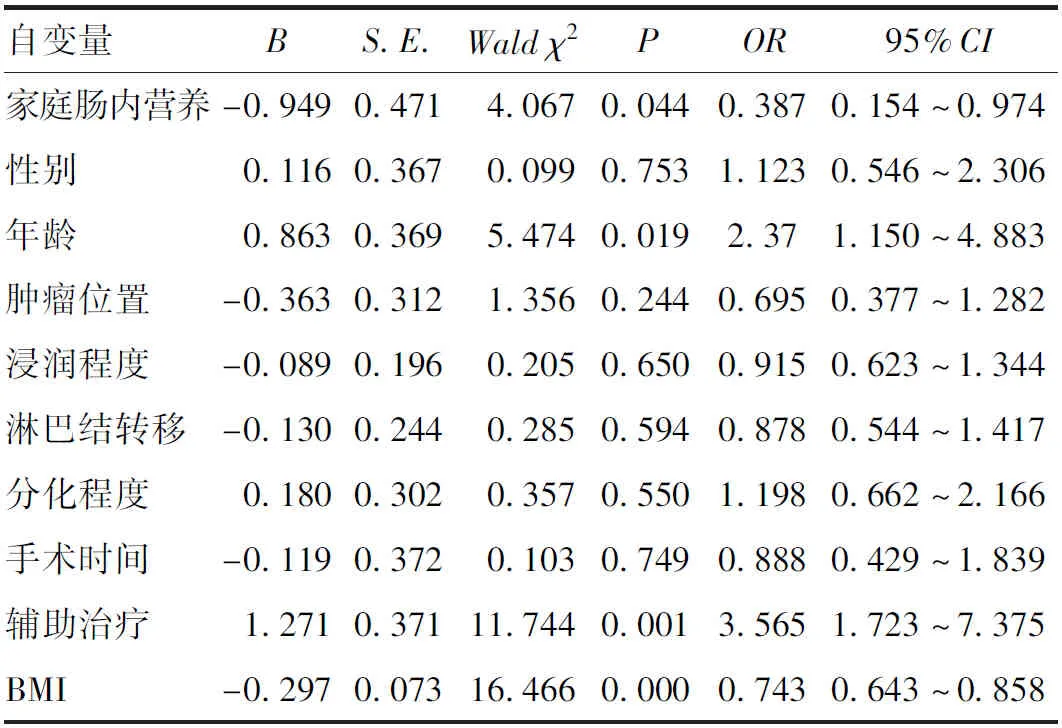
表3 影响食管癌患者术后并发肌肉减少症的单因素分析
2.4 食管癌患者术后6个月并发肌肉减少症的多因素分析 将单因素分析中P<0.10的变量(家庭肠内营养、年龄、辅助治疗、BMI)作为自变量进行多因素Logistic回归(向前法)分析。结果显示,家庭肠内营养支持、高BMI是食管癌患者术后6个月并发肌肉减少症的重要保护因素(P<0.05),而高龄、术后辅助治疗是食管癌患者术后6个月并发肌肉减少症的重要危险因素(P<0.05),见表4。
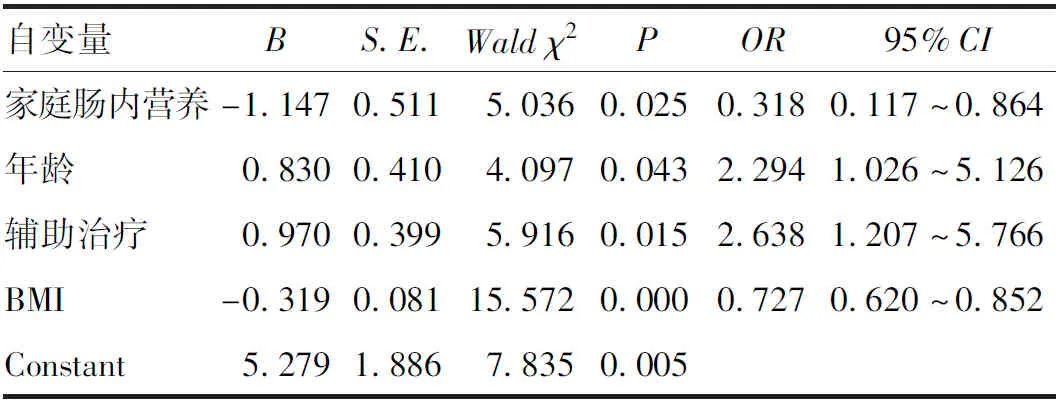
表4 影响食管癌患者术后并发肌肉减少症的多因素分析
2.5 两组患者术后辅助治疗情况比较 研究组实际接受术后辅助治疗与建议行辅助治疗的患者比例[94.74%(36/38)]高于对照组[79.81%(83/104)],差异有统计学意义(χ2=4.570,P=0.033);研究组行术后辅助治疗的患者中存在辅助治疗不良事件(放化疗延迟、药物剂量改变或计划中断)比例[8.33%(3/36)]低于对照组[21.69%(18/83)],但差异无统计学意义(χ2=3.081,P=0.079)。
3 讨论
食管癌患者初次就诊时大多存在着较高的营养风险。术前基于营养风险筛查2002量表认定为合并营养不良的患者比例高达50%[8]。营养不良会延缓食管癌患者术后快速康复,增加吻合口瘘、肺部感染等并发症的发生,还与不良预后密切相关[9]。食管癌根治术中需要行胃或肠代食管的消化道改建,涉及胸腹部甚至颈部的操作,具有手术区域广、操作时间长、机体创伤大等特点,围手术期康复也亟需营养支持。本研究结果也提示两组患者术后第8天的营养指标较术前降低。积极的围手术期全程营养干预能明显改善食管癌患者营养状况和降低术后并发症的发生,有益于并发症的治疗[10-11]。
食管癌手术的消化道重建导致术后容易出现恶心、呕吐、疼痛和消化不良等症状,也会改变患者饮食方式和营养摄入,康复周期较长。研究发现,食管癌患者术后需要3~9个月才能恢复到正常所需的口服摄入量[12]。出院后口服营养摄入不足、手术造成的高分解代谢消耗以及术前的营养不良等都会延缓患者术后恢复和生活质量,甚至会影响后续的辅助治疗,从而影响预后。一项Meta研究分析发现[5],术后延续的家庭肠内营养支持能够改善食管癌患者出院后短期的营养状况和生活质量,减少术后疲劳和肺炎的发生率。因此,食管癌围手术期的肠内营养支持及指导应该始于术前、横跨院内-家庭、终于康复;而必要的营养风险筛查也应贯穿整个疾病治疗周期,便于营养支持的及时介入。
肌肉减少症代表着机体营养不良和肌肉功能减退,好发于高龄人群以及消化道恶性肿瘤患者[4]。研究发现[13-14],食管癌患者合并肌肉减少症的比例高达40%~70%,且术前合并肌肉减少症的患者更容易出现吻合口瘘、肺部感染等严重并发症,预后更差。合并肌肉减少症也会增加食管癌患者放化疗的副作用、治疗的延误甚至中断[15]。此外辅助放化疗的介入也会对患者的进食造成影响。因此,积极控制肌肉减少症的发生对于食管癌患者术后辅助治疗的延续和预后的改善有着显著作用。本研究发现,家庭肠内营养支持能够明显降低食管癌患者手术6个月后肌肉减少症的发生,降低手术康复过程中的腹部肌肉丢失,提高患者术后辅助治疗的接受度。延续至家庭的肠内营养支持通过减少食管癌患者术后并发肌肉减少症的风险,促进患者早日完成规范的辅助放化疗治疗,也有助于预后的改善。
食管癌围手术期的康复和综合治疗的完成与良好的躯体功能评价密不可分。本研究发现,家庭肠内营养支持能够通过有效承接住院期间的营养支持,降低肌肉的丢失,从而减少食管癌患者术后肌肉减少症的发生。家庭肠内营养通过改善患者的营养状况,提高肿瘤患者肌肉状况和治疗的延续性。本研究也存有一定的局限性,缺乏针对肌肉功能的评估,有待后续研究进一步改进。

