基于失巢凋亡相关标志物预测膀胱癌患者预后
朱亮,陈业刚
(天津医科大学第二医院泌尿外科,天津 300211)
膀胱癌是最普遍的泌尿系统恶性肿瘤之一,也是世界上最常见的十大癌症之一。根据《2020 年全球癌症统计》,膀胱癌在全球范围内造成约212 000 人死亡,而且这一死亡人数随着时间的推移在不断增加[1]。根据临床病理特征,膀胱癌可分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌[2]。大多数膀胱癌患者(75%)表现为非肌层浸润性膀胱癌,但其中超过60%的患者有复发可能,超过20%的患者最终进展为肌层浸润性膀胱癌,患者5 年生存率从90%急剧下降到50%以下[3-5]。尽管目前膀胱癌的治疗方案越来越多,如手术、放疗、化疗、靶向治疗、免疫治疗和新辅助治疗等,但仍有相当一部分人没有从中受益[6]。因此,鉴定膀胱癌的生物标志物和基因靶点以抑制癌症浸润进展具有重要的临床意义。
失巢凋亡是由正常的细胞-细胞或细胞-细胞外基质附着失败而诱发的一种程序性细胞死亡[7]。与经典的细胞凋亡类似,失巢凋亡通过线粒体途径或细胞表面死亡受体途径在人体内发挥作用[8]。失巢凋亡可以防止脱落的细胞黏附在异常部位[9-10]。然而,越来越多的研究表明,侵袭性肿瘤细胞产生失巢凋亡抵抗是肿瘤进展的关键因素[11]。失巢凋亡抗性日益成为肿瘤进展的有力标志。但是目前很少有研究探讨膀胱癌中失巢凋亡与肿瘤细胞浸润和远处转移之间的联系。
因此本研究探讨了失巢凋亡与膀胱癌之间的预后关系,并建立一个预后评分模型。此外,将肿瘤微环境、药物敏感性和失巢凋亡相关基因结合起来,进一步探讨该风险评分与肿瘤微环境的相关性,为膀胱癌患者的预后评估提供了坚实的基础。
1 材料与方法
1.1 数据收集 2023 年3 月10 日从The Cancer Genome Atlas(TCGA)数据库(https://portal.gdc.cancer.gov/)中收集了有关膀胱癌的基因转录组数据和临床数据,其中包含19 个正常样本和412 个肿瘤样本。进一步从Gene Expression Omnibus(GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/)下载了GSE-3507数据集的相关信息。使用Perl 和WinRAR 软件对GEO 基因表达数据和TCGA 表达数据进行提取、解压、清理和合并。转录组数据使用的是每千基数的片段(FPKM)。所有的失巢凋亡相关基因都是通过genecards(https://www.genecards.org/)数据库[12]和harmonizome(https://maayanlab.cloud/Harmonizome/)数据库[13]获得。在去除重复的数值后,得到516 个失巢凋亡相关基因。为尽量减少数据偏差,从临床数据中剔除了缺失总生存期(overall survival,OS)和总生存期低于30 d 的样本(表1)。最后,从UCSC Xena 服务器(https://xena.ucsc.edu/)上的GDC TCGA膀胱癌项目中获得膀胱癌患者的拷贝数变异数据。
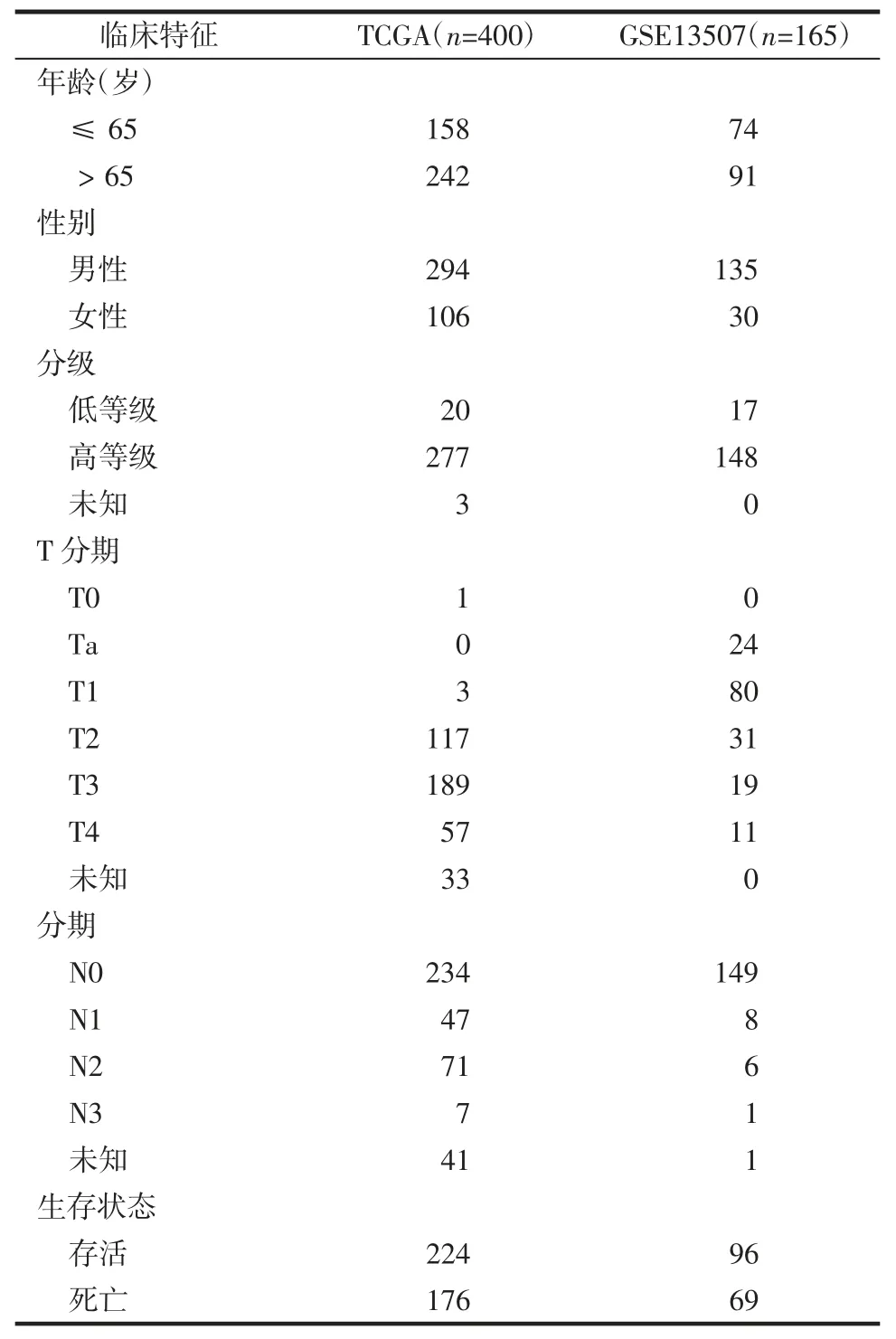
表1 基于TCGA 及GEO 膀胱癌患者临床特征分布Tab.1 Distribution of clinical characteristics of bladder cancer patients based on TCGA and GEO
1.2 建立与预后相关的失巢凋亡相关基因风险评分 从TCGA 数据库中筛选出上述516 个基因表达数据,并使用Wilcoxon秩和检验进行差异分析。随后,进行单因素Cox回归分析以筛选与生存相关的基因,使用R 包“glmnet”进行最小绝对收缩和选择算子(LASSO)回归分析。多因素Cox回归被用来提取风险模型构建的核心基因并计算其对应系数(coef)。所有样本的风险得分按以下公式计算:风险分数=,其中exp(Xi)和coef(Xi)分别代表基因表达水平和对应风险系数。然后,将所有符合标准的样本按1 ∶1 的比例分成训练组和测试组。以训练组中风险分数中位数值为分界点,将所有样本分为高风险组和低风险组。最后,对所有样本、测试样本和训练样本中的高、低风险组进行Kaplan-Meier(K-M)分析和受试者工作特征(ROC)曲线分析,以评估模型的预测价值。
1.3 列线图模型的构建与验证 根据患者的临床特征和失巢凋亡相关基因评分,使用R 包的“rms”与“survival”包创建列线图来预测样本1、3 和5 年的生存期。校准图、累积危险曲线和决策曲线分析以验证列线图模型的预测能力。
1.4 免疫浸润与肿瘤微环境分析 采用CIBERSORT 软件包获得所有样本中22 种免疫细胞的表达谱。然后,预估高风险组和低风险组之间22 种免疫细胞浸润肿瘤的比例,并以柱状图和小提琴图的形式呈现。同时,探索各种免疫细胞之间的相关性。此外,将得到的核心预后失巢凋亡基因,风险得分与22 种免疫细胞进行相关性分析。最后,通过ESTIMATE 算法比较高危组和低危组的纯度、基质和免疫评分。
1.5 药物敏感性分析 通过使用R 包“pRR-ophetic”,测量了不同药品的50%最大抑制浓度(IC50),并比较不同风险组间的敏感性差异(P<0.001)
1.6 细胞培养及转染 将人正常膀胱细胞SVHUV-1 及膀胱癌细胞系T24、J82、5637(中国科学院上海细胞库)接种于含10%胎牛血清的DMEM(日本Takara 公司)中培养,并放置于37℃,5%CO2细胞培养箱中,待细胞生长至80%~90%培养皿时,予胰蛋白酶进行消化、传代。
1.7 RT-qPCR 实验检测基因mRNA 表达量 按照TRIzol 试剂[天根生化科技(北京)公司]说明书所述,提取细胞密度达80%左右时的正常膀胱细胞、T24、J82、5637 膀胱癌细胞系中的总RNA,使用反转录试剂盒(日本TaKaRa 公司)合成cDNA,应用qRT-PCR 的方法对F10,内参GAPDH 进行扩增,采用2-ΔΔCT法对F10,内参GAPDH 表达水平定量分析,设置qRT-PCR 反应条件:92℃40 s,58℃28 s,72℃28 s,循环36 次,每组6 个重复,每个重复3 个平行。其中所选择的引物序列如下:F10 上游引物:5′-TCAAGGTGAGGGTAGGGGAC-3′,下游引物:5′-GGAAGGTGATGGGGGTCTTG-3′;GAPDH 上游引物:5′-GAAAGCCTGCCGGTGACTAA-3′,下游引物:5′-GCCCAATACGACCAAATCAGAG-3′。
1.8 细胞转染 取对数生长期的膀胱T24 细胞进行转染,按照LipofectamineTM3000 说明书(美国Invitrogen 公司)的方法操作,分别转染阴性对照质粒(NC 组)和F10 过表达质粒(OE-F10 组),以pcDNA3.1 为质粒载体。收集转染完全的对数生长期T24 细胞进行后续研究。
1.9 CCK-8、集落刺激实验检测细胞增殖能力 消化、收集对数生长期的NC 组、OE-F10 组细胞,制成单细胞悬液,将转染后的各组细胞置于96 孔板中进行培养,每组3 个复孔,每孔中加入100 μL 细胞悬液,置于37℃,5%CO2细胞培养箱中培育至0、24、48、72 h 时,加入10 μL CCK-8 溶液(日本Takara 公司),继续避光孵育2 h,使用酶标仪记录此刻450 nm 波长对应的吸光度,即OD 值,绘制细胞生长曲线。
同样,取对数生长期的NC 组、OE-F10 组细胞以每孔1 000 个的密度接种于六孔板上,置于37℃,5%CO2细胞培养箱中孵育2 周,4%多聚甲醛固定细胞20 min 后,使用0.5%结晶紫(美国Sigma 公司)进行染色,PBS 冲洗、晾干、拍照。
1.10 Transwell 检测细胞侵袭能力 细胞转染后,取对数生长期的NC 组、OE-F10 组细胞制备无血清的单细胞悬液,按1×105细胞数/孔(200 μL)加入transwell 上室,下室加入600 μL 含10%胎牛血清的RPMI1640 培养液,置于37℃,5%CO2细胞培养箱中24 h,棉签轻拭去未侵袭的细胞,多聚甲醛固定20 min,PBS 清洗3 次,并采用0.1%结晶紫染料(美国Sigma 公司)染色20 min,再次PBS 清洗,晾干,于显微镜下选取合适的视野计数。
1.11 统计学处理 在这项研究中,使用单因素Cox分析、LASSO和多因素Cox回归分析来获得膀胱癌的预后基因。ROC 曲线和K-M生存分析用于预测模型的准确性。所有的数据处理都是基于R(4.1.3版)和Perl。相关R 包包括ggplot2、ggpubr、survival、survminer 等均从Bio Conductor 包或R 包中下载。qPCR、CCK-8、transwell、集落等实验均重复3 次,利用graghpad prism 9.1 进行统计学分析及可视化处理,正态分布的计量资料以表示,两组间均数比较采用t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 失巢凋亡相关基因遗传变异和表达 共发现516 个失巢凋亡相关基因。与癌旁组织相比,获取到136 个差异失巢凋亡基因(67 个上调,69 个下调)(图1A)。单因素Cox回归分析(P<0.05)显示136 个差异失巢凋亡基因中有52 个与生存预后相关(图1B,P<0.001)。52 个失巢凋亡相关基因与预后的相关性表明,GKN1、ID2、CASP6、RPS6KA1 和SATB1是膀胱癌的保护性因素,而其他基因属于危险因素(图1C)。拷贝数变异分析显示了所有与预后相关的失巢凋亡相关基因的拷贝频率变化(图1D)。其中,S100A7 在所有样本中拷贝频率呈增加趋势,而MSLN 的拷贝频率则呈降低趋势。52 个与预后相关的失巢凋亡相关基因在染色体上的位置见图1E。
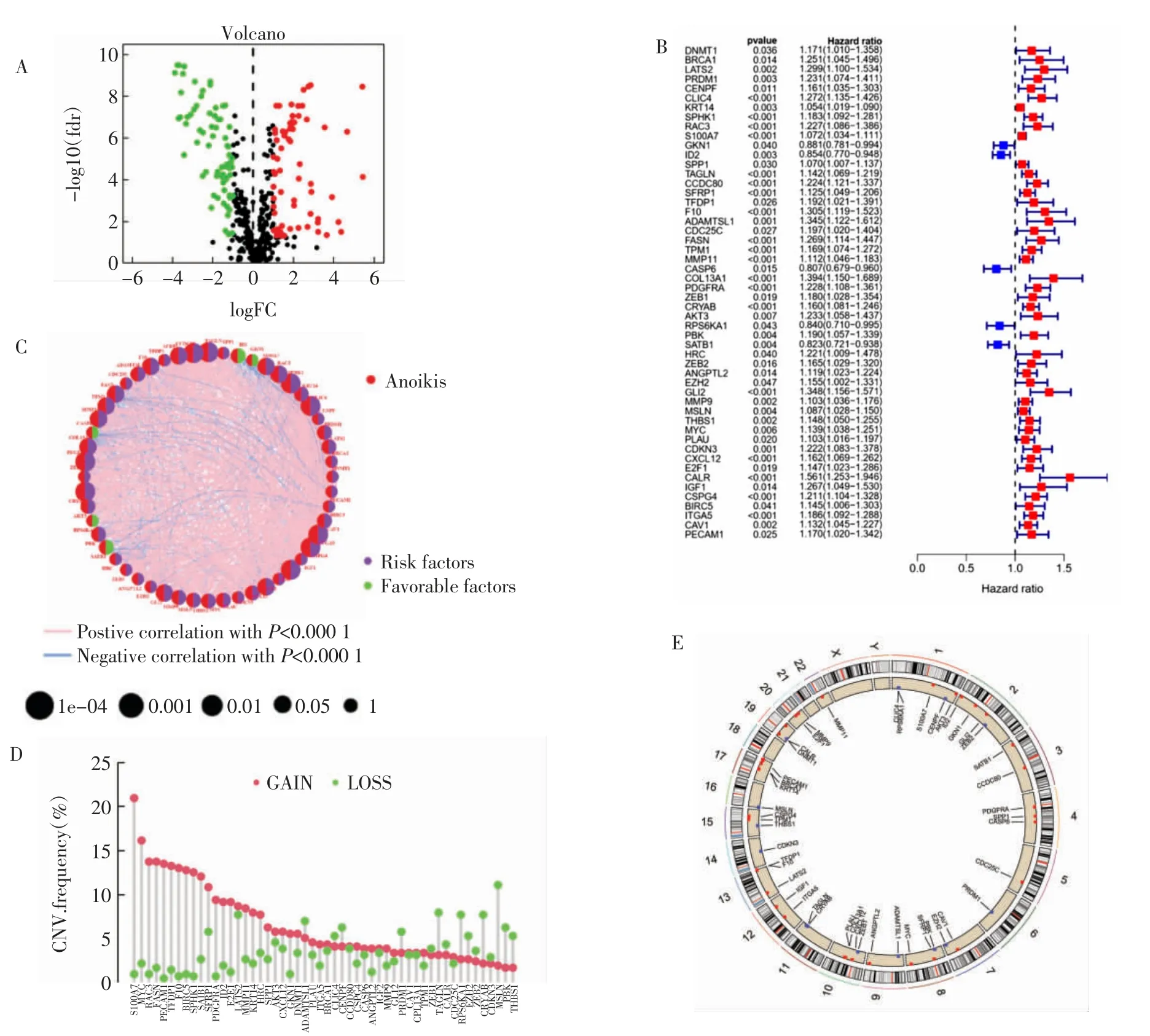
图1 基于TCGA 膀胱癌患者失巢凋亡相关基因变异与表达Fig.1 Genetic variations and expression of ARGs based on TCGA in bladder cancer patients
2.2 失巢凋亡相关基因风险预后模型建立 对52个失巢凋亡相关基因进行降维,得到16 个基因(图2A、B)。进一步多因素Cox分析选出9 个失巢凋亡相关风险基因(DNMT1、F10、FASN、PDGFRA、SA-TB1、MSLN、MYC、CALR、CSPG4)。9 个失巢凋亡相关风险基因的表达水平与相关系数见表2。将所有符合标准的样本按1∶1 的比例分为训练组(n=280)和测试组(n=279)。以训练组中风险评分的中位数值为截断点,将所有样本分为高、低风险组。K-M分析显示低风险组整体样本、测试样本和训练样本的生存生存预后均好于高风险组(图2C~E)。两组1、3、5年生存预后的AUC 值都大于0.6,训练组数值高于0.7(图2F~H)。
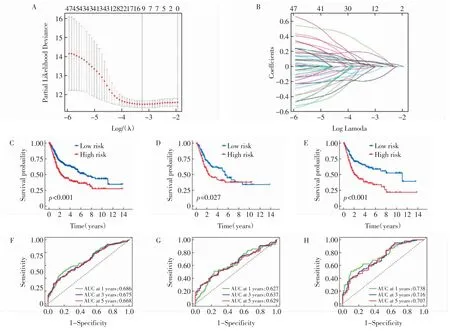
图2 基于TCGA 及GSE13507 数据集建立风险预后模型Fig.2 Establishing prognostic risk model based on the TCGA and GSE13507 cohort
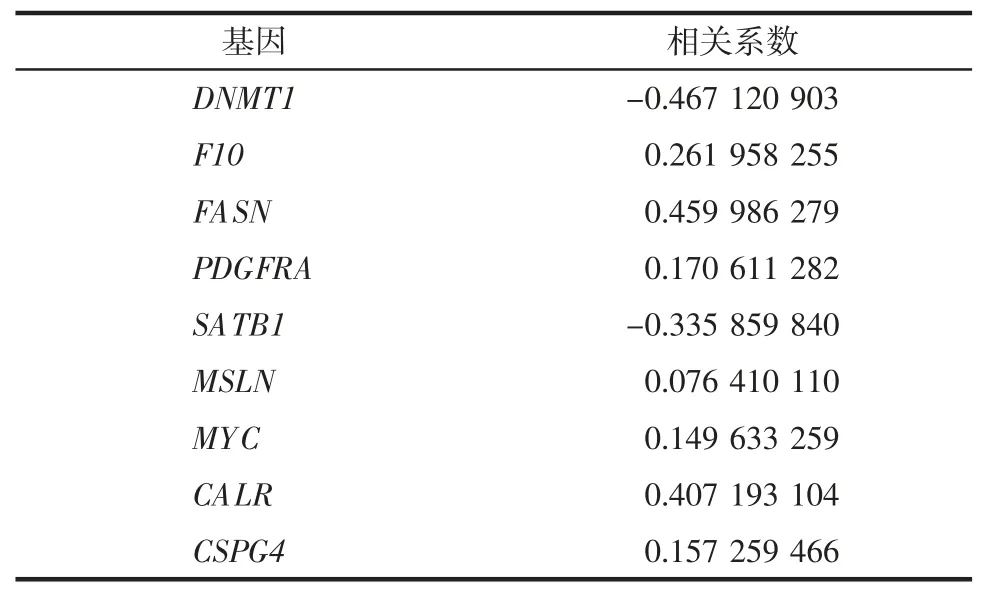
表2 多因素Cox 分析鉴别9 个失巢凋亡相关基因Tab.2 Nine genes identified by multivariate Cox regression analysis
2.3 列线图创建与验证 将膀胱癌患者的临床特征和风险评分结合,构建一个列线图来预测患者在1、3 和5 年的生存状况,显示该列线图的良好预测性(图3A、3B)。累积危险曲线显示风险评分高的膀胱癌患者OS 逐渐增加(图3C)。决策曲线分析结果显示列线图在预测患者预后方面的表现优于其他临床相关特征(图3D~3F)。
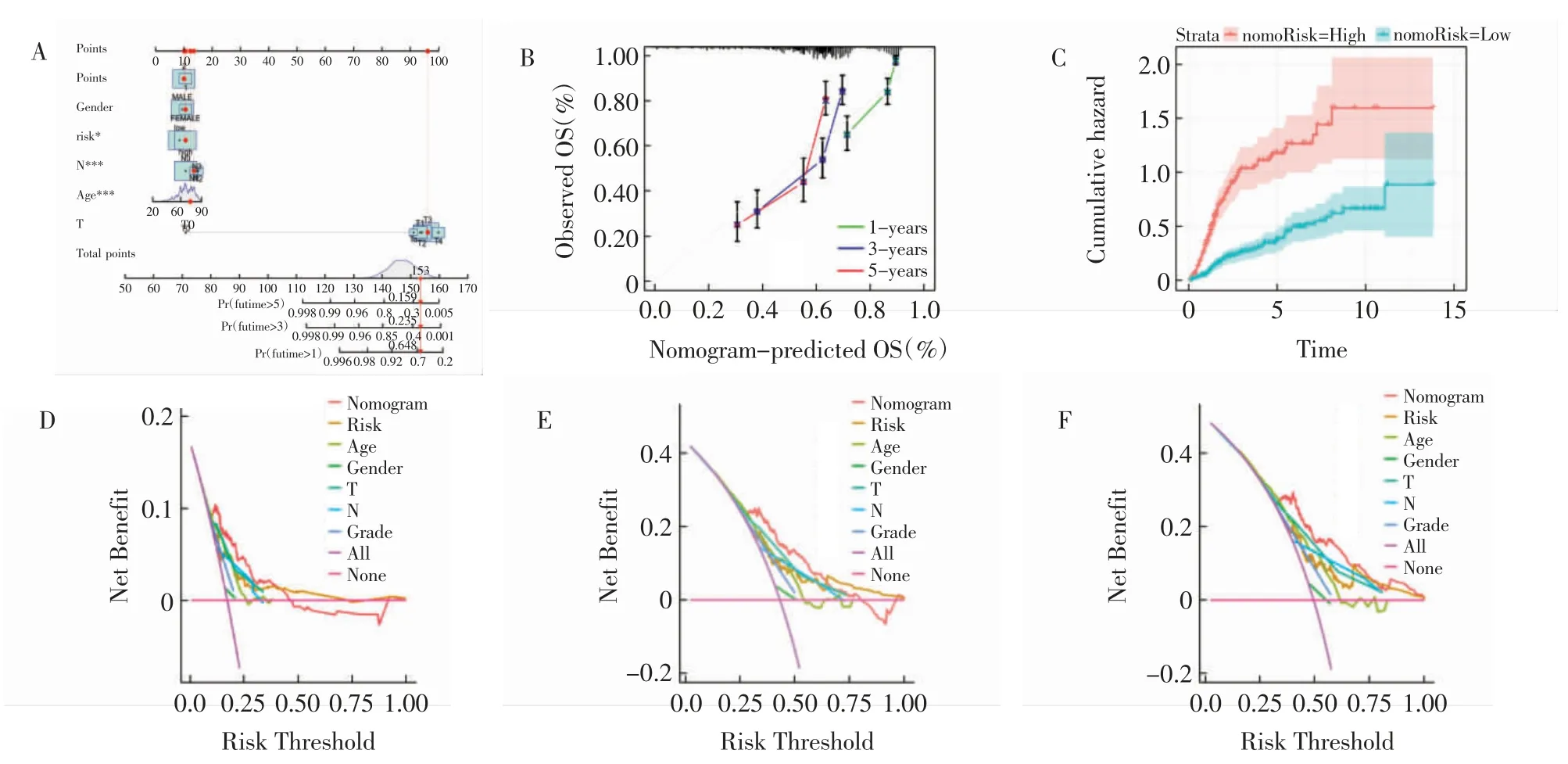
图3 列线图构建与验证Fig.3 Construction and validation of nomogram
2.4 失巢凋亡相关基因免疫浸润、免疫检查点和肿瘤微环境分析 高风险组和低风险组之间CD8+T细胞(P=0.015)、M0 巨噬细胞(P=0.005)、M2 巨噬细胞(P=0.05)和中性粒细胞(P=0.009)的表达有明显差异(图4A~C)。用于构建风险模型的9 个失巢凋亡相关基因与众多的免疫细胞有较强的关联性(图5A)。失巢凋亡风险评分与M0 巨噬细胞、M2 巨噬细胞和中性粒细胞呈正相关,而与滤泡辅助T 细胞、CD8T 细胞和活化NK 细胞呈负相关(图5B)。高危组基质和免疫评分高于低危组(图5C)。
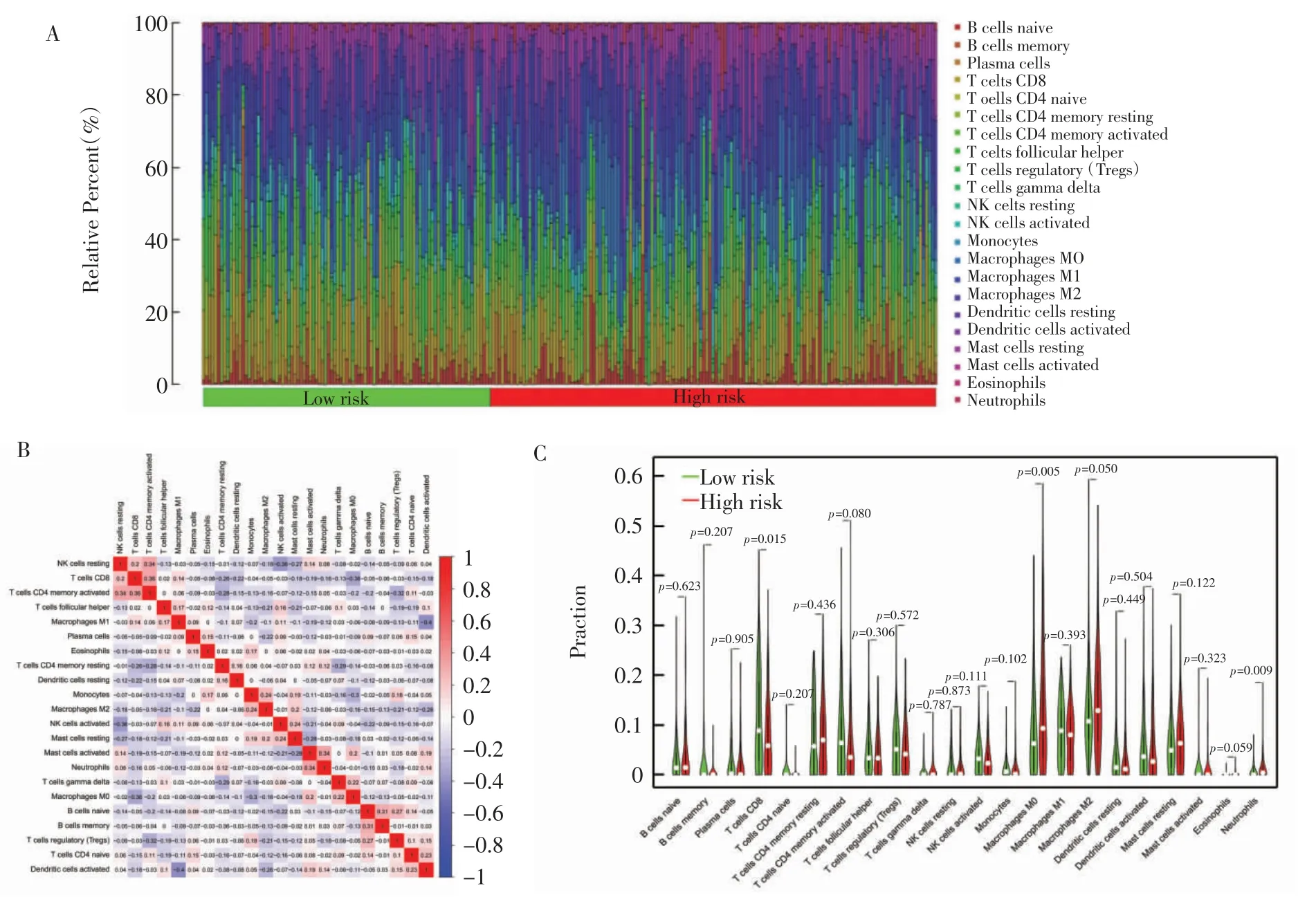
图4 免疫细胞浸润分析Fig.4 Analysis of immune cell infiltration
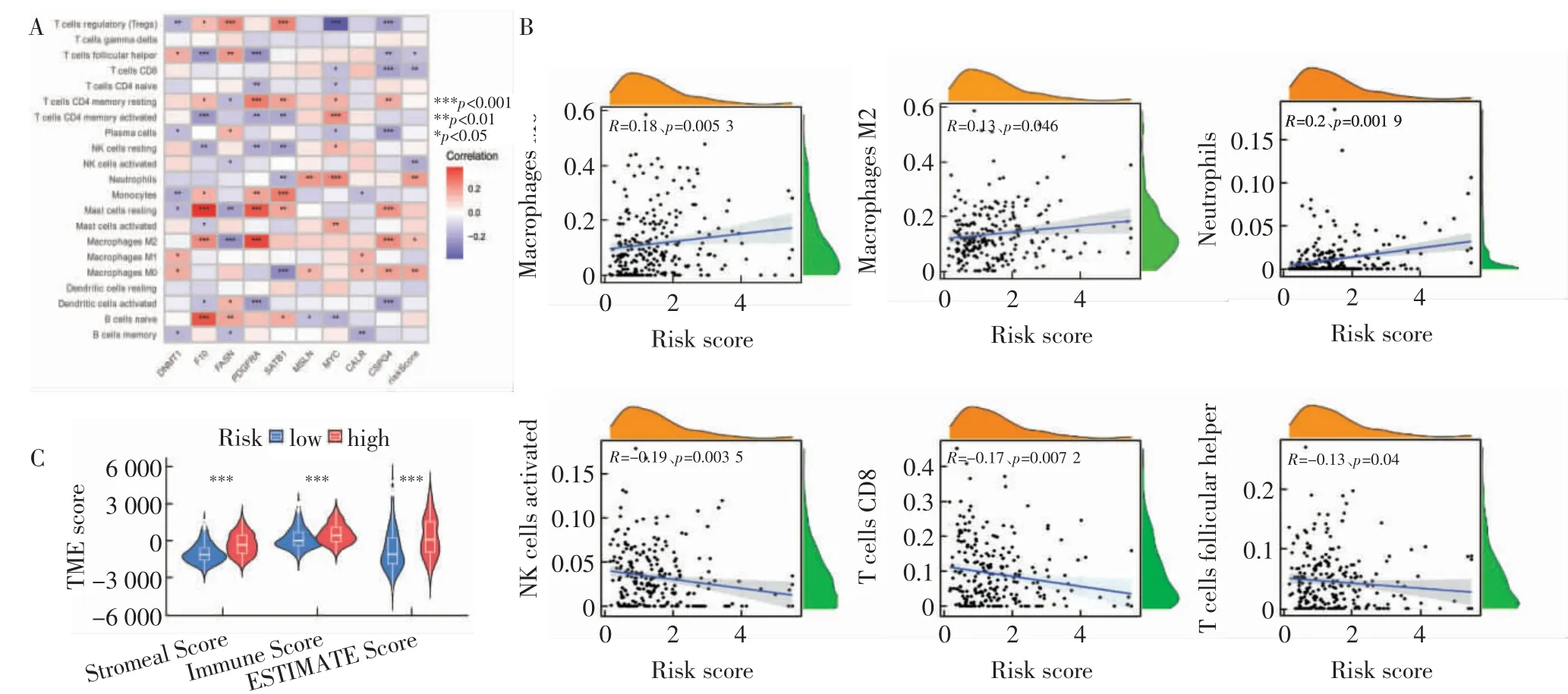
图5 失巢凋亡预后基因免疫检查点及免疫微环境评估Fig.5 Evaluation of the immune checkpoint genes and immune microenvironment for anoikis-apoptotic prognostic genes
2.5 药物敏感性分析 共得到65 种符合条件的药物(P<0.001)。其中,低危人群对Dasatinib、Ribo ciclib、Staurosporine、Luminespib 等药物具有敏感性(图6A~6D),而高危人群则对Afatinib、Oxaliplatin、Gemcitabine、Paclitaxel 等药物更为敏感(图6E~6H)。
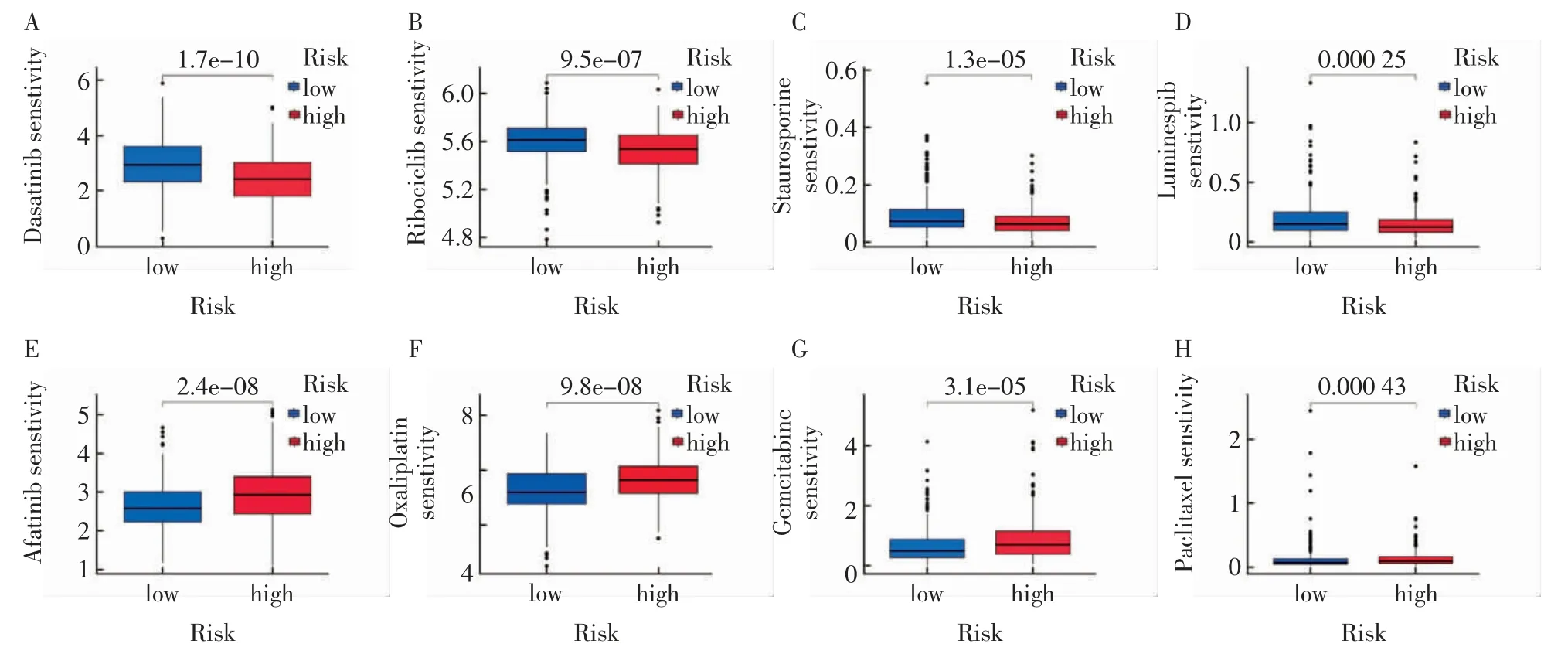
图6 预测膀胱癌患者高低失巢凋亡评分组的免疫治疗反应Fig.6 Prediction of immunotherapy response in high-and low-ARG scores groups in bladder cancer patients
2.6 F10 对膀胱癌细胞增殖、分化、侵袭能力的影响 生物信息学分析显示,F10 在癌组织中呈低表达状态(P<0.001,图7A)。qPCR 显示F10 基因表达在T24 膀胱癌细胞系中具有差异,于T24 细胞系中呈低表达(t=3.031,P<0.05,图7B)。CCK-8 实验显示,OE-F10 组24、48、72h 细胞活力低于NC 组(0.75±0.02 比0.80±0.02,0.85±0.03 比1.05±0.06,1.01±0.02比1.49±0.04,t=2.578、5.528、19.25,均P<0.001,图7C)。集落刺激实验及transwell 实验显示,OE-F10 组侵袭、增殖能力低于NC 组(79.67±21.55 比329.67±34.84,69.67±28.54 比575.33±104.08;t=10.570,P<0.001;t=8.115,P<0.005,图7D、7E)。
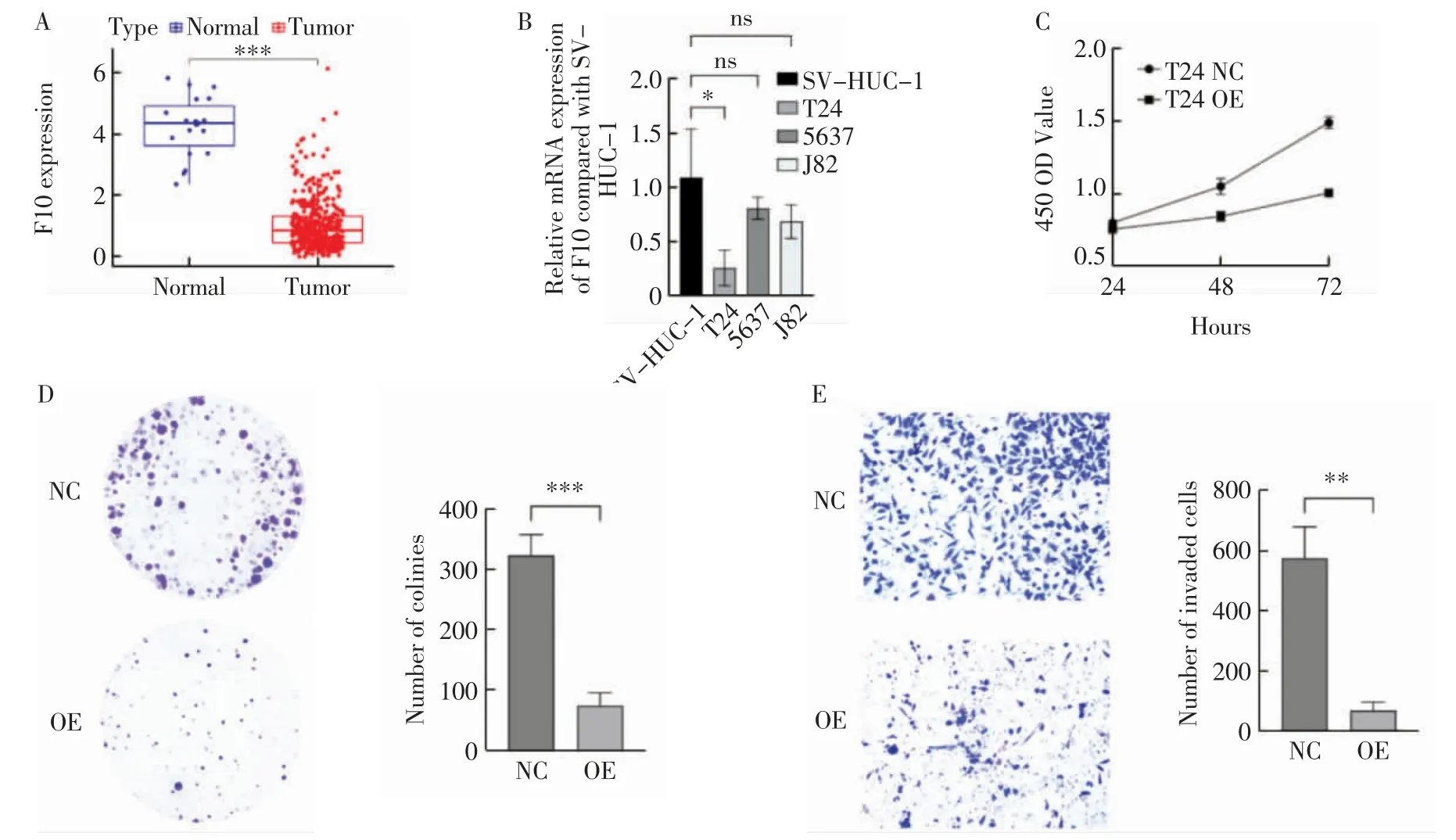
图7 F10 抑制T24 细胞的增殖和侵袭Fig.7 F10 inhibits the proliferation and invasion of T24 cells
3 讨论
膀胱癌被公认为是全世界最具侵袭性的肿瘤之一[14]。即使在最初被诊断为非肌层浸润性膀胱癌的患者中,5 年内也有40%~50%复发,而在高危人群中高达80%[15]。肌层浸润性膀胱癌是一种更致命的形式,复发的几率和远处转移的风险更高[16]。一旦发生转移,膀胱癌患者能够被治愈的可能性就会进一步降低,5 年的OS 仅有6%[17]。作为生物体自身防御机制的一部分,一旦正常细胞脱离了细胞外基质,失巢凋亡的作用是防止这些细胞在不适合的地方种植和生长[18]。然而,研究发现,癌细胞可以通过各种途径产生失巢凋亡抗性,如分泌性生长因子激活途径、整合素表达模式的改变、活性氧对细胞因子受体的激活以及上皮-间充质转化[19]。失巢凋亡抵抗已成为癌细胞浸润和进展的标志。因此,膀胱癌作为高侵袭性癌症的代表,迫切需要发现更多预后标志物,从而为潜在的药物治疗奠定基础。
本研究本研究构建了风险预后模型,其中的基因包括DNMT1、F10、FASN、PDGFRA、SATB1、MSLN、MYC、CALR和CSPG4。DNMT1 是催化DNA 甲基化的关键酶之一,可引起异常的高甲基化,导致肿瘤浸润和生长[20-21]。DNMT 还可促进上皮-间充质转化,诱导细胞自噬,并增强肿瘤干细胞的增殖,进而使肿瘤细胞可能发生失巢凋亡抗性[22]。F10 常见于妇科恶性肿瘤转移,具体作用机制可能是加速细胞外基质的降解,增强肿瘤细胞的侵袭性[23]。FSAN 通过脂肪酸代谢合成途径参与骨肉瘤细胞的转移与生长,尤其在出现肺部转移时,肿瘤细胞出现失巢凋亡抗性[24]。PDGFRA 在结直肠癌细胞转移、血管生成、化疗抵抗中发挥了重要作用[25]。Qi 等[26]发现,SATB1 引起前列腺癌上皮-间充质转化,并加速肿瘤细胞的耐药性和转移。MSLN 则在超过70%的恶性肿瘤组织中表达。虽然没有发现MSLN 的其他功能,但学者们认为其可能参与了细胞黏附的过程,最终诱发癌细胞的远处转移[27]。MYC 作为一个原癌基因,参与调控细胞生长、凋亡、代谢、肿瘤发生和其他生命活动[28]。研究人员发现MYC 可能与ATF4的启动子区域结合,触发失巢凋亡抵抗、促进骨肉瘤细胞转移与浸润[29]。Gao 等[30]证明CALR 可以诱导核因子-κB 信号通路,促进肺癌细胞增殖。CSPG4参与了细胞黏附、运动和侵袭,在恶性细胞的快速浸润和转移中发挥了至关重要的作用[31]。
本研究根据获得的9 个失巢凋亡相关基因建立了风险预后模型, 将这些预后基因同肿瘤微环境相联系,发现肿瘤微环境对肿瘤细胞的发生、发展、转移和治疗反应有巨大的影响。本研究分析了不同风险组中22 种免疫细胞的比例,高风险组中巨噬细胞(M0 和M2)和肥大细胞的比例较高,低风险组中CD8+T 细胞的比例较高。免疫细胞浸润影响膀胱癌患者的OS,以往的研究发现,巨噬细胞是实体瘤免疫浸润的重要组成部分,伴随着恶化潜能,往往带来不良预后[33]。另外,也有证据表明,高CD8+T细胞浸润往往有更好的OS[34]。Li 等[35]证明,膀胱癌患者中CD8+T 细胞高表达和M0 巨噬细胞低表达与良好的临床预后相关。与本研究得到的结果一致。此外,构建预后模型的9 个失巢凋亡相关基因中,PDGFRA与巨噬细胞和肥大细胞呈正相关,表明PDGFRA可能在巨噬细胞相关的途径下促进肿瘤细胞的增殖。
研究证实,F10 基因不仅在葡萄胎、侵蚀性葡萄胎和绒毛膜癌中呈阳性表达,且在多种腺癌中表达阳性,包括卵巢癌、子宫内膜癌、乳腺癌、肝癌和胃癌等[36-37]。A549 肺癌细胞系中F10 可通过上调BCL-2 的表达增强肿瘤细胞在裸鼠体内的成瘤能力[38],胶质瘤中F10 启动子的高甲基化可增加肿瘤的侵袭性[39]。本研究中F10 在膀胱癌细胞中表达下调,过表达F10 的膀胱癌细胞的增殖及侵袭能力显著受到抑制,提示F10 可能对膀胱癌的发生、发展起重要作用。
综上所述,本研究在膀胱癌患者中发现了新的失巢凋亡靶点。这些靶点可以作为治疗靶点,改善患者的生存结果。构建预后风险模型,将风险评分与肿瘤微环境结合起来,可评估膀胱癌患者的免疫状态和免疫治疗反应,有助于了解失巢凋亡相关基因的潜在病理机制,为膀胱癌患者的治疗方案带来新的选择。

