基于RPA的病原体快速诊断策略
许淑莹,王冬梅,欧阳松应,2
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学南方生物医学研究中心,福建 福州 350117)
核酸检测是病原体快速检测的重要方法之一,对于在实验室中难以培养或生长速度不理想的病原体来说,基于核酸扩增的检测技术具有明显优势[1]。聚合酶链式反应(polymerase chain reaction,PCR)[2]可以扩增特定核酸序列片段,广泛应用于检测中,迄今为止,大多数核酸检测是通过PCR或实时荧光定量PCR (real-time quantitative PCR,qPCR)进行的[3],但PCR需要变温热循环过程,需要专业人员配备专业仪器进行操作,检测时间长,限制其在现场检测的应用。为了满足现场诊断需求,近年来研究学者们开发了多种等温核酸扩增技术,包括环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)[4]、依赖核酸序列性扩增技术 (nucleic acid sequence-based amplification,NASBA)[5]、单引物等温扩增(single primer isothermal amplification,SPIA)[6]、链置换扩增技术(strand displacement amplification,SDA)[7]、依赖解旋酶的等温扩增技术(helicase-dependent amplification,HDA)[8]、滚环扩增技术(rolling circle amplification,RCA)[9]和重组酶聚合酶扩增技术(recombinant enzyme polymerase amplification,RPA)[10]等。等温扩增技术在恒温条件下进行,减少了对变温仪器的需求,其中,RPA在37~42 ℃之间反应15~20 min即可完成,具有更大的应用潜力。
1 RPA的原理及技术流程
1.1 原理
RPA是由英国TwistDx公司于2006年提出的核酸扩增技术[10]。该技术利用多种酶在体外模拟T4噬菌体内的DNA复制系统,在恒温条件下实现扩增。传统PCR反应无法在恒温条件下实现扩增,近几年发展较快的LAMP、NESBA等可以在65 ℃恒温条件下完成扩增反应,而RPA可以在37~42 ℃的条件下实现恒温扩增。RPA与PCR具有相似的一点是利用两个相反引物实现扩增,这使其在引物设计上相比较于恒温扩增技术更具优势,其他的等温扩增技术如LAMP需要设计复杂的引物,这也成为非特异性扩增出现的原因之一。PCR反应依赖耐高温的DNA聚合酶,反应过程需要复杂的变温程序来实现扩增,而RPA恒温扩增反应过程需要更多的酶参与。以重组酶(Uvs X)、DNA单链结合蛋白(SSB)和链置换DNA聚合酶作为核心酶[10],其扩增原理是重组酶Uvs X蛋白在加载因子(T4 Uvs Y)协助下与寡核苷酸引物形成核蛋白丝复合物,该复合物在双链DNA模板寻找同源序列并通过引物在同源位点进行链交换形成 D环,D环一侧为引物与模板链杂交形成的双链结构,另一侧为解开的互补链,单链结合蛋白随即结合互补链,防止引物解离,随后重组酶从核蛋白丝结构上解体后,在dNTPs存在下新引物启动另一条链置换反应,DNA聚合酶结合引物的一端进行延伸,并通过循环过程实现指数扩增[3](见图1)。
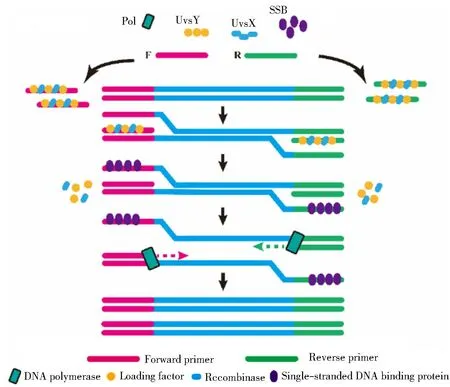
图1 RPA扩增原理图Fig.1 RPA amplification schematic
1.2 反应条件和引物探针设计
RPA反应体系包括Tris、乙酸钾、乙酸镁、二硫青素醇(DTT)、Carbowax20M(或聚乙二醇)、dNTPs、ATP、磷酸肌酸、肌酸激酶等[10],同时需要加入引物探针组合以及反应关键酶,整个反应在37 ℃条件下进行。需要提出的是,体系成分的添加[11]和反应条件[12]对扩增有影响,如加入甜菜碱可以有效避免非特异性扩增出现[13],表明RPA体系成分并不固定,可根据情况进行调整。RPA引物长度在30~35个碱基范围内较为合适[14],但是比较长的引物给设计带来了一定难度,为避免形成二级结构或是导致非特异性扩增,应避免核苷酸长重复或多次小重复,引物GC含量在30%~70%之间[15]。RPA一般使用的探针有exo、fpg和nfo等。反应结合侧流测定需要nfo探针,在5′端带有FAM荧光团标记,内部带有碱基类似物用于核酸内切酶IV(Nfo)的识别和切割,同时反向引物带有5′端生物素标记,与探针形成双标记扩增子[14],在侧流系统中金纳米粒子与抗FAM抗体偶联,双标记扩增产物被特异性抗体捕获[10],检测线的固定抗体捕获生物素,也可以通过利用地高辛和生物素分别标记的引物,不使用nfo探针也能够保留特异性[16]。实时RPA可使用exo或fpg探针。exo探针两侧带有荧光团和淬灭剂,并由内部碱基类似物分离,探针与靶序列结合时,外切核酶进行切割将荧光团与其淬灭剂分离,携带淬灭剂的部分被释放,另一带有荧光团的片段可以通过聚合酶进行延伸,导致荧光与扩增成比例放大[17],在5~10 min可产生检测信号[10]。fpg探针的5′端携带淬灭剂,荧光团结合在淬灭剂下游的内部位置[17],在探针结合靶基因时,DNA糖基化酶识别切割产生2个不可扩展的序列片段[14],荧光团和淬灭基团分离导致荧光放大。
1.3 产物检测
1.3.1 琼脂糖凝胶电泳测定
与其他的扩增技术类似,RPA可通过琼脂糖凝胶电泳进行产物检测,电泳比较简单且可以提供产物大小的信息,在实验室研究阶段经常使用。不足的是,电泳过程需要转移样品可能会导致气溶胶污染,致使假阳性结果出现,并且反应过程需要在相应仪器中进行,应用于现场还存在限制。相关的设备如手持式凝胶电泳设备的开发,将电泳过程集中在一个手掌大小的工具中,同时与基于FIA卡的直接采样工具相结合,可以满足现场检测需求[18]。
1.3.2 桥式絮凝测定
桥式絮凝测定一般用于DNA片段的纯化过程,可作为核酸扩增产物检测的手段。桥式絮凝测定依据羧基官能化的磁珠的可逆絮凝过程[19]。在磁场存在的情况下,磁珠与RPA扩增产物聚集缠绕形成絮状物,阻止两者在去除磁场之后重新分散开。在没有扩增产物时,磁珠在去除磁场后重新分散存在于溶液中,不存在絮状物。因而可以通过体系中反应絮凝状态的存在情况,无需设备,依靠肉眼观察对结果进行判读。
1.3.3 浊度或比色测定
核酸扩增过程可以产生焦磷酸根离子,可与溶液中的镁离子结合形成焦磷酸镁沉淀,通过反应管的浊度变化进行结果的判读,这一特性被应用于恒温核酸扩增技术的结果报告中。常用的检测染料有SYBR Green I[20]、Celfinder、钙黄绿素、孔雀石绿等。辣根过氧化物酶(HRP)/H2O2与3,3′,5,5′-四甲基联苯胺(TMB)底物偶联是广泛使用的比色系统之一,可用于RPA扩增产物检测,利用被生物素或是生物素标记的dNTPs修饰的引物扩增靶标基因,再加入链霉亲和素-HRP,随后加入TMB和H2O2产生颜色变化,可通过肉眼或紫外可见光度计进行结果判读,还可以利用TMB的电化学性质进行电化学安培定量[21]。相关研究表明,基于该比色系统的RPA结合酶联免疫吸附检测技术在特异性、灵敏性、重现性等方面表现较好[22]。
1.3.4 通过pH值的定量测定
通过扩增体系pH值变化可为核酸检测提供更简便的终点检测方法[23],扩增过程的副产物产生及积累可以使反应混合物的pH值发生变化[24],目前已有利用pH变化和RPA反应结合的检测方案[25]。需要注意,RPA体系的缓冲液和其他成分有缓冲作用,以及扩增过程中多种分子机制可能影响pH变化,相关的检测策略的应用需确定体系的缓冲能力,尽可能降低RPA试剂盒的缓冲能力[24],同时避免缓冲能力改变对于相关酶以及DNA扩增过程的影响。
1.3.5 侧向流动检测
侧流测定(LFA)因具有成本低、操作简便的优势而受到关注。LEA在核酸检测上有两种不同结合原理的选择,涵括核酸侧流检测(LF)和核酸侧流免疫检测(LFIA)[26]。核酸与侧向流动LF结合需对特异性引物进行修饰,在扩增过程产生特殊标记产物,产物中间有互补的双链片段,两侧有单链的部分,单链尾部片段作为设计片段,与捕获探针上的互补单链片段实现杂交,从而实现产物检测。LFIA也需要进行特异性引物修饰设计,正向和反向引物通常用生物素和另一种具有高抗体亲和力的抗原进行标记[27],最后扩增产物带有标记,并通过标记物的高亲和力结合或抗原抗体免疫反应形成复合物,可以实现对靶标或靶标产物的检测。相较于凝胶电泳与扩增荧光信号的检测,侧向流动检测更具有现场应用的潜力,RPA技术所需要的扩增温度在没有任何加热仪器的条件下也可以达成,同样具有现场应用的高潜力,RPA结合侧向流动检测的侧向流动试纸条(RPA-LFD)被提出并应用于不同的病原体检测,可以实现现场即时检测[28],减少了检测对于设备的需求。
1.3.6 实时检测
RPA可结合荧光探针进行实时检测[29-30],实时荧光定量RPA中探针两侧分别标记荧光团和淬灭团,当探针与靶序列DNA 结合,相应酶识别切割位点,荧光团和淬灭团分开使荧光变强,产生与扩增DNA数量成正比的荧光信号,荧光信号强度可由荧光信号检测器或扫描仪识读,结果易于判断。目前的实时监测以荧光应用为主,还可以用无标记的环形谐振器对固相重组酶聚合酶扩增进行实时监测,扩增片段与固定在环形谐振器表面上的互补捕获探针杂交[31],并通过谐振波长的变化进行检测。
2 RPA的应用策略
2.1 常规RPA的应用
食源性病原体会导致严重的健康问题。快速检测食源性病原体有重要意义,基于RPA的检测方案已经被提出用于大肠杆菌O157∶H7[32]、金黄色葡萄球菌[33-34]、沙门氏菌[35]、单核细胞增生性李斯特菌[36]等食源性病原体的检测(表1)。需要注意的是,存在少量病原体感染的食物等样品可能在随后保存过程出现病原菌迅速繁殖的情况,因此,食源性病原体的检测灵敏度更受关注。在实际操作过程中可以通过菌体预富集[35]进一步提高检测灵敏度。

表1 食源性病原体的RPA检测Tab.1 RPA detection of foodborne pathogens
RPA也被用于其他病原体的检测,如结核病分枝杆菌[20]、布鲁氏菌[37]等。研究表明,RPA的检测灵敏度不亚于传统PCR及其他扩增技术,并在时间和温度上具有优势。RPA不需要在扩增反应前进行DNA纯化过程,在对临床样本的检测中表现良好。在COVID-19大流行期间,各种等温扩增技术应用于SARS-CoV-2的诊断[38]。RPA在研究报告中被证明是SARS-CoV-2的诊断工具之一[39](表2),检测不需要提取病毒RNA,可以防止污染问题。RPA也被用于其他病毒的检测,如HIV[40]、腺病毒[41]。已有研究提出通过非仪器化孵育结合RPA技术对HIV-1进行快速检测,在环境温度或者使用简单的化学加热器孵育[40],检测HIV-1与检测仪器的结果相近。RPA还被应用于致病真菌如隐球菌[42]、产毒镰刀菌[43]、黄曲霉[44]、大豆疫霉病菌[45]的感染检测,还有应用于原生动物寄生虫的检测[46-47],RPA显示出了其在分子诊断方面的巨大潜力。
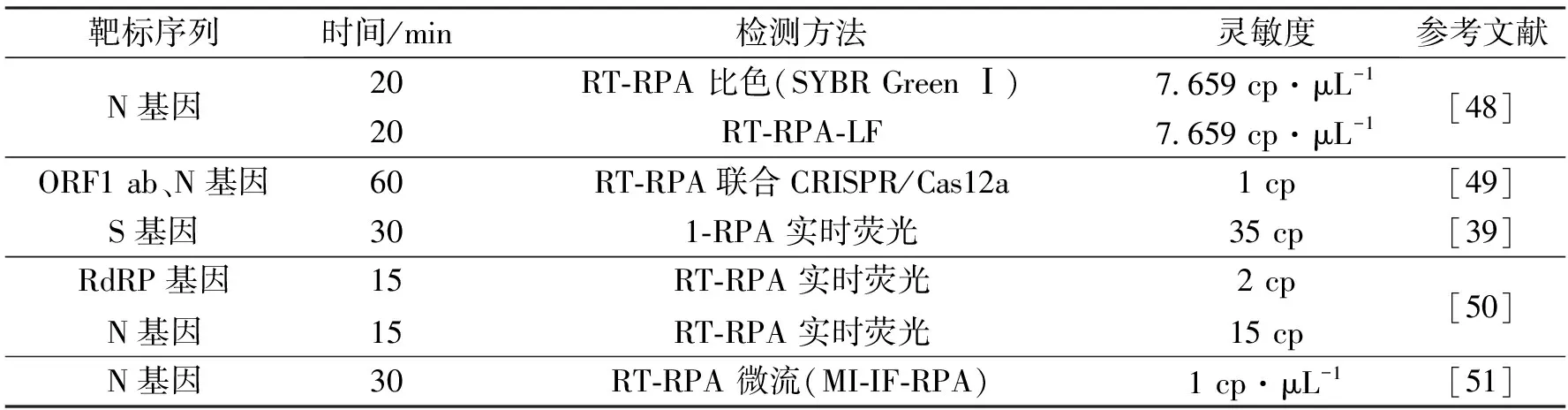
表2 SARS-CoV-2的RPA检测Tab.2 RPA detection for SARS-CoV-2
2.2 逆转录RPA(RT-RPA)
RT-RPA的提出为RPA的进一步应用提供基础,通过逆转录酶的作用,实现样品中RNA到DNA的转换过程,将逆转录反应与DNA扩增在一个步骤中完成。RT-RPA已经被应用于SARS-CoV-2[48,50-51]的检测过程,对于一些高致病性的RNA病毒,RT-RPA提供了更多的现场检测方法(表3),如H7N9[52]、H9N2[53]、塞卡病毒[54]、登革热病毒[55]等。

表3 病毒RPA诊断的相关研究Tab.3 Research on virus diagnosis using RPA technology
2.3 实时RPA
实时PCR广泛应用于病原体诊断,实时RPA也能够应用于病原体的检测中。开发用于大肠杆菌O157:H7[57]、副溶血性弧菌[58]、土拉弗朗西斯菌[59]、单核细胞增多性李斯特菌[60]、虹彩病毒[61]、肺炎支原体[62]等病原体的RPA检测,不同的检测方案中体现了RPA技术在检测时间和灵敏度上的优势。搭配便捷式荧光检测仪[57]或ESEQuant管扫描仪[59]等设备,在操作和时间上存在明显的优势。针对血细胞虹彩病毒的实时RPA检测限为每个反应11个拷贝[61],对其他病毒也有低至几拷贝的检出限[63],谷物中黄曲霉的RPA检测也被证实了不亚于实时荧光定量PCR方法的特异性[44],不同的报告中展示了实时RPA在疾病监测上替代实时PCR的可能性。
2.4 多靶标RPA
开发多靶标检测技术方案具有重要意义。多靶标检测需要建立合适的终点检测方案,有报告提出了不同类型的RPA多靶标检测方法,包括针对病原体[64-66]、病毒[41]的检测,以及针对SARS-CoV-2与其他呼吸道病毒的联合检测[67](表4)。一种基于纸芯片的装置,通过在PES膜上划分反应区来实现用于3种食源性致病菌多靶标检测[64],RPA反应在培养基中进行可以避免污染,纸封闭和胶带封闭也可避免气溶胶污染的产生,同时利用试纸阅读器的终点定量分析[65],提供了新的可视化方案。一种双重检测土拉弗朗西斯菌和鼠疫耶尔森菌RPA方法被成功提出[66],该技术方案中在引物中加入特殊识别序列,能够有效捕捞过量引物,最后采用横向流动法对无过量引物的扩增产物进行检测。SARS-CoV-2感染与其他呼吸道病毒感染症状具有相似性,利用RPA结合测序建立的同时监测SARS-CoV-2和多种呼吸道病毒合并感染的策略[67],对于在疾病感染期间进行有效诊断起到了促进作用。针对多种原生动物的多重RPA测定方案也具有可行性[68]。总的来说,基于RPA检测可以实现从单靶标到多靶标检测,而且通过检测设备等方面的不断创新,利用重新设计引物和探针序列实现不同靶标的检测。但多重检测中还需考虑靶标负担问题,需要针对检测目的进行条件优化以提高反应的灵敏度。
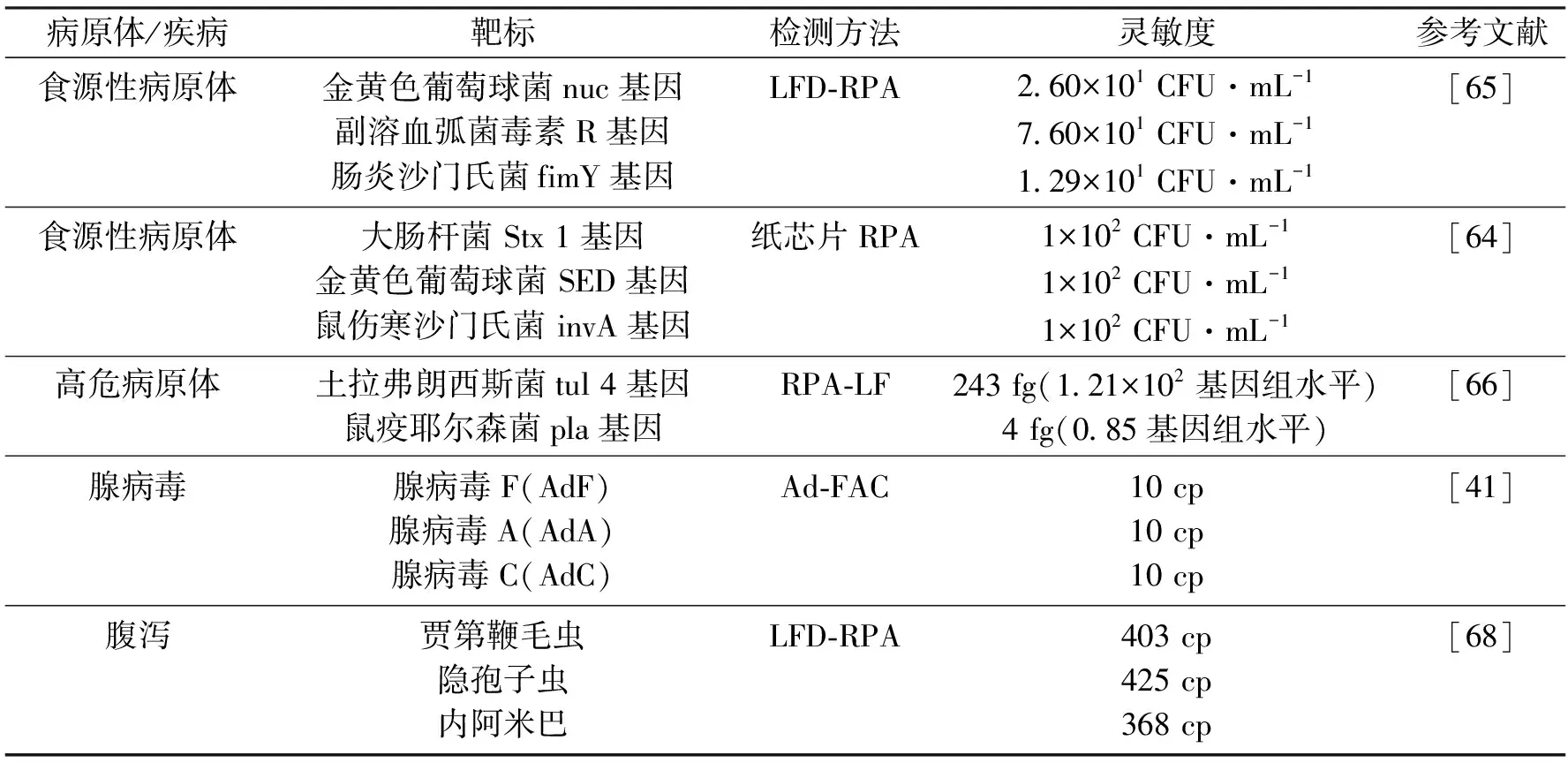
表4 多靶标的RPA检测Tab.4 Multi-target RPA detection
2.5 侧流RPA
利用重组酶聚合酶扩增联合侧流系统的病原体检测是一个重要趋势,用于HIV检测的纸和塑料装置[69]可以储存RPA反应所需冻干酶以及促进反应所需组分的混合,这是RPA侧流检测在设备上的突破之一。目前针对不同病原菌,包括假单胞菌[70-71]、大肠杆菌[57]、金黄色葡萄球菌[72]、副溶血性弧菌[73]、沙眼衣原体[74]、鲤科疱疹病毒2[75]、恶性疟原虫[76]等的RPA侧流检测都显示了检测特异性,有望被开发应用于现场检疫站甚至是居家检测。产毒素真菌大多数具有比较强的致癌或致畸能力,是病原体监测中的重要关注对象。侧流RPA也被开发用于产毒镰刀菌[43]、大豆疫霉病菌[45]、隐球菌病[42]的检测,诸多报告表明了RPA具有重要的应用潜力。在侧流测定中比较重要的材料就是金纳米粒子,其在样品检测线和对照线显色上起到关键作用,但金纳米粒子存在局限,比如在灵敏度和分辨率上存在不足。为了避免该不足,一种纳米铕粒子横向流动免疫结合RPA同时检测单核增生李斯特菌、副溶血性弧菌和大肠杆菌O157∶H7等致病菌的方法[77]被成功开发,该研究用荧光寿命长、荧光强度高的纳米铕粒子代替胶体金作为标记材料,有效提高了结果分析的灵敏度与定量分辨率。
2.6 RPA-CRISPR/Cas系统
CRISPR是生物体基因组编辑的强大工具之一,结合不同类型Cas内切酶能准确识别核酸序列,但对低水平序列无法做到有效识别,若结合上游核酸扩增技术,再通过CRISPR/Cas对扩增产物或转录产物识别切割[78-79],就能够实现对低拷贝样品的检测,通过荧光团和淬灭剂分离实现肉眼或仪器的结果判读。RPA的扩增温度与Cas内切酶的工作温度接近,在上游扩增技术中RPA无疑是一个良好选择。RPA-CRISPR/Cas系统目前已被应用于多种病原体检测(表5),包括寄生虫[80-81]、致病菌[82-83]、病毒[49,84]等。

表5 RPA-CRISPR/Cas系统的病原体检测Tab.5 Pathogen detection of RPA-CRISPR/Cas systems
利用RT-RPA-CRISPR/Cas12a的SARS-CoV-2检测方法已被开发[49],用DNA修饰金纳米微粒比色,靶向ORF1 ab和N区,在扩增时dsDNA结合激活Cas12a反式切割,被包裹的DNA底物被AuNPs水解表现为表面等离子体共振,通过紫外-可见光光谱和肉眼观察,RPA-CRISPR/Cas12a协同检测能有效避免出现其他冠状病毒引起的假阳性。一种结合微推进反应器(Cas12a-MPR)[83]的检测方案被成功建立,通过体系条件优化,可以实现在同一反应器中进行CRISPR/Cas12a切割和RPA扩增过程。从现有研究看,RPA-CRISPR/Cas系统应用快速、灵敏且具有良好的特异性,显示出在病原体现场检测的前景。
2.7 集成与微型化RPA检测
大规模筛查能够有效控制高传染性疾病的传播,而检测过程的试剂消耗、检测样品量不足等问题有待解决。基于RPA的集成微型化设备如微芯片、微流控装置提供了多样化的检测平台,结合数字方法、生物传感器在检测中表现出不同优势。基于RPA的手提箱式实验室也被成功开发用于检测SARS-CoV-2[50],该检测具有良好扩增性能,适用于资源有限的地区现场即时检测。其他更加小巧便捷的设备也被开发用于SARS-CoV-2的检测,Liu等[51]利用微流整合侧流RPA设计了检测设备,将RT-RPA与试纸检测系统集成微流控芯片,在简单的核酸提取之后反应30 min就可得到结果,检出限可达1拷贝。Fu等[85]成功建立了一种基于链霉亲和素包被的金纳米颗粒结合RPA的侧流条状生物传感器检测方案,该检测利用智能手机和笔记本电脑就可以完成实验结果数据的收集以及定量分析,可用于肠道沙门氏菌的临床定量检测。一种称为PADLOCK的方法利用微流体实现液滴数字RPA(ddRPA)进行核酸绝对定量[86],微流体注射与液滴发生器耦合,通过MgOAc注射触发反应过程避免过早扩增,实现精准的定量,结合CRISPR/Cas13a系统表现出单分子检测能力,体现出核酸定量的巨大前景。Luo等[87]报告了一种利用水凝胶纳米流控芯片的数字RPA系统,能够对病原体进行绝对定量,应用于单核细胞增多性李斯特菌的检测限可达单拷贝,且能够避免体系预扩增导致的错误结果,并且提出了新的“随机重叠理论”对核酸精准定量。该操作相对简单,整个过程快速(<10 min),具有高灵敏度、高特异性以及抗抑制能力。集成与微型化设备的研究发明是RPA技术应用于现场的关键,不同POC诊断工具应用于现场检测模式是否具有可行性还需要证明,但RPA本身对于环境条件的低需求以及扩增上的优势使其在现场应用上具有较大的潜力。
3 展望
基于核酸的病原体检测技术在不断发展,相较传统的PCR技术及其他核酸等温扩增技术,RPA不需要昂贵装置,对温度要求低,反应时间短,可以在资源有限的地区实现快速检测的目的,但目前RPA技术在现场即时检测的实际应用还比较少,未来还可能在以下方面有进一步突破:①结合RPA技术的特点,设计更为巧妙的装置实现对于病原体的单重和多重检测,使结果判定更简便、直观,例如类似于保温杯的加热装置或者一些手提式设备等都可以为未来的相关研究提供思路;②最重要的是成本问题,任何需要被普遍利用的技术都需要考虑成本效应,目前的RPA技术大多直接利用商品化的试剂盒进行反应,在成本上是一个比较大的问题,因此,如果能够在未来研发出更为低廉、高效的相应试剂和酶制剂,就能够解决根本上的商业成本受限问题等,给病原体核酸检测带来新的可能。

