BmOsi9a基因在家蚕胚胎细胞周期中的功能研究
刘雪冰 袁雨桐 张然 张基开朗 刘春,2 程廷才,2
[1. 资源昆虫高效养殖与利用全国重点实验室(西南大学), 重庆 400716;2. 重庆市蚕丝生物材料与再生医学工程技术中心, 重庆 400716]
1972年,LINDSLEY等[1]在研究果蝇非整倍体对果蝇生长发育的影响时,发现位于果蝇基因组3号染色体上有1个三倍体致死或单倍体致死位点,简称为Tpl(Triplo-lethal Locus)。Tpl基因重复型杂合子和缺失型杂合子与野生型果蝇杂交的后代致死,表现为部分卵无法孵化或在1龄幼虫期死亡。致死胚胎或幼虫出现气管破裂,中肠变成黄棕色,内部器官退化等表型。直到2003年,科学家在Tpl位点发现了由20多个基因组成的基因簇,并将其命名Osiris基因,认为这些表型可能是由Tpl位点的Osiris基因簇所致[2]。
在家蚕基因组中,胡文波等[3-4]研究发现了22个Osiris同源基因,其中有21个位于26号染色体,另1个位于4号染色体。使用SMART网站进行在线预测,家蚕Osiris基因家族蛋白中有20个含有典型的功能未知的DUF1676结构域。此外,家蚕Osiris蛋白中还存在分泌信号肽结构域和跨膜结构域[5]。在线预测家蚕Osiris基因家族编码蛋白质的结构域,发现家蚕Osiris基因开放阅读框(ORF)长度为723~882 bp,对应蛋白质分子量在26~31 kDa之间[6]。刘春等[7]对包括家蚕、黑脉金斑蝶、小菜蛾、红带袖蝶、蜜蜂和果蝇等多种昆虫的Osiris基因进行系统进化分析,发现Osi9亚家族基因成员之间的相似性约为60%,并且Osi9亚家族的多基因拷贝只存在于鳞翅目昆虫中。家蚕中部丝腺高量表达Sericin-1(Ser1)基因[8],而Osi9a基因呈现出与Ser1基因相似的表达谱。Osi9a在家蚕胚胎发育期4~7 d表达,与家蚕胚胎丝腺的形成时间相一致。Osi9a蛋白也存在于除丝腺以外的茧壳中,并且在多种鳞翅目泌丝昆虫中都被检测到。特别是在家蚕的茧壳中,Osi9a蛋白的丰度仅次于丝素和丝胶蛋白[9]。程廷才等[10]用在家蚕中过表达Osi9a蛋白的方式,发现Osi9a过表达使得茧丝的力学性能发生改变,茧丝弹性模量增强,茧丝强度减弱,茧丝二级结构中的β-折叠含量减少,结晶度下降。
已有研究表明Osiris基因可能参与到昆虫的防御系统中,在几丁质和角质层的形成中起着重要作用[11-13],但具体的分子机制并不清楚。因此,本研究为了揭示BmOsi9a基因的生物学功能,通过在家蚕胚胎细胞系中过表达和下调该基因的表达,对其分子机制进行初步探索,为进一步揭示Osiris基因的生物学功能奠定基础。
1 材料与方法
1.1 实验材料
本研究使用的BmE细胞系为家蚕胚胎起源细胞系,由本实验室保存使用。大肠埃希菌T1购于北京全式金生物技术有限公司。
1.2 实验方法
1.2.1 BmE细胞RNA提取及RT-PCR和RT-qPCR
根据Triozl试剂盒实验方案提取家蚕胚胎细胞BmE细胞系的RNA,根据Promega公司的反转录试剂盒(A5001)说明书制备家蚕胚胎细胞BmE cDNA。同时,利用Primer Premier 5.0软件设计BmOsi9a基因的引物进行扩增,RT-PCR和RT-qPCR所使用的引物见表1。

表1 BmOsi9a的RT-PCR和RT-qPCR引物序列
RT-PCR反应体系的总体积为10 μL,包括:2.5 mmol/L dNTP 0.8 μL,10×PCR Buffer 1 μL,2 μmol/L正向引物/反向引物各1 μL,250 U r-Taq酶0.1 μL,Milli-Q水5.1 μL。反应程序为:94 ℃预变性5 min; 94 ℃变性10 s,55 ℃退火15 s,72 ℃延伸50 s,共30个循环;72 ℃延伸7 min后16 ℃保存。
RT-qPCR实验采用Promega的荧光定量试剂盒进行,以BmRpl3基因为内参(表1),20 μL的反应体系中含SYBR染料10 μL、2 μmol/L正向引物/反向引物各2 μL、cDNA模板2 μL,Milli-Q水4 μL。反应程序为:95 ℃ 30 s; 95 ℃ 3 s,60 ℃ 30 s,95 ℃ 15 s,共40个循环;60 ℃ 1 min,95 ℃ 30 s,60 ℃ 30 s。利用2-△Ct法计算目标基因的相对表达量。
1.2.2 免疫荧光检测
在可传代的细胞上进行目的基因质粒转染实验。首先,将细胞均匀铺于带有爬片的24孔板中,培养48 h后,将培养基去除,用PBS进行洗涤,弃PBS后加入4%多聚甲醛室温固定15 min。随后,在摇床上用1×PBS洗涤3次(每次5 min),洗涤完毕后加入1% Triton X-100室温静置打孔15 min,再次用1×PBS洗涤。配制封闭液,1 mL配制体系:羊血清100 μL,1×PBS 900 μL,并将其加入每个孔中(每个孔300 μL),在37 ℃恒温培养箱中封闭1 h。按1∶200的比例配制一抗,标记好属源性之后直接加入孔中,在37 ℃恒温培养箱中孵育1~1.5 h。随后,回收一抗,进行1~2次PBS清洗。接下来避光按1∶800的比例配制二抗,并在37 ℃恒温培养箱中孵育1 h,随后进行1~2次PBS清洗,DAPI染色并进行封片处理。如果共转染2种质粒,则先孵育1个抗体,然后再孵育另1个抗体,确保2个抗体具有不同的属性,并且二抗的荧光颜色错开。最后,使用共聚焦显微镜观察[Olympus corporation(FV1000)]并拍摄图像。
1.2.3BmOsi9a过表达载体及干涉载体构建
(1)BmOsi9a过表达载体的构建。根据家蚕BmOsi9a基因的ORF序列设计扩增引物(表2),其中,正向引物5′端包含有BamHⅠ酶切位点,反向引物包含有NotⅠ酶切位点,并且在上游和下游引物中均添加入Myc标签。从5龄第3天幼虫的丝腺cDNA中扩增回收目的片段并克隆至psL1180载体中。

表2 BmOsi9a细胞过表达检测引物序列
(2)BmshOsi9a干扰载体构建。设计的干扰载体序列(表3)由深圳华大基因股份有限公司合成。引物退火用超纯水溶解使其总浓度为20 μmol/L。将20 μmol/L正向引物/反向引物各5 μL、10×Buffer M 5 μL、Milli-Q水 35 μL,按照上述反应体系配制于1.5 mL离心管中,置于100 ℃水浴锅中,关闭电源,自然降至室温,随后在4 ℃条件下保存。使用AgeⅠ、EcoRⅠ酶切pLKO.1载体,并将上述双酶切产物与退火产物进行连接,随后转化至大肠埃希菌T1,挑选菌落,测序并保存阳性质粒。

表3 BmshOsi9a干扰载体鉴定引物序列
1.2.4 细胞复苏及转染
(1)细胞复苏。从液氮中取出BmE细胞并迅速解冻于27 ℃,然后在超净工作台将其转移至细胞培养瓶并置于恒温细胞培养箱(27 ℃)中进行培养。(2)细胞培养。BmE细胞在细胞培养瓶中以配制好的培养基培养,培养基一般换3次左右细胞就能长满,此时需要传代,传代步骤同细胞复苏。(3)细胞转染。首先,当细胞密度达到80%左右时即准备进行转染实验:准备2个10 mL的离心管,并向每个离心管中加入1.5 mL的无抗无血清的Grace培养基;接下来,在一个离心管中添加转染试剂(转染试剂与质粒的比例为2∶1),在另一个离心管中分别加入质粒,并静置5 min;然后将2个离心管中的液体混合到一个离心管中,静置20 min;接着,取出待转染的细胞,弃掉旧的培养基,并将之前混合好的转染试剂加入细胞中,轻轻混匀后将细胞置于恒温细胞培养箱(27 ℃)中培养;经过6~10 h培养便弃掉旧的培养基,加入有抗血清的Grace培养基继续培养48 h后,使用荧光显微镜[ZEISS(3527001973)]观察细胞并进行拍照,对结果进行统计分析。
1.2.5 BrdU染色
将待处理的细胞收集并进行血球板计数。将细胞用培养基稀释至2 000个/mL,取500 μL细胞悬液加入24孔细胞培养板中,然后置于恒温细胞培养箱(27 ℃)中培养24 h。细胞培养24 h后,向每个孔中加入BrdU(终浓度为250 μmol/L),轻轻摇晃混匀,然后继续在恒温细胞培养箱(27 ℃)中孵育4 h。弃掉培养基,使用1×PBS进行1~3次洗涤。向每个孔中加入1 mL 4 %多聚甲醛,固定15 min,然后使用1×PBS进行1~3次洗涤。向每个孔中加入500 μL 2 mol/L盐酸,在37 ℃下孵育15 min,然后使用1×PBS洗涤3次。向每个孔中加入500 μL含有1% Triton X-100的PBS溶液,室温下孵育15 min,然后使用1×PBS洗涤3次。根据说明书配制Click反应液(碧云天试剂盒C0071L),注意避光操作,并在室温下避光孵育30 min。吸去孔板中的反应液,使用1×PBS进行洗涤,每次洗涤5 min。向每个孔中加入200 μL DAPI,室温孵育15 min。弃掉DAPI染色液,使用PBS进行1~2次洗涤。最后在荧光显微镜[ZEISS(3527001973)]下采集并保存数据。
1.2.6 流式细胞术检测
首先,待细胞密度达到70 %时弃掉旧的培养基,加入无抗无血清的Grace培养基,并使用巴氏吸管轻柔吹打细胞,将细胞转移到一个5 mL离心管中。将离心管以750×g的离心力在4 ℃温度条件下离心5 min,弃掉上清液,然后用PBS洗涤细胞,并加入1 mL 75%乙醇,在4 ℃下固定至少24 h。再次以750×g的离心力,在4 ℃下离心3 min,弃掉上清液,使用含有RNase的1×PBS洗涤细胞2次。用检测细胞周期试剂(按照1∶100体积比在含0.005 μg/ μL RNase的PBS中加入1 mg/mL碘化丙啶)重悬细胞,37 ℃室温避光30 min。随后,将上述细胞悬液放入流式细胞仪(Sparrow2040)进行检测,最后使用FlowJo软件对数据进行分析。
1.2.7 Western blot检测
(1)制胶后上样:取适量蛋白质样品于1.5 mL离心管中,加入适量5×SDS-PAGE Loading Buffer调节终浓度为1×,混匀后经95 ℃金属浴孵育3~5 min使蛋白质完全变性,瞬时离心后即可上样,也可在-20 ℃条件下存放。(2)电泳:制备好的样品每孔上样10 μL,恒压电泳,初始为80 V,当样品电泳至分离胶时,转至120 V电泳,直至溴酚蓝染液到胶板底部停止电泳。(3)转膜:将PVDF膜浸泡在99.5%甲醇中激活2 min,然后转至纯水中,待膜不再旋转为止(转膜条件:25 V,1.2 A,15~20 min)。(4)封闭:将膜转至5%脱脂奶粉中,4 ℃过夜。(5)孵育一抗:用1%脱脂奶粉配制一抗溶液,一抗Ab-BmOsi9a稀释比例为1∶10 000,将封闭好的PVDF膜完全浸泡于一抗中,37 ℃摇晃1 h。(6)洗膜后孵育二抗:用1%脱脂奶粉配制山羊抗兔二抗溶液,二抗稀释比例为1∶20 000,将洗好的膜完全浸泡于二抗溶液中,37 ℃摇床轻摇2 h。(7)洗膜后曝光:将显影液的A、B液按1∶1比例加入离心管中,颠倒混匀,均匀滴加在膜上,避光放置5 min,按照曝光仪操作说明进行曝光观察。
2 结果与分析
2.1 BmOsi9a基因 mRNA转录及蛋白质表达分析
为了确定BmOsi9a在家蚕胚胎细胞BmE的表达情况,采用RT-PCR、RT-qPCR和Western blot,从基因mRNA转录及蛋白质水平进行分析。结果表明:BmOsi9a基因在BmE细胞中有明显的转录表达(图 1-A、B),证实了BmOsi9a蛋白在BmE细胞中的存在(图 1-C)。以上结果为进一步的功能分析提供了依据。
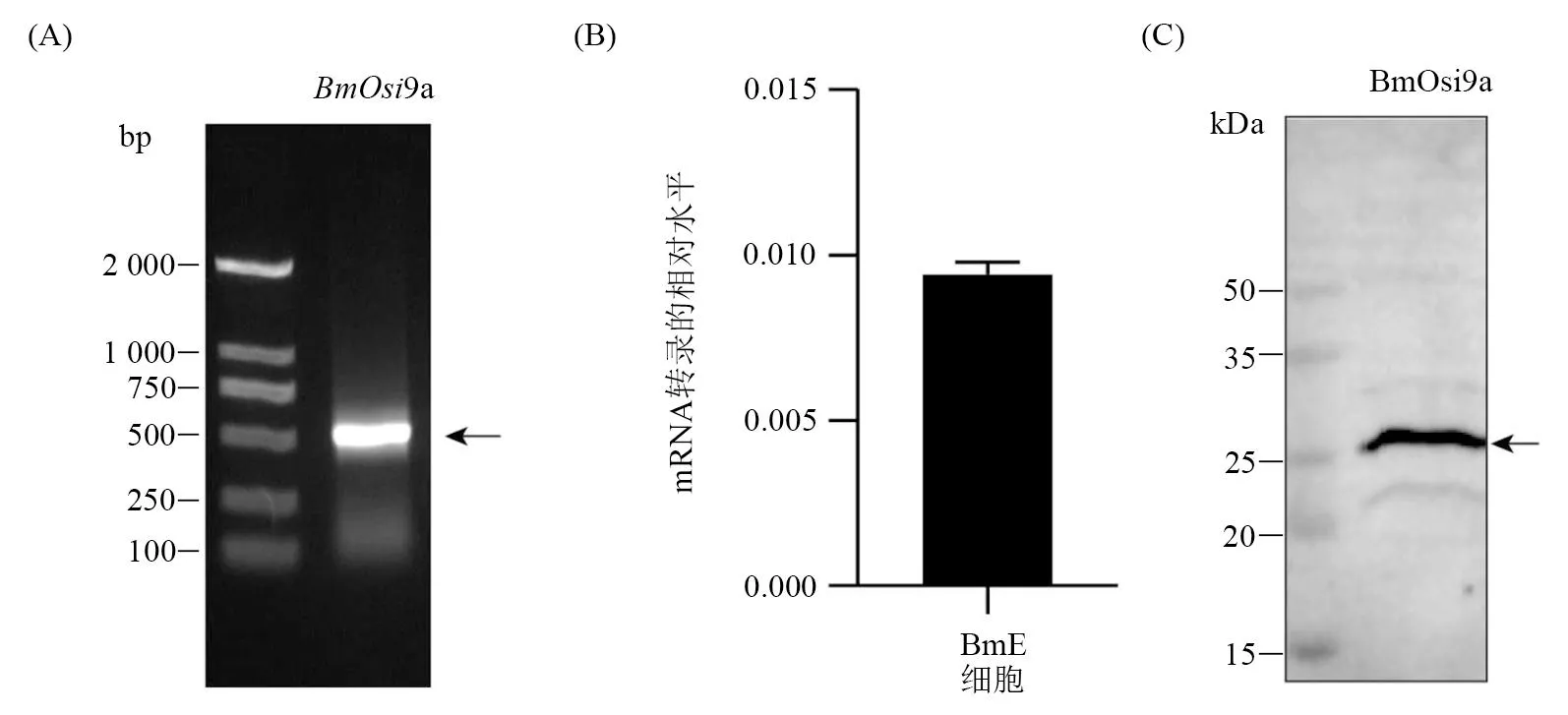
(A) RT-PCR (B) RT-qPCR (C) Western blot图1 BmOsi9a基因在BmE细胞中的表达分析
2.2 BmOsi9a蛋白的亚细胞定位
为了准确确定BmOsi9a基因在家蚕胚胎细胞BmE中的表达定位情况,采用免疫荧光技术,通过抗体来检测和可视化BmOsi9a蛋白的位置,结果如图2所示:BmOsi9a定位于细胞质。细胞质是细胞内许多重要的生物过程和活动发生的场所,包括信号传导、蛋白质合成、代谢调控等。BmOsi9a在细胞质中的定位提示其可能在调节这些生物过程中发挥着功能性的角色。
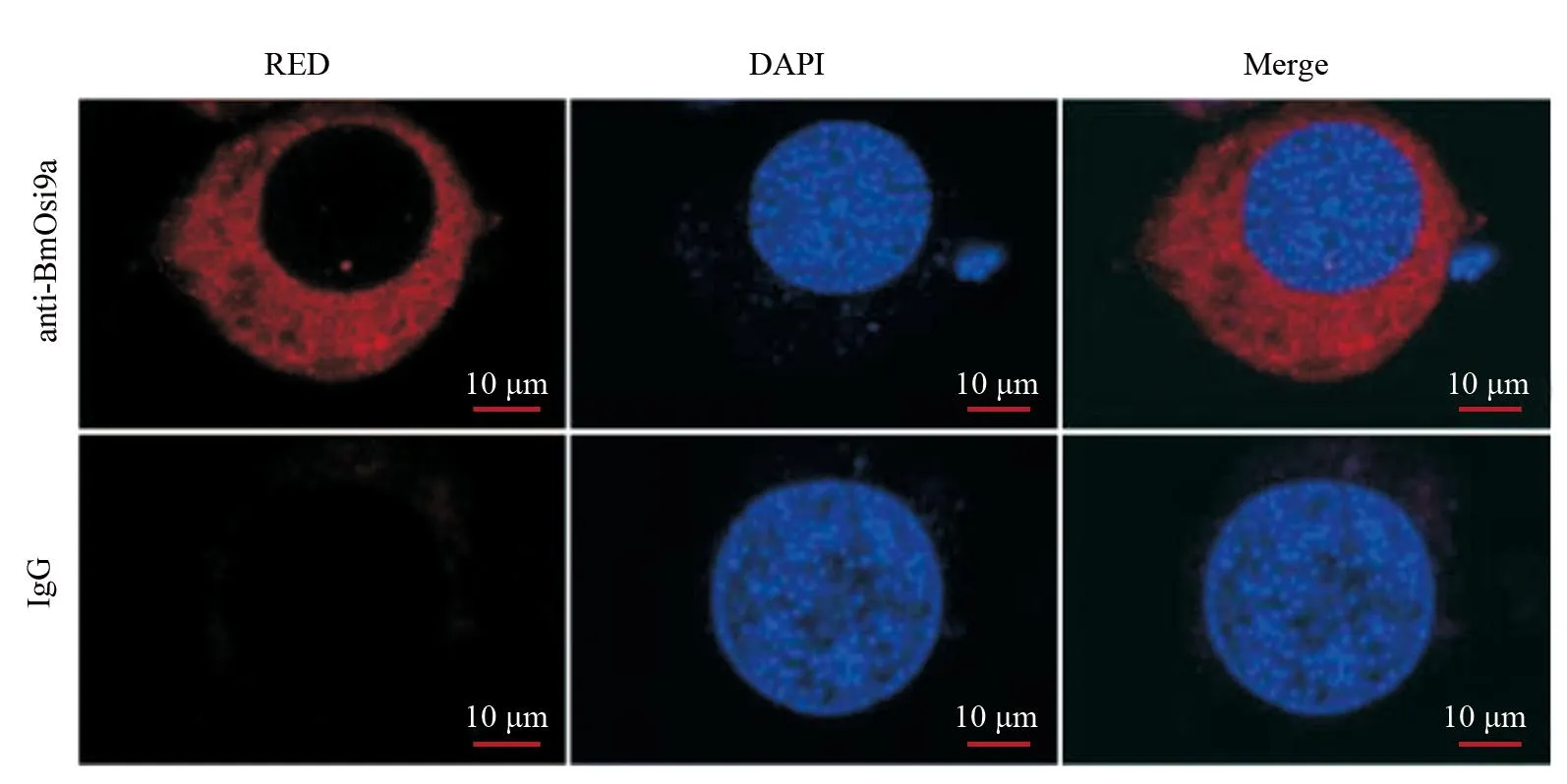
图2 免疫荧光实验观察BmOsi9a蛋白在BmE中的亚细胞定位
2.3 过表达BmOsi9a对细胞增殖能力的影响
为了探索BmOsi9a在BmE细胞中的功能,通过构建BmOsi9a过表达载体(图 3-A),使BmOsi9a基因成功在BmE细胞中过表达(图 3-B),该基因的mRNA水平和蛋白质水平都已经显著上调。BrdU实验显示BmE细胞的BrdU阳性率无明显变化,表明细胞的DNA合成能力无显著变化,即过表达BmOsi9a并未对细胞增殖产生显著影响(图3-C)。

(A) 1180-BmOsi9a阳性克隆的PCR检测(B) 蛋白质及mRNA水平检测BmOsi9a上调表达,“****”示P<0.000 1(C) BrdU实验检测上调BmOsi9a后对BmE细胞增殖无影响图3 上调BmOsi9a表达对BmE细胞增殖的影响观察
2.4 下调BmOsi9a对BmE细胞增殖能力的影响
通过构建BmOsi9a细胞干涉载体,在BmE细胞中降低了BmOsi9a蛋白的表达水平(图4-A)。与对照组相比,实验组细胞的形态发生了明显的改变,血球计数板显示的细胞数量也明显减少,推测下调BmOsi9a抑制了细胞增殖。为了验证这一猜想,我们进行了BrdU实验,发现下调BmOsi9a后,DNA复制的细胞数目显著减少,细胞增殖受到抑制(图4-B)。

(A) 蛋白质及mRNA水平检测BmOsi9a下调情况(B) BrdU实验检测下调BmOsi9a后BmE细胞增殖受到抑制,“****”示P<0.000 1。图4 下调BmOsi9a表达抑制BmE细胞增殖的观察
2.5 下调BmOsi9a对BmE细胞周期的影响
细胞周期是细胞增殖的基础,我们推测BmOsi9a可能诱导了细胞周期阻滞进而影响了细胞增殖。为此,进一步使用流式细胞技术来检测细胞周期是否发生改变,结果显示:下调BmOsi9a后BmE细胞系的细胞周期发生了明显的变化,与对照组相比,实验组处于G0期/G1期的细胞显著增加,而处于S期的细胞则显著减少(图5-A),由此表明细胞周期被阻滞在G0期/G1期。为了更加明确地阐释下调BmOsi9a对细胞周期的影响,通过Western blot实验从分子水平检测下调BmOsi9a对细胞周期蛋白的影响,结果表明:与G0期/G1期相关的细胞周期蛋白依赖性激酶CDK4、CDK2以及细胞周期蛋白CyclinE1的表达水平随着BmOsi9a的下调也明显降低(图5-B)。

(A) 流式细胞术检测下调BmOsi9a后细胞周期受阻的情况(B) Western blot检测下调BmOsi9a后细胞周期相关蛋白表达水平, “***”示P<0.001,“*”示P<0.05。图5 下调BmOsi9a表达阻滞BmE细胞周期的检测
3 讨论
本研究采用多种技术手段,包括RT-PCR、RT-qPCR、Western blot、RNAi以及细胞周期分析等,对BmOsi9a的功能进行了初步探索。研究结果表明,在BmE细胞中,BmOsi9a蛋白主要定位于细胞质。细胞质中有许多其他细胞器和亚细胞结构相互作用,因此BmOsi9a可能参与调节这些结构和器官的功能。进一步做细胞干涉实验发现,下调BmOsi9a后抑制BmE细胞增殖,并且将细胞周期阻滞在G0期/G1期。这些结果表明BmOsi9a在细胞分裂过程中发挥着重要的作用,并且对细胞增殖具有显著的影响。
然而,在BmE中过表达BmOsi9a后,对细胞增殖却无明显影响,推测可能有如下原因:(1)BmE本身已经处于高增殖状态,BmOsi9a表达量的增加对细胞的增殖就显得微不足道;(2)基因剂量效应,过表达BmOsi9a基因后,可能由于基因的过量表达导致细胞内某些调节机制的负向反馈或抑制作用,使得细胞增殖没有被促进;(3)调节基因的时机和空间表达,BmOsi9a基因的调节可能在细胞生命周期的不同阶段和细胞不同区域发挥作用,过表达BmOsi9a基因可能导致其在不适当的时机或空间过量表达,从而未能促进细胞增殖。
未来可以进一步探索BmOsi9a在细胞分裂调控中的作用机制,并且探究其与细胞周期相关蛋白的相互作用关系。此外,可以考虑研究其在其他昆虫中的作用,并且还可以结合系统生物学的方法,探究BmOsi9a对于细胞生长和分化等生物过程的调控机制,为深入阐释其生物学功能提供更多的证据和基础理论。

