基于Nrf 2/HO-1启动子筛选抗水生病毒药物的方法
王靖雯, 吴苗苗, 李莉娟,2, 顾泽茂,2, 袁军法,2*
(1. 华中农业大学水产学院,湖北 武汉 430070;2. 华中农业大学,水生动物疫病专业实验室,湖北 武汉 430070)
水生动物病毒病种类多、流行广、传播快、死亡率高,是限制水产养殖业绿色发展的重要因素[1-2]。因抗病毒药物缺失、疫苗种类有限,水生动物病毒病的防控始终是水产养殖中的难点,筛选绿色、广谱的抗病毒药物,建立高效防控技术体系是水生动物病毒研究的核心目标[3-4]。氧化应激是鲤春病毒血症病毒(spring viremia of carp virus,SVCV)、草鱼呼肠孤病毒(grass carp reovirus,GCRV)等多种病毒感染的主要病理机制之一[5-6]。抗氧化通路作为一种内源性的防御机制,除维持机体氧化-还原平衡稳态外,还可拮抗丙型肝炎病毒(hepatitis C virus,HCV)和SVCV等多种病毒,而萝卜硫素、雷公藤红素等作为药食同源的抗氧化剂,也被证实具有较好的抗病毒作用[7-8]。因此,靶向抗氧化通路,筛选具有抗病毒作用的抗氧化剂,可为开发绿色、广谱的抗水生病毒药物提供新思路[9]。
核转录因子E2相关因子2(Nrf2)是细胞中氧化应激的主要传感器,可启动下游包括血红素加氧酶1(HO-1)在内的抗氧化及解毒基因的转录与翻译[10]。HO-1是将血红素分解为胆绿素、Fe2+和CO的关键酶,在维持机体氧化还原平衡方面起关键作用[11-12]。此外Nrf2/HO-1信号通路还广泛参与到机体的生长、分化、代谢、免疫等多种生命过程中,通过其下游醌氧化还原酶1(NQO-1)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化/二相解毒酶维持机体的稳态[13-14]。Nrf2/HO-1信号通路是机体最重要的抗氧化防御系统,姜黄素、萝卜硫素、雷公藤红素等药物可通过激活Nrf2介导的HO-1表达来缓解病毒感染引起的氧化应激并抑制病毒复制[7-8,15-16]。靶向Nrf2/HO-1信号通路的抗病毒药物,通过激活抗氧化和抗炎症等内源性防御通路发挥作用,具有广谱性。这些药物不直接作用于病毒本身,减少了耐药性的产生,为开发绿色高效的抗病毒药物提供了靶标。
胖头鱥上皮细胞(FHM)对SVCV、RGV、大口黑鲈弹状病毒(Micropterus salmoidesrhabdovirus,MSRV)、传染性胰脏坏死病毒 (infectious ancreatic necrosis virus,IPNV) 等多种水生动物病毒敏感,是病毒诊断、致病机制与病毒复制规律研究的重要材料[17-19]。本实验利用胖头鱥(Pimephales promelas)基因组数据,分析并构建了Nrf2、HO-1启动子报告质粒,建立靶向其启动子活性的药物筛选方法,为抗水生动物病毒的药物筛选提供了基础工具和新的思路。
1 材料与方法
1.1 实验材料
实验所用FHM细胞系、SVCV、RGV均为本实验室保存。
1.2 药物与主要试剂
DNA提取试剂盒购自江苏康为世纪生物科技股份有限公司;2X M5 HiPer plusTaqHiFi PCR mix (with blue dye) 、胶回收试剂盒购自北京聚合美生物科技有限公司;DNA Marker、DH5α菌株购自北京擎科新业生物技术有限公司;限制性内切酶购自TaKaRa公司;T4 DNA连接酶购自武汉爱博泰克生物科技有限公司;低内毒素真核质粒提取试剂盒购自Magen公司;胎牛血清、M199培养基、0.25%EDTA胰酶以及OPTI-MEM培养液购自Gibco;FishTrans转染试剂购自武汉美森特生物科技有限公司;姜黄素[95%(HPLC),S19245]、白藜芦醇(BR, 98%,S30630)、穿心莲内酯(98%,S24818)、水飞蓟宾[98%(HPLC),Y53945]购自上海源叶生物科技有限公司;CCK-8试剂盒购自Biosharp公司;pGL3- Basic、pRLTK1、双荧光素酶报告基因检测试剂盒购自Promega公司;pTOPO001 Simple Cloning Kit载体试剂盒购自北京金沙生物科技有限公司;TRIzol、反转录及定量试剂盒购自南京诺唯赞生物科技股份有限公司;引物合成与测序由北京擎科新业生物技术有限公司完成。
1.3 FHM Nrf2、HO-1基因启动子的生物信息学分析
利用NCBI数据库[National Center for Biotechnology Information (nih.gov)]获取FHMNrf2(Gene ID: 120459756、NCBI Reference Sequence:XM_039647189.1)和HO-1(Gene ID: 120467971、NCBI Reference Sequence: XM_039656609.1)的基因组DNA序列及mRNA序列,利用AnimalTFDB3.0[AnimalTFDB3 (hust.edu.cn)]、JASPAR(JASPAR -A database of transcription factor binding profiles(genereg.net))在线软件对转录因子结合位点进行预测。利用MethPrimer软件[MethPrimer | Tools and Databases | The Li Lab (urogene.org)]预测CpG岛。
1.4 质粒载体的构建
根据胖头鱥基因组序列设计扩增引物(表1),上下游引物的酶切位点以下划线表示。提取FHM细胞的DNA,进行PCR扩增。 PCR体系共20 μL∶2X M5 HiPer plusTaqHiFi PCR mix (with blue dye)10 μL,DNA模板1 μL,上下游引物各0.5 μL,ddH2O 8 μL 。反应程序∶95 °C预变性3 min,94°C变性 25 s,根据引物Tm值设置退火温度,退火25 s,72 °C延伸(10~15 s / kb ),35个循环;72°C延伸5 min。PCR 产物经 1.0% 的琼脂糖凝胶电泳检测有明亮单一条带后切胶回收。将纯化后的扩增产物与pGL3-basic 载体进行双酶切处理。回收纯化后的启动子片段和载体按物质的量 3∶1 混合,T4 DNA 连接酶 16 °C连接 12 h,转化入DH5α 感受态细胞,涂布氨苄西林(Amp)抗性的平板,37 °C倒置培养12 h。对单菌落进行菌液PCR检测,将阳性菌送测序,验证序列是否正确。

表1 引物序列Tab. 1 Primer sequences
1.5 细胞培养及瞬时转染
FHM细胞用含有10% FBS的M199培养基培养,培养温度为28 °C,待细胞平铺长满孔板的80%~90%进行转染。转染试剂、质粒的配比及操作步骤按FishTrans转染试剂使用说明进行。
1.6 启动子活性分析
为评价药物的细胞毒性,使用含不同浓度药物的培养基(0、3.1、6.3、12.5、25.0、50.0、100.0、200.0 μg/mL)对FHM进行药物处理,同时设置阴性对照 (negative control, NC) 和二甲基亚砜 (DMSO)组,每个浓度设置6个重复,28 °C继续培养24 h后每孔加入10 μL CCK-8试剂在培养箱内继续孵育2.5 h,酶标仪于450 nm处测量吸光值,计算细胞活力。
转染重组启动子质粒及pRL-TK质粒24 h后,将白藜芦醇、水飞蓟宾、穿心莲内酯和姜黄素4种药物以10.0 μg/mL的浓度同细胞孵育,28 °C作用24 h后,按双荧光素酶报告基因检测试剂盒操作说明进行荧光素酶活性检测。再次转染重组启动子质粒及pRL-TK质粒,24 h后将上述初步筛选有效的药物—水飞蓟宾、穿心莲内酯、姜黄素,进行梯度稀释,选取基于药物细胞毒性实验确定的6个药物浓度(0、3.1、6.3、12.5、25.0、50.0 μg/mL)对细胞进行处理,28 °C作用24 h后,检测药物浓度梯度对启动子活性的影响。
1.7 抗病毒实验
以6.3 μg/mL的姜黄素和穿心莲内酯分别预处理细胞6 h,再分别以0.1感染复数 (multiplicity of infection,MOI)的SVCV和RGV进行感染,28 °C孵育1 h后更换为含相应药物浓度的培养基继续培养。收取细胞上清液及细胞样,测定病毒滴度及病毒复制水平,验证基于启动子活性的药物筛选策略。将收集的细胞培养上清连续10倍稀释(10−1~10−10),每个梯度6个重复,加入细胞培养板,每孔100 μL,同时用稀释液做阴性对照,培养7 d后观察并记录全部孔的细胞病变,再根据Reed-Muench两氏法计算出病毒滴度。
以RGV9506 (GenBank: JQ654586.1)的MCP序列(ORF97R)设计引物,建立RGV的绝对定量方法,评价药物对RGV感染的影响。提取细胞样DNA,以RGV感染组DNA样品为模板进行PCR扩增,回收后按pTOPO001 Simple Cloning Kit载体试剂盒说明进行连接、转化及阳性克隆的鉴定。提取标准重组质粒并测量浓度,然后依据公式计算每微升样品中质粒拷贝数∶每微升质粒拷贝数( 拷贝 / μL) = 质粒总质量( μg / μL) /质粒分子量;质粒分子量 = 2 × 330 × nt(其中 nt 为质粒的碱基数) 。标准重组质粒进行10倍的梯度稀释后定量检测,得到标准曲线。提取细胞样的DNA,进行实时荧光定量PCR(qPCR) 实验对 RGV进行定量,RGV定量引物如表1所示。定量检测SVCV-G的转录水平,评价药物对SVCV复制的影响。提取细胞样的总RNA并反转录为cDNA后进行qPCR,对SVCV G蛋白的mRNA水平进行定量检测,SVCV-G定量引物如表1所示。
1.8 统计分析
所有实验数据均采用双样本等方差t检验进行处理,*,P< 0.05; **,P< 0.01 或 ***,P< 0.001。
2 结果
2.1 Nrf2、HO-1基因启动子的生物信息学分析
通过NCBI数据库获取Nrf2和HO-1的DNA序列,分别选取编码区(CDS区)起始密码子ATG前后2482和2104 bp作为Nrf2和HO-1基因启动子候选区,利用Animal TFDB3.0、JASPAR等软件分别对Nrf2和HO-1启动子区的转录因子结合位点进行预测,结果显示,Nrf2和HO-1启动子区存分别存在FOXO、ATF、IRF、AP-1、FOS和Nrf2、Bach1、SP-1、STAT等多种潜在转录因子结合位点(图1)。利用MethPrimer预测到Nrf2启动子中存在一个CpG岛,位于2125~2243 bp,而HO-1启动子中存在3个CpG岛,分别位于53~156 bp、704~852 bp、1156~1276 bp(图2)。
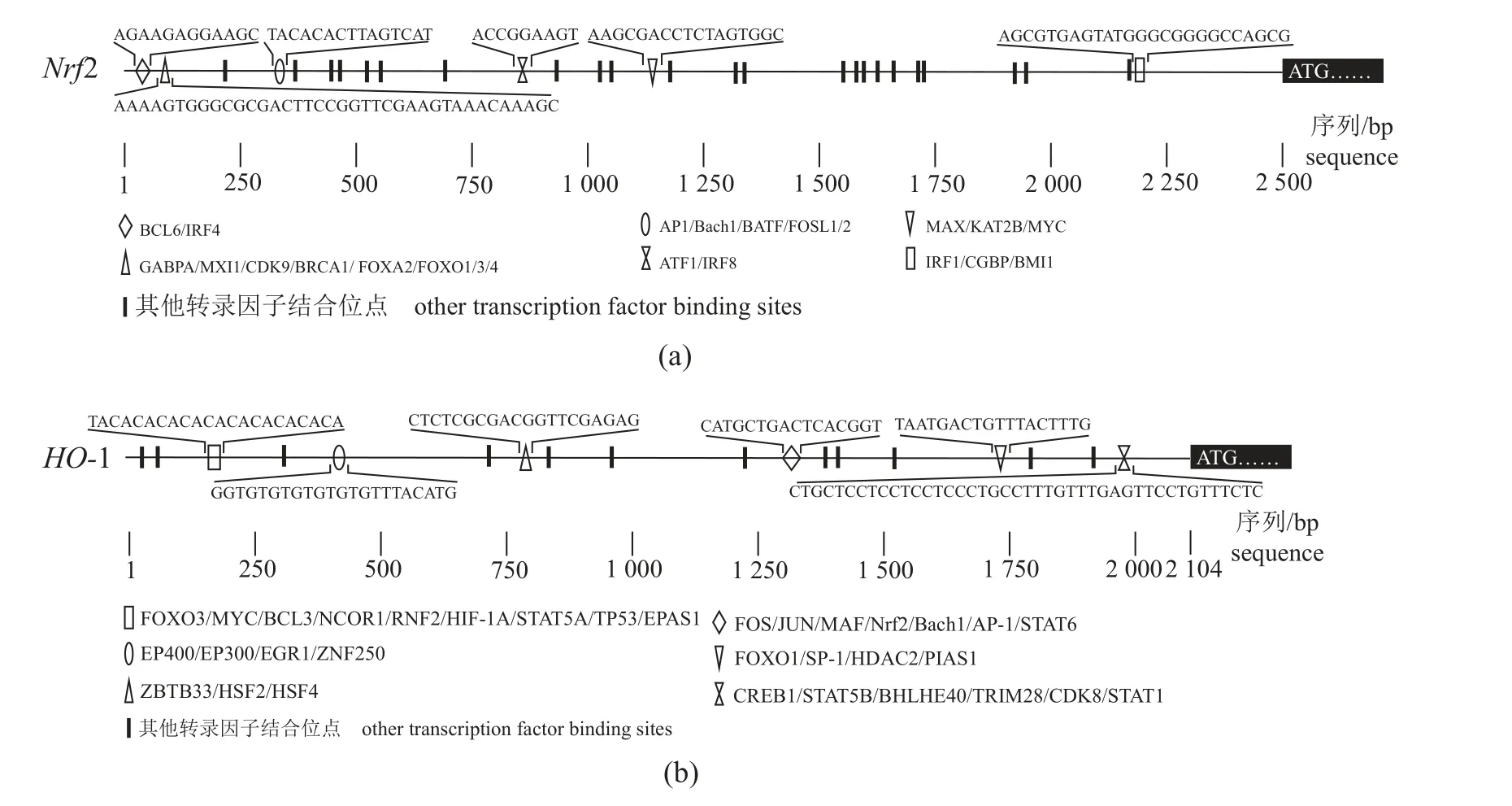
图1 FHM Nrf2(a)和HO-1(b)基因启动子区转录因子结合位点预测Fig. 1 Predicted transcription factor binding sites in the promoter region of FHM Nrf2 (a) and HO-1 (b) genes

图2 FHM Nrf2(a)和HO-1(b)基因启动子序列CpG岛预测结果Fig. 2 Predicted results of CpG islands of promoter sequences of FHM Nrf2 (a) and HO-1 (b) genes
2.2 Nrf2和HO-1基因启动子片段的扩增和报告载体的构建
构建FHMNrf2、HO-1启动子报告质粒(图3-a)。PCR扩增Nrf2和HO-1基因启动子片段,回收后分别使用KpnⅠ、XhoⅠ和XhoⅠ、Hind III限制性内切酶对扩增片段及pGL3-Basic进行双酶切,1%的琼脂糖凝胶电泳检测结果(图3-b)。结果显示,在2000 bp附近及2000~3000 bp存在单一明亮的特异性条带,与预期的大小一致,经连接、转化、阳性单克隆菌液PCR及测序后确认获得pGL3-Nrf2和pGL3-HO-1重组双荧光素酶质粒。

图3 FHM Nrf2、HO-1启动子报告质粒的构建(a) Nrf2、HO-1启动子报告质粒构建流程图,(b) Nrf2基因启动子片段及pGL3-Basic质粒的双酶切,(c) HO-1基因启动子片段及pGL3-Basic质粒的双酶切;1. pGL3-Basic质粒双酶切产物,2. Nrf2基因启动子片段双酶切产物,3. pGL3-Basic质粒双酶切产物,4. HO-1基因启动子片段双酶切产物,M. 分子质量标准DL5000。Fig. 3 Construction of FHM Nrf2 and HO-1 promoter reporter plasmids(a) flow chart for the construction of FHM Nrf2, HO-1 promoter reporter plasmid, (b) double digestion of Nrf2 gene promoter fragment and pGL3-Basic plasmid, (c)double digestion of HO-1 gene promoter fragment and pGL3-Basic plasmid; 1. pGL3-Basic plasmid double digestion product, 2. Nrf2 gene promoter fragment double digestion product, 3. pGL3-Basic plasmid double digestion product, 4. HO-1 gene promoter fragment double digestion product, M. molecular quality standard DL5000.
2.3 基于启动子活性的药物筛选
选取白藜芦醇、水飞蓟宾、穿心莲内酯和姜黄素4种中草药有效成分来探究药物对Nrf2和HO-1启动子活性的影响,验证启动子的活性。细胞毒性实验显示,4种药物的浓度在25.0 μg/mL以下时对细胞无明显毒性(图4),当浓度升至50.0 μg/mL时,除姜黄素外,其他3种药物的细胞存活率均大于70%。
以10.0 μg/mL的药物浓度进行初步筛选实验。结果显示,水飞蓟宾和姜黄素可显著上调Nrf2的启动子活性,而穿心莲内酯和姜黄素则可显著上调HO-1的启动子活性(图5)。选取以上3种有效药物,对不同浓度药物刺激下的启动子活性进行检测,结果显示,6.3 μg/mL的水飞蓟宾可有效上调Nrf2和HO-1的启动子活性;穿心莲内酯各浓度均未能显著激活Nrf2的启动子,相反,3.1~50.0 μg/mL的穿心莲内酯均可显著激活HO-1启动子,其中6.3 μg/mL的效果最为显著;姜黄素中除因药物毒性导致细胞大量死亡的50.0 μg/mL,其他浓度均可显著上调Nrf2的启动子活性,但只有6.3 μg/mL的姜黄素浓度可显著上调HO-1的启动子活性(图6)。

图5 四种药物对Nrf2 (a)、HO-1 (b) 启动子活性的影响1. 对照,2. 白藜芦醇,3. 水飞蓟宾,4. 穿心莲内酯,5. 姜黄素;*.表示差异显著(P<0.05);下同。Fig. 5 Effects of four drugs on Nrf2 (a) and HO-1 (b)promoter activity1. control, 2. resveratrol, 3. silybin, 4. andrographolide, 5. curcumin; *.means the difference is significant (P<0.05); the same below.

图6 不同药物浓度对Nrf2、HO-1启动子活性的影响(a)~(c)分别表示不同浓度的水飞蓟宾、穿心莲内酯和姜黄素对Nrf2启动子活性的影响,(d)~(f)分别表示不同浓度的水飞蓟宾、穿心莲内酯和姜黄素对HO-1启动子活性的影响;1. NC,2. 3.1 μg/mL,3. 6.3 μg/mL,4. 12.5 μg/mL,5. 25.0 μg/mL,6. 50.0 μg/mL。Fig. 6 Effect of different drug concentrations on the activity of Nrf2 and HO-1 promoters(a)-(c)the effects of different concentrations of silybin, andrographolide and curcumin on Nrf2 promoter activity, (d)-(f)the effects of different concentrations of silybin, andrographolide and curcumin on HO-1 promoter activity; 1. NC,2. 3.1 μg/mL, 3. 6.3 μg/mL, 4. 12.5 μg/mL, 5. 25.0 μg/mL, 6.50.0 μg/mL.
2.4 抗病毒活性
为验证姜黄素和穿心莲内酯激活Nrf2和HO-1的启动子是否与抗病毒活性关联,分别以姜黄素和穿心莲内酯对FHM细胞进行孵育,再分别以RGV和SVCV感染FHM,以含相应浓度药物的维持培养基继续培养。结果显示,SVCV和RGV感染可诱导细胞产生明显的CPE,姜黄素和穿心莲内酯的处理可显著缓解病毒感染引起的细胞病变(图版)。
构建的RGV荧光定量标准曲线(y=-3.413x+40.60)具有较好的线性关系(图7)。姜黄素处理组和穿心莲内酯处理组可分别减少约40%和60%的RGV拷贝量;姜黄素处理组和穿心莲内酯处理组较对照组分别下调约20%和60%的SVCVG水平。滴度结果也证实,药物处理可减少培养基上清中的病毒粒子含量,其中穿心莲内酯的效果更为显著,RGV和SVCV的病毒滴度分别下降了25%和23%(图8)。

图7 靶向MCP基因的RGV定量标曲Fig. 7 Quantitative standard curve of RGV targeting MCP gene

图8 药物的抗病毒活性检测(a) 绝对/相对定量检测病毒的复制水平,(b) 药物处理后病毒的滴度检测;1. 病毒感染组,2. 姜黄素组,3. 穿心莲内酯组。Fig. 8 Detection of antiviral activity of drugs(a) absolute/relative quantification of viral replication levels, (b) titer detection of viruses after drug treatment; 1. virus infection group, 2. curcumin group, 3. andrographolide group.
3 讨论
启动子是基因的开关,位于结构基因5‘端的上游,与转录因子一起,从起始时间和表达程度上对基因的转录进行调控[20]。本实验对Nrf2、HO-1启动子区的转录因子结合位点及CpG岛进行了预测。Nrf2启动子序列中预测到的潜在转录因子结合位点较为分散,其中存在与细胞增殖、凋亡、分化和炎症相关的ATF家族,涉及细胞生长发育及代谢周期调控的FOX家族,以及IRF 家族的结合位点。HO-1启动子序列中的潜在转录因子结合位点较为集中,其中FOS、JUN、MAF、BACH1、AP-1、Nrf2等HO-1转录调控中常见的转录因子集中在1240~1260 bp。在人(Homo sapiens)的HO-1启动子序列中同样预测到IRF-1、AP-1和STAT的结合位点[21]。CpG岛主要分布在启动子区,CpG岛的甲基化可影响转录因子的结合,对基因的表达产生负调控作用[22]。牙鲆(Paralichthys olivaceus)的Nrf2启动子中存在2个CpG岛,且急性缺氧可显著降低CpG岛的甲基化,促进Nrf2的表达。与牙鲆不同,胖头鱥的Nrf2启动子中预测到1个CpG岛[10]。 人类的HO-1启动子区中存在一个长307 bp的CpG岛,而胖头鱥的HO-1启动子中预测到3个预测的CpG岛[21]。此外研究表明,Nrf2启动子区域rs13005431位点的多态性变化会改变Nrf2的转录活性,影响对结核病的易感性;哺乳动物的HO-1启动子的多态性也被证明与肺部和心脑血管等疾病密切相关[23-24]。但水生动物鲜有启动子多态性与疾病联系的相关研究,相关研究的展开将对抗病育种具有积极意义。
近年来,关于Nrf2/HO-1信号通路参与病毒复制及病理机制的研究逐渐深入。Nrf2和HO-1具有广谱的抗病毒活性,HO-1可诱导IFN-1表达并抑制HCV的NS3/4A蛋白酶活性;Nrf2介导的HO-1表达还可抑制寨卡病毒(Zika virus,Zika)及单纯疱疹病毒1型(herpes simplex virus-1,HSV-1)等病毒的增殖[7,25-26]。研究已证实多种药物可靶向Nrf2和HO-1信号通路发挥抗病毒作用∶青蒿的类黄酮衍生物DMO-CAP处理可诱导p38丝裂原活化蛋白激酶(MAPK)、JNK/MAPK和ERK/MAPK磷酸化,激活Nrf2/HO-1,抑制甲型流感病毒(influenza A virus,IAV)的增殖[27];青蒿琥酯通过激活AMPK依赖的Nrf2/HO-1信号通路来抑制猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的复制[28]。鱼类中也有研究表明,萝卜硫素、香豆素衍生物BBC和α-脂质酸可靶向于Nrf2/HO-1通路抑制SVCV和病毒性出血败血症病毒(viral hemorrhagic septicemia virus,VHSV)[8,29-30]。靶向内源性防御通路Nrf-2/HO-1的抗病毒策略为广谱抗病毒药物的筛选提供了新的思路,基于此,本实验构建了Nrf2、HO-1的启动子报告质粒,评价了靶向Nrf2/HO-1启动子活性的抗病毒药物筛选方法。该方法利用灵敏度高、检测线性范围广的荧光素酶报告系统,以荧光信号强度定量表示启动子活性的强弱。与靶向病毒基因的药物筛选方式相比,该方法不受病毒种类的限制,适用于所有可引起氧化应激的水生生物病毒,具有广谱性,也不易产生耐药性[31]。与基于活体实验及细胞病变程度的传统药物筛选方法相比,该方法筛选周期短,易于操作与重复,可用于抗水生病毒药物初筛[32]。
姜黄素可通过PKC的磷酸化激活Nrf2;穿心莲内酯可通过p38/MAPK的磷酸化促使Nrf2入核介导HO-1的表达,以发挥其抑制HCV、COVID-19等多种病毒的抗病毒作用[15,33-35]。本研究也证实姜黄素和穿心莲内酯可激活FHMNrf2、HO-1的启动子活性,抑制RGV和SVCV的增殖。白藜芦醇是常见的多酚之一,被普遍认为具有抗氧化、抗癌症等功能。研究表明白藜芦醇在3.1~100.0 μmol/L时均可显著激活HEK293T细胞中抗氧化元件(ARE)的启动子活性,在50.0 μmol/L时可激活PI3K/Akt介导的Nrf2信号通路以减轻氧化应激诱导的肠道屏障损伤。本实验以10.0 μg/mL的浓度进行药物初筛时,白藜芦醇并未激活FHMNrf2、HO-1的启动子活性[36-38]。随着对白藜芦醇研究的逐渐深入,其保护作用开始出现争议∶白藜芦醇可增强HCV的复制,不适用于慢性丙型肝炎的抗氧化治疗;存在双相刺激剂量依赖性反应及昼夜节律,即在低剂量下及暗期为抗氧化剂,存在保护作用,高剂量下及光照期作为促氧化剂,通过下调PKB/Akt的磷酸化增加氧化应激[36,39-41]。这些均表明白藜芦醇的抗氧化效应在不同细胞、浓度、状态下不同。
本实验分析并构建了胖头鱥Nrf2、HO-1启动子报告质粒,并在此基础上建立了基于抗氧化信号通路的抗病毒药物筛选方式,分别以DNA病毒RGV和RNA病毒SVCV验证了该药物筛选方式的有效性,为鱼类抗病毒药物的高效快速筛选提供了新方法。
(作者声明本文无实际或潜在的利益冲突)

