绿原酸抑制LPS诱导的RAW264.7细胞炎症及机制探索
周云鑫 刘 柯 丁军颖
近年来,部分地区抗生素使用不规范,加之抗生素的应用与多重耐药和泛耐药细菌的传播之间存在时间差,导致抗生素耐药性逐年升高[1,2]。其中,耐药菌感染所致肺炎主要表现为获得性肺炎,在临床获得性感染疾病中占第1位,治疗颇具挑战,给患者和社会带来了沉重的经济负担[3]。
中医药治疗耐药菌感染因不易引起耐药而备受关注,耐药菌属风热之邪,侵袭机体首先犯肺,其所致肺炎核心病机为正气不足,邪毒内伏[4]。芪归银方由黄芪、当归、金银花、青蒿和虎杖五味药合理配伍而成,为扶正透邪治则经典方,契合耐药菌所致肺炎病机,且前期研究证实芪归银方治疗耐药菌所致肺炎临床疗效肯定[5]。绿原酸为芪归银方中金银花和青蒿共同药理成分且在芪归银方中含量较高,此外,在动物模型中绿原酸已被证明可以减少炎症并调节炎症和神经性疼痛[6]。
在机体免疫应答的诸多细胞中,巨噬细胞以其对非特异免疫应答不可替代的作用而受到广泛关注[7]。在炎性疾病中,巨噬细胞在病程的不同阶段表型发生相应的改变,以维持、加剧或者抑制、终止炎性反应[8]。芪归银方治疗耐药菌所致肺炎疗效肯定,但其机制尚不完全明确。为此,本研究以脂多糖(lipopolysaccharide, LPS)诱导巨噬细胞RAW264.7炎症,探讨芪归银方重要成分绿原酸对RAW264.7细胞炎症的抑制作用及可能的机制,以期为耐药菌所致肺炎的中医药防治提供可能的治疗策略。
材料与方法
1.细胞与试剂:小鼠巨噬细胞(RAW264.7)购自中国科学院细胞库(上海);DMEM购自美国Hyclone公司;胎牛血清、0.25%胰酶购自美国Gibco公司;LPS(纯度≥98%)、绿原酸(纯度≥98%)购自上海碧云天生物技术有限公司;CCK-8试剂盒购自日本同仁化学研究所;小鼠白细胞介素-1β(interleukin-1beta, IL-1β)、精氨酸酶-1(arginase-1, Arg-1)及单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)的ELISA试剂盒购自上海酶联生物科技有限公司;DMSO购自美国Sigma公司;SG高纯总RNA提取试剂盒、Thermo First cDNA Synthesis Kit及One-Step miRNA RT Kit购自北京信诺金达生物科技有限公司。
2.RAW264.7细胞培养与分组:巨噬细胞以含15% FBS的DMEM进行复苏,于恒温培养箱(37℃,5%CO2)中培养,倒置显微镜下动态监测细胞生长情况。生长密度达到85%,按1∶2以含10% FBS的DMEM进行传代,取对数生长期的细胞用于实验。将处于对数生长期的细胞接种于6孔板(5×105/ml,每孔2ml),各组分别进行不同干预:模型对照组(L组),以LPS刺激RAW264.7,使LPS终浓度达到1μg/ml;实验组(S组),以LPS刺激RAW264.7,使LPS终浓度达到1μg/ml,加入以不含FBS的DMEM为溶剂的绿原酸,使绿原酸终浓度达到50μg/ml;空白对照组(K组),加入同等体积的不含FBS的DMEM。
3.细胞活性检测:将处于对数生长期的RAW462.7细胞接种于96孔板(1×105/ml,每孔100μl)。参考文献[9]并结合前期实验,设置校正组、空白对照组(K′,0μg/ml)、不同浓度绿原酸组(S12.5、S25、S50、S100及S200,即12.5、25、50、100及200μg/ml)。校正组中只含有等体积不含FBS的DMEM,空白对照组中含细胞及不含FBS的DMEM,绿原酸组中含细胞及不同浓度的绿原酸,每组3个样本,每个样本设置3个复孔,于恒温培养箱中(37℃,5%CO2)培养24h。检测前2h每孔加入10%的CCK-8溶液,避光孵育2h,酶标仪检测450nm处的吸光度。实验结果以细胞活性表示,细胞活性(%)=(绿原酸组A450-校正组A450)/(空白对照组A450-校正组A450)×100%。
4.ELISA检测炎性细胞因子浓度:培养48h后获取上清及沉淀。根据ELISA试剂盒说明书操作,终止显色后,立即检测各组A450,分别绘制ELISA标准曲线,依据曲线公式,结合稀释倍数求得IL-1β、Arg-1及MCP-1的浓度。
5.qPCR检测mRNA表达:采用Trizol直接裂解法分别提取不同组别样本的总RNA,按照反转录试剂盒(Thermo First cDNA Synthesis Kit)将总RNA反转录为相应cDNA,再以cDNA为模板进行扩增。反应条件:95℃预变性10min,95℃变性30s,60℃退火,40个循环。引物序列详见表1。所有样本进行3个重复,取循环阈值(CT)平均值,反应内参均为Actin。采用2-△△Ct相对定量法进行分析。

表1 引物序列
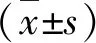
结 果
1. 不同浓度绿原酸干预下RAW264.7的细胞活性:经不同浓度绿原酸处理的RAW264.7细胞活性,说明12.5~200.0μg/ml的绿原酸对RAW264.7细胞无明显毒性作用(P>0.05),其中50μg/ml的绿原酸对RAW264.7细胞有显著的提高细胞活性的作用,差异有统计学意义(P<0.05),详见图1。
图1 不同浓度绿原酸预处理后RAW264.7的细胞活性*P<0.05,**P<0.01
图2 不同干预方式及时间点RAW264.7的细胞形态(×100)
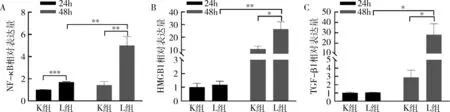
图3 LPS诱导的RAW264.7细胞中炎性细胞因子的mRNA水平

图4 细胞上清中炎性细胞因子及极化标志物的含量
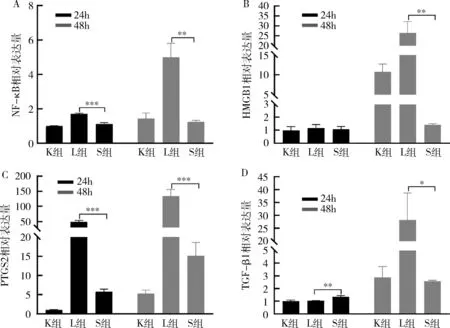
图5 细胞中炎性细胞因子及通路因子的mRNA水平
2.最佳浓度绿原酸干预下不同时间点RAW264.7的细胞形态:以1μg/ml的LPS刺激巨噬细胞,倒置显微镜下细胞形态,在24h及48h时,K组细胞呈圆形或椭圆形,与K组比较,L组增殖状态无明显区别,而细胞形态变化明显,表现为L组巨噬细胞伪足明显,长梭形细胞增多;相较于L组,S组细胞增殖明显,此外,从形态上看,S组伪足减少,梭形细胞减少(图2)。
3.LPS预制RAW264.7的细胞炎性状态:以qPCR法检测1μg/ml浓度的LPS刺激RAW264.7后24、48h时的炎性细胞因子核转录因子-κB(nuclear transcription factor-kappaB, NF-κB)、转化生长因子β1(transforming growth factor-beta1, TGF-β1)及高迁移率族蛋白1(high mobility group box-1, HMGB1)的mRNA表达,与K组比较,L组除24h时HMGB1、TGF-β1的mRNA表达水平比较,差异无统计学意义外(P>0.05),24h时NF-κB的mRNA表达显著升高并且48h时NF-κB、HMGB1及TGF-β1表达均显著升高,差异有统计学意义(P<0.05),此外,各炎性因子mRNA表达随时间延长而增加,差异有统计学意义(P<0.05),详见图3。
4. 细胞上清中炎性细胞因子及极化标志物的水平:与K组比较,L组炎性细胞因子IL-1β及MCP-1的含量明显升高,差异有统计学意义(P<0.05),且M2极化标志物Arg-1的含量明显下降;S组中,IL-1β含量明显降低,而Arg-1含量明显上升,差异有统计学意义(P<0.05),详见图4。
5.绿原酸处理后炎性细胞因子及通路因子的mRNA表达结果:RAW264.7巨噬细胞经LPS刺激后产生炎症,引起相应的炎性细胞因子的表达改变。S组中绿原酸显著抑制LPS诱导24h及48h的RAW264.7细胞中的NF-κB、TGF-β1及前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2, PTGS2)的mRNA水平。此外,S组可降低LPS刺激24h时炎性通路关键因子HMGB1的mRNA水平,差异无统计学意义(P<0.05),并且显著降低LPS刺激48h时HMGB1的mRNA水平,差异有统计学意义(P<0.05),详见图5。
讨 论
耐药菌所致肺炎,究其核心病机,当属正气不足,邪毒内伏,故而以扶正透邪为组方原则的芪归银方契合耐药菌所致肺炎的病机,且有研究报道芪归银方可明显延缓耐药菌对抗生素的耐药性,有效提高抗生素疗效,探究其机制发现,可能是通过调节机体免疫应答,影响T、B等细胞及相关细胞因子实现的[10]。绿原酸是芪归银方重要活性药理成分,是一种具有生物活性的酚酸类物质,具有抗氧化活性、抗菌、抗炎、解热、抗病毒等作用[11~13]。有研究显示,小鼠感染肺炎克雷伯杆菌后,绿原酸治疗组,尤其是绿原酸+抗生素治疗组显著降低了血清中炎性细胞因子的水平,改善了小鼠存活率和肺病理变化,证实绿原酸可有效减轻肺炎克雷伯杆菌感染小鼠的肺部感染,与抗生素合用可增强其抗菌作用[14]。本研究以LPS预制RAW264.7炎症,同样发现绿原酸可降低炎性相关通路因子水平及炎性细胞因子水平,发挥抑制巨噬细胞炎症的作用。
HMGB1是免疫网络的核心调控分子,可通过促进对无菌或感染性刺激的免疫反应在调节先天性免疫和适应性免疫中发挥关键作用[15]。HMGB1参与免疫反应的方式多样,经研究证实,通过递送LPS和促进内吞作用,HMGB1可激活非经典抗炎途径并诱导细胞凋亡,揭示HMGB1是调节炎症的重要靶点[16]。NF-κB是一个转录因子家族,因它能够调节参与建立免疫和炎性反应的基因的转录,因此被认为是炎性反应的关键调节因子[17]。炎症会诱导HMGB1激活NF-κB信号通路,继而维持炎性微环境[18]。本实验通过对通路相关因子mRNA水平的检测,提示绿原酸抑制炎性反应的作用可能是通过HMGB1调控NF-κB通路实现的。
IL-1β及MCP-1是炎性反应中的标志性因子,MCP-1又称趋化因子(CC基序)配体2(C-C motif chemokine ligand 2, CCL2),来自CC趋化因子家族,可吸引或增强其他炎性细胞因子/细胞的表达,在炎症应答过程中起重要作用,近年来研究显示,在人类多种肺部疾病中均有表达异常升高的现象[19,20]。本实验中检测各组上清中IL-1β及MCP-1蛋白浓度结果显示,与模型对照组比较,实验组显著降低了IL-1β的水平。PTGS2是参与前列腺素生物合成的关键酶,有研究提示PTGS2在炎症期间水平升高,此外,慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)异常炎症与PTGS2密切相关,提示PTGS2可作为潜在的炎症标志物[21]。同样,转化生长因子-β(transforming growth factor-β, TGF-β)可通过抑制T、B细胞的增殖分化,降低NK细胞的杀伤作用及补体系统的溶菌作用,调节巨噬细胞的吞噬能力及对抗病原微生物的反应能力,来达到调节免疫炎性反应的作用[22]。本实验检测各组mRNA水平发现,绿原酸组明显降低各炎症标志物的mRNA水平,这表明绿原酸具有明确降低LPS诱导的RAW264.7细胞炎性反应的作用。
巨噬细胞在免疫反应中有着不可替代的作用,通过吞噬、递呈抗原和分泌细胞因子参与免疫反应[23]。由于不同的刺激,巨噬细胞可以极化成几个不同的亚群,其中交替激活或抗炎M2型巨噬细胞主要由一些细胞因子(IL-4、IL-10和IL-13)、糖皮质激素、免疫球蛋白复合物或Toll样受体等刺激分化而来[24]。M2型巨噬细胞可控制炎症和适应性Th2免疫,支持血管生成,修复受损组织,清除碎屑,还可引起过敏性炎症、帮助肿瘤组织生长[25]。Arg-1是经典的M2型巨噬细胞标记因子[26,27]。本实验中检测M2型巨噬细胞的活化状态,结果显示经LPS干预后,上清中Arg-1水平明显下降,而经过绿原酸处理后显著升高,提示绿原酸调节巨噬细胞极化可能是绿原酸发挥抗炎作用的一种途径。
综上所述,绿原酸对LPS诱导的RAW264.7细胞炎症具有明确的抑制作用,其机制可能是通过调控HMGB1介导的NF-κB通路,进而抑制炎性细胞因子的表达,从而发挥抗炎作用,这为耐药菌肺炎的中医药防治提供了潜在的靶点及可能的策略。

