桡动脉桥使用策略对冠状动脉旁路移植术中桥血流及早期通畅性的影响
韩增强 范桄溥 赵舟 史艺 陈彧
目的:分析桡动脉桥的不同使用策略对冠状动脉旁路移植术(CABG)中桥血流及早期通畅性的影响。
方法:回顾性分析2019年1月至2021年12月我院使用桡动脉桥行CABG 的99 例患者临床资料,其中男性92例(92.9%),平均年龄(57.2±8.7)岁。按桡动脉桥近端吻合部位不同分为升主动脉组(n=79,吻合在升主动脉)和复合桥组(n=20,吻合在其他桥血管上)。应用瞬时流量测定技术测量桥血流各项参数,围术期及术后1年行冠状动脉CT 血管造影(CTA),评价桥血管通畅情况。
结果:术前两组患者的一般临床资料差异均无统计学意义(P 均>0.05)。全部患者无围术期死亡。与升主动脉组比,复合桥组行微创CABG 比例更高,桡动脉桥平均血流量更高(P 均<0.05)。围术期冠状动脉CTA 显示桡动脉桥失败24 例(24.2%);与升主动脉组比,复合桥组桡动脉桥失败率更低,但两组间差异无统计学意义(27.8% vs.10.0%,P=0.096)。术后1年桡动脉桥失败改善至16 例(16.1%)。与桡动脉桥通畅患者比,围术期桡动脉桥失败患者术中桡动脉桥搏动指数较高,桡动脉桥平均血流量较低(P 均<0.05);术后1年桡动脉桥失败患者术中桡动脉桥搏动指数较高,桡动脉桥远端吻合在右冠状动脉患者占比较高(P 均<0.05)。
结论:桡动脉桥近端吻合在升主动脉或其他桥血管上并不影响其围术期通畅性。围术期失败的桡动脉桥术后1年有再通现象。术后1年失败患者术中桡动脉桥搏动指数较高,桡动脉桥远端吻合在右冠状动脉患者占比较高。
随着冠状动脉旁路移植术(CABG)的发展及对远期疗效要求的提高,左乳内动脉(LIMA)与左前降支的吻合已成为常规术式。然而,在目前的临床实践中第二支动脉桥血管的选择并不统一。桡动脉是一种应用广泛的桥血管材料,但由于临床证据不足、术后桡动脉桥痉挛等问题导致CABG 患者中桡动脉桥的应用并不普及,美国及中国对桡动脉桥的使用率均不足10%[1]。因此,我们有必要对行桡动脉桥的患者进行基线资料、术中吻合方式及术后的结果等进行全面分析,并对影响桡动脉桥通畅率的因素进行分析,为将来的桡动脉桥的应用提供帮助。
1 资料与方法
1.1 临床资料
2019年1月至2021年12月我院有99 例冠心病患者使用桡动脉桥行单纯CABG,其中男性92 例(92.9%),平均年龄(57.2±8.7)岁。所有患者桥血管均采用LIMA 和桡动脉,桥血管数量多者在此基础上使用右乳内动脉(RIMA)或大隐静脉,全部实现完全再血管化。使用桡动脉桥的指征:(1)有合适的靶血管部位(右冠状动脉狭窄≥90%,左冠状动脉狭窄≥70%)[2-3];(2)Allen 试验阳性。实现桥血管全动脉化患者40 例(40.4%),其中24 例(24.2%)同时使用RIMA;另59 例(59.6%)患者同时应用动脉桥和静脉桥。术前根据临床症状及冠状动脉造影结果明确诊断。按照桡动脉桥近端吻合部位不同分为升主动脉组(n=79,吻合在升主动脉)和复合桥组(n=20,吻合在其他桥血管上)。本研究经北京大学人民医院伦理委员会审批(编号:2019PHB214-01),入选患者对本人的治疗情况均知情同意。
1.2 手术方法
经左胸微创CABG 者,采用双腔气管插管,左前胸第五肋间切口约6~8 cm,进胸后单肺通气;传统CABG 则采用单腔气管插管,正中切口入路,选择LIMA、桡动脉、RIMA 及大隐静脉作为桥血管,体外或非体外循环下行完成桥血管吻合。使用复合桥者,首先完成复合桥的构建,然后依次完成远端靶血管吻合。桡动脉复合桥的构建方式有两种,即“I”型和“Y”型,I 型桥,将桡动脉与乳内动脉端端吻合;Y 型桥,将桡动脉与乳内动脉或大隐静脉近端端侧吻合。全部血管吻合结束后,循环稳定后,在肝素中和前,根据血管直径选择不同规格的超声探头(2~4 mm),利用血流测定仪对桥血管进行血流测定。记录桥血管平均血流量、搏动指数、舒张期充盈率和血流波形等指标,并记录当时患者的心率和平均动脉压。对于测量结果不满意者,反复检查吻合口及桥血管无误后重新测量。
1.3 术后处理
围术期给予尼卡地平静脉泵入,拔管后常规给予阿司匹林+氯吡格雷双联抗血小板治疗,同时口服地尔硫草卓1年预防桡动脉桥痉挛。所有患者围术期和术后1年行冠状动脉CTA 检查,评价桥血管通畅情况。以Fitzgibbon 分级作为桥血管通畅性评价标准,冠状动脉CTA 结果显示桥血管B 级(狭窄50%~99%,由近端或远端吻合口或主干三个部位中狭窄程度最高的一个决定)或O 级(完全闭塞)视为桥血管“失败”,否则认为桥血管“通畅”[4]。
1.4 统计学方法
2 结果
2.1 两组患者一般临床资料比较(表1)
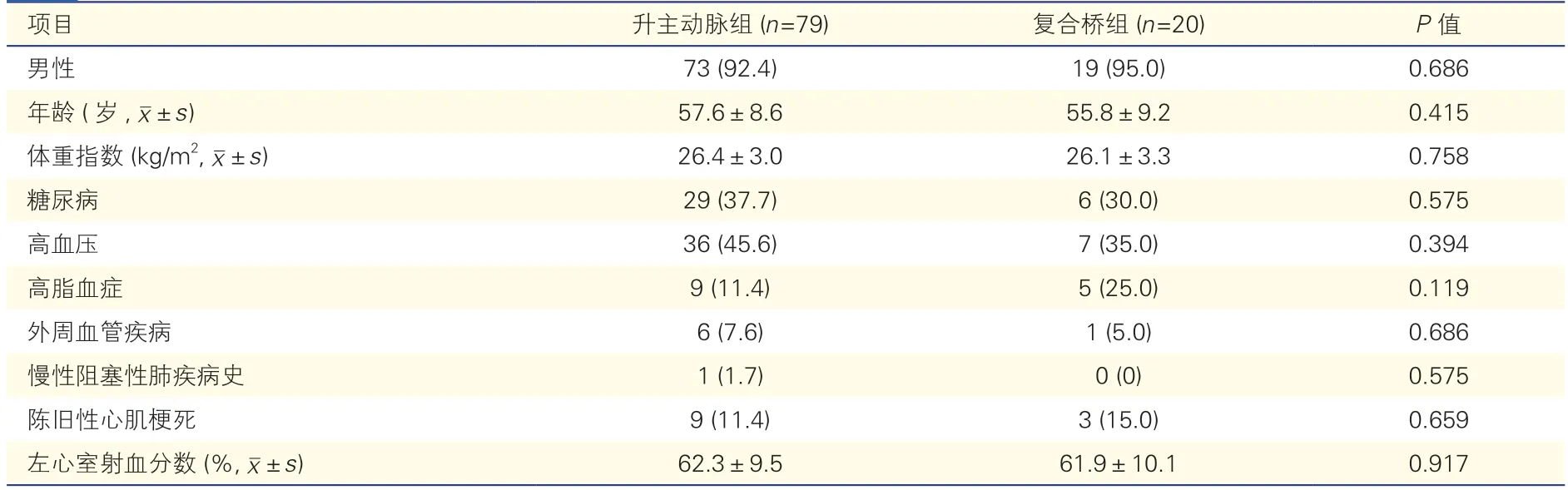
表1 两组患者一般临床资料比较[例(%)]
术前两组患者一般临床资料比较差异均无统计学意义(P均>0.05)。
2.2 两组患者手术资料比较(表2)
表2 两组患者手术资料比较(±s)

表2 两组患者手术资料比较(±s)
注:CABG:冠状动脉旁路移植术;ICU:重症监护病房。
项目升主动脉组(n=79)复合桥组(n=20)P 值全部桥血管远端吻合口平均数(个)3.0±0.93.1±0.60.736桡动脉桥远端吻合口平均数(个)1.1±0.31.3±0.50.052微创CABG[例(%)]5(6.3)8(40.0)0.000围术期心肌梗死[例(%)]3(3.8)1(5.0)0.807急性肾损伤[例(%)]2(2.5)1(5.0)0.565术后引流量(ml)1 311±6901 087±4290.265呼吸机使用时间(h)20.4±27.118.6±21.40.825 ICU 时间(h)49.8±55.747.0±45.40.826桡动脉桥搏动指数2.5±1.12.2±1.20.358桡动脉桥平均血流量(ml/min)36.5±20.147.1±23.30.048桡动脉桥舒张期充盈率(%)67.0±8.365.7±8.60.569
两组患者围术期无死亡。两组共应用桥血管298 支,其中动脉桥219 支,静脉桥79 支。桡动脉桥远端吻合口:87 例(87.9%)为单一吻合口(远端吻合口87 个),12 例(12.1%)为序贯桥(远端吻合口24 个),序贯桥吻合口最多为3 个。升主动脉组73 例(92.4%)为单一吻合口,6 例(7.6%)为序贯桥。复合桥组12 例(60%)为Y 型桥(桡动脉远端吻合口12 个,4 例吻合在左冠状动脉,8 例吻合在右冠状动脉),8 例(40%)为I 型桥(桡动脉远端吻合口14个,6 例吻合在左冠状动脉,2 例吻合在右冠状动脉)。与升主动脉组比,复合桥组微创CABG 比例更高,桡动脉桥平均血流量更高(P均<0.05)。
2.3 冠状动脉CTA 结果
围术期CTA 显示:所有乳内动脉桥通畅,2 支静脉桥闭塞。24 例(24.2%)桡动脉桥失败,其中升主动脉组22 例(19 支B 级,3 支O 级),复合桥组2 例(1 支B 级I 型桥,1 支O 级Y 型桥)。与升主动脉组比,复合桥组桡动脉桥失败率更低,但两组间差异无统计学意义(27.8% vs.10.0%,P=0.096)。与通畅患者比,失败患者术中桡动脉桥搏动指数较高,桡动脉桥平均血流量较低(P均<0.05),具体见表3。
表3 围术期桡动脉桥CTA 显影通畅患者与失败患者的手术资料比较(±s)

表3 围术期桡动脉桥CTA 显影通畅患者与失败患者的手术资料比较(±s)
注:CTA:CT 血管造影。
项目通畅患者(n=75)失败患者(n=24)P 值术中桡动脉桥搏动指数术中桡动脉桥平均血流量2.2±1.03.0±1.30.007(ml/min)41.2±22.630.3±12.80.004桡动脉桥舒张期充盈率(%)66.7±7.966.7±9.80.991桡动脉近端吻合在升主动脉[例(%)]57(76.0)22(91.7)0.096桡动脉近端吻合在其他桥血管上[例(%)]18(24.0)2(8.3)0.096桡动脉远端吻合在右冠状动脉[例(%)]38(50.7)14(58.3)0.513桡动脉远端吻合在左冠状动脉[例(%)]37(49.3)10(41.7)0.513
1年复查CTA 显示:乳内动脉和大隐静脉桥通畅率无变化,围术期通畅的桡动脉桥仍通畅,但是有8 例(33.3%,7 例单一吻合口,1 例序贯桥,共计9 支桡动脉桥)围术期失败的桡动脉桥显示再通(图1)。术后1年桡动脉桥失败改善至16例(16.1%)。与通畅患者比,失败患者术中桡动脉桥搏动指数较高,桡动脉远端吻合在右冠状动脉患者占比较高(P均<0.05),见表4。
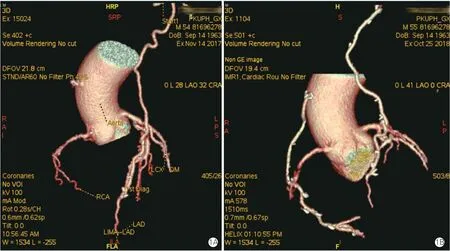
图1 围术期和术后1年CTA 影像
表4 术后1年桡动脉CTA 显影通畅患者与失败患者的手术资料比较(±s)

表4 术后1年桡动脉CTA 显影通畅患者与失败患者的手术资料比较(±s)
注:CTA:CT 血管造影。
项目通畅患者(n=83)失败患者(n=16)P 值术中桡动脉桥搏动指数2.3±1.03.2±1.50.040术中桡动脉桥平均血流量(ml/min)40.0±20.731.2±22.30.131桡动脉桥舒张期充盈率(%)67.3±8.263.8±8.90.120桡动脉近端吻合在升主动脉[例桡动脉近端吻合在其他桥血管上(%)]65(78.3)14(87.5)0.402[例(%)]18(21.7)2(12.5)0.402桡动脉远端吻合在右冠状动脉[例(%)]40(48.2)12(75.0)0.049桡动脉远端吻合在左冠状动脉[例(%)]43(51.8)4(25.0)0.049
3 讨论
LIMA 与左前降支的吻合,长期以来是公认的减少CABG 术后远期心脏事件,提高生存率的最佳策略[5-7],已成为冠心病治疗的一项金标准[8]。然而,第二支动脉桥血管包括RIMA、桡动脉、胃网膜右动脉等的选择,在目前的临床实践中并不统一,不同中心、不同术者的认知仍存在差异[9-13]。RIMA 因其获取时免于额外的手术切口、不易痉挛等优点成为常用选择,这种联合运用LIMA 和RIMA 进行CABG的技术称双侧乳内动脉(BIMA)CABG。然而,使用BIMA 的患者,术后更容易出现胸部切口感染、胸骨裂开、术区引流量增多等术后并发症。桡动脉是一种用途广泛且非常有用的桥血管材料,其长度理论上可以完成对任一靶血管的吻合;管壁可承受并适应来自主动脉的高压血流[14]。由于桡动脉的血管平滑肌层结构较厚,外界刺激容易诱发桡动脉出现早期痉挛,但经过较长时间的探索证实,特殊的外科技术如“不接触技术”以及围术期的抗痉挛药物使用可以在很大程度上预防桡动脉桥痉挛的发生[15-16]。除此以外,如何优化桡动脉桥的使用策略,预防桥血管痉挛,提高早期和中远期通畅率,对保证CABG 患者的术后疗效至关重要。我们采用桡动脉为99例患者进行CABG取得了较为理想的近期疗效,远期效果还需更大的样本量以及长期的随访观察。
桡动脉管壁厚度与升主动脉存在不匹配现象,尽管其管壁可以承受来自主动脉的高压血流,但将其连接在其他桥血管上构成复合桥可以避免高压血流对血管的刺激,减少痉挛风险。同时,复合桥的构建可以减少对升主动脉的操作,当患者合并升主动脉多发斑块,甚至瓷化主动脉时,其优势更明显。尽管差异无统计学意义,复合桥组术后早期桡动脉桥失败率更低。复合桥的使用可以大大降低经左胸微创手术中近端吻合的难度,尤其是“I”型桥使得微创CABG 更加简单易行。因此,本研究中复合桥组微创比例明显高于升主动脉组。通过血流比较发现,复合桥组中由于桡动脉使用序贯桥更多,因此平均血流更高。但有文献报道,乳内动脉序贯桥尽管可以增加其血流量,但是为了减少竞争血流,建议序贯口不超过4 个[17-18]。本研究中,序贯桥吻合口最多为3 个。
冠状动脉CTA 能准确地诊断桥血管通畅情况和吻合口狭窄程度[19],越来越广泛地应用于CABG术后随访。本研究全部患者围术期及术后1年均行CTA 检查,桡动脉通畅性要比乳内动脉和大隐静脉低。由于桡动脉桥的血管平滑肌层较其他动脉桥更厚,对外部创伤和机体释放的血管活性物质更加敏感,因此桡动脉桥血管更容易发生痉挛从而导致“线样征”。尽管两组间桡动脉桥失败率差异无统计学意义,但是复合桥组结果优于升主动脉组。而且值得兴奋的是,术后1年桡动脉再通率达到了33%(8/24)。以往研究显示,当冠状动脉狭窄程度不重或桥血管痉挛导致血流不足时,可以发生竞争或逆向血流,从而影响对比剂的填充,导致CTA 检查的判读误差。即临床上所说的“功能性闭塞”。桡动脉桥的再通现象,主要与两方面的因素有关。一是桡动脉桥血管的自身特性易出现痉挛、狭窄甚至闭塞,二是靶血管的竞争血流。由于围术期多种因素(对桥血管的牵拉、机体释放的血管活性介质、竞争血流等)的刺激,桡动脉桥在术后早期容易表现为病变,即在冠状动脉 CTA 上表现为狭窄、线样征,甚至闭塞。但随着术后抗痉挛药物的规律使用,时间推移,刺激因素的减轻以及桡动脉桥对冠状动脉血流的适应性提高,靶血管的原始狭窄变得更加严重时,桡动脉桥有可能从功能性闭塞状态恢复为通畅[20-21]。本研究中,桡动脉桥的移植策略为均移植至严重狭窄的靶血管(左冠状动脉狭窄≥70%或右冠状动脉狭窄≥90%)。无论围术期还是术后1年,失败患者搏动指数均高于通畅患者。术后1年失败患者桡动脉桥远端吻合在右冠状动脉患者占比较高(P<0.05),这与以往的报道一致[22-23]。本研究中,术后1年桡动脉通畅率比围术期明显改善,提示术后1年桡动脉存在再通的现象。随诊时间延长,自身冠状动脉病变加重,这一再通是否会进一步改善需要我们进一步随访观察。
随着技术与策略的不断完善,桡动脉桥由于其独特的优越性,未来将成为多动脉旁路移植桥血管更好的选择。
利益冲突:所有作者均声明不存在利益冲突

