术前增强MRI 特征对肝癌患者TACE 治疗术后反应性的预测价值
袁钰晓,侯勤明,王国伟,张晓晶
肝癌是全球第五大常见的恶性肿瘤,也是癌症相关死亡率的第三大原因[1]。指南建议对不可切除的肝癌进行经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE),因原发性肝癌的血供90%以上来自肝动脉,TACE 能有效减少肿瘤区的血供。但部分肝癌血供来自门脉,TACE 治疗可能无效[2]。因而术前预测何种肝癌患者TACE 治疗更受益意义重大。磁共振成像(MRI)为TACE 术后随访的重要影像学手段,肝脏成像报告和数据系统(LI-RADS)用于肝癌的诊断,已被大多数专家和医生广泛接受。最新研究发现,肿瘤边缘和动脉期瘤周强化是评估肝癌患者TACE后无复发生存率的独立指标[3]。且LI-RADS 的不均匀强化、镶嵌结构和脂肪团缺失可作为潜在的生物标志物,用于评估肝切除术后肝癌的组织学分级、微血管浸润和早期复发[4]。本研究探讨术前MRI特征对肝癌患者经TACE后功能结果的预测价值,现报道如下。
1 资料与方法
1.1 临床资料 回顾性收集2020 年6 月至2022 年12 月杭州市西溪医院收治的肝癌患者102 例,纳入标准:(1)符合肝癌诊断标准[5],经病理活检确诊;(2)符合TACE 指征;(3)接受MRI 检查。排除标准:(1)合并其他恶性肿瘤;(2)继发性肝癌;(3)合并活动性感染。本研究经杭州市第六人民医院(杭州市西溪医院)伦理委员会批准,患者免除知情同意。
1.2 方法
1.2.1 一般资料收集 TACE治疗前收集患者年龄、性别、体质量指数、肝癌病程、肝硬化、Child-Pugh分级、巴塞罗那分期系统(BCLC)分期、甲胎蛋白(AFP)、丙氨酸氨基转移酶(ALT)及碱性磷酸酶(ALP)。
1.2.2 TACE 治疗 所有患者均接受标准化的常规TACE 方案。2%利多卡因5 ml 局部麻醉后,在DSA仪(ArtisQCeiling,西门子)及5-F 导管下行腹部动脉造影,确定肿瘤位置、数量、大小、染色及供血动脉。肿瘤供血动脉用2.4F 微导管(Progreat 微导管系统,Terumo)超选择性插管,造影确认无动静脉瘘后,经导管缓慢注射表柔比星(辉瑞制药,H20000496,10 ml/支)20 mg/m2、洛铂(海南长安国际制药,H20080359,50 mg)30 mg/m2,再将导管插至癌灶供血动脉,将碘化油5 ~20 ml 充分混合后经供血动脉缓慢注入瘤灶至填塞满意。
1.3 MRI 检查 术前使用GE Signa HDxt 1.5T MR扫描仪及8 通道体部相控阵线圈。扫描前,受试者空腹4 h 以上,检查前20 min 行屏气训练。患者仰卧,膈顶至肝右叶下缘为扫描区域,行轴面、冠状面MRI 平扫,后使用MRI 双管高压注射器经肘静脉注射钆特醇注射液,速率2.0 ml/s,行动脉期、门静脉期和平衡期扫描。20 min 完成全肝扫描,获取肝胆特异期图像。由3 名影像科医师采用双盲法评估图像,评估可能反映肝癌病理特征的MRI 特征,包括最大肿瘤大小、数量、部位、边界、形态(规则、不规则)瘤内出血、包膜、肿瘤内脂肪(与同相图像相比,反相图像上信号强度降低的肿瘤区域)、瘤周动脉增强(肿瘤边缘外的新月形或多边形增强部分,在动脉期与肿瘤边界广泛接触,在延迟期与背景肝实质等强度)、增强包膜(门静脉或过渡期图像中平滑过度增强的外围边缘)、肝胆期瘤周低信号(肝胆期图像上位于肿瘤边缘外的肝实质楔形或火焰状低强度区域)、非富血供肝胆期低信号结节(NHHN)(与没有动脉期高增强的周围肝实质相比,在肝胆期图像上显示明确低强度的结节)。
1.4 术后治疗反应性评估 TACE 后随访3 个月,根据改良的实体瘤反应评估标准(mRECIST)[6]评定TACE 治疗反应性:若病灶消失,CT 或MRI 显示所有目标病灶内动脉期无增强显影为完全缓解;病灶总长径缩小30%以上为部分缓解;目标病灶(动脉期增强显影)的直径总和增加20%或出现新病灶为疾病进展;目标病灶(动脉期增强显影)的直径总和缩小未达部分缓解或增加未达到疾病进展为疾病稳定,将完全缓解和部分缓解定义为反应,疾病进展和疾病稳定为无反应。所有患者TACE 治疗反应性的评估由两位有5 年以上腹部影像诊断经验的医师进行。
1.5 统计方法 采用SPSS 22.0统计软件进行分析,计量资料经正态性检验,对于非正态分布资料应用变量转换法转为正态分布资料,以均数±标准差表示,采用t 检验;计数资料采用2检验;采用多因素Logistic 回归分析TACE 治疗反应性的影响因素,绘制ROC 曲线评估术前增强MRI 相关参数的预测效能。P <0.05 表示差异有统计学意义。
2 结果
2.1 TACE 治疗反应性 术后随访3 个月,其中48例MRI 显示所有目标病灶内动脉期无增强显影,病灶总长径缩小30%以上,归为反应组;其余54 例归为无反应组。
2.2 两组一般资料比较 反应组BCLC 分期A 期占比高于无反应组(P <0.05),见表1。
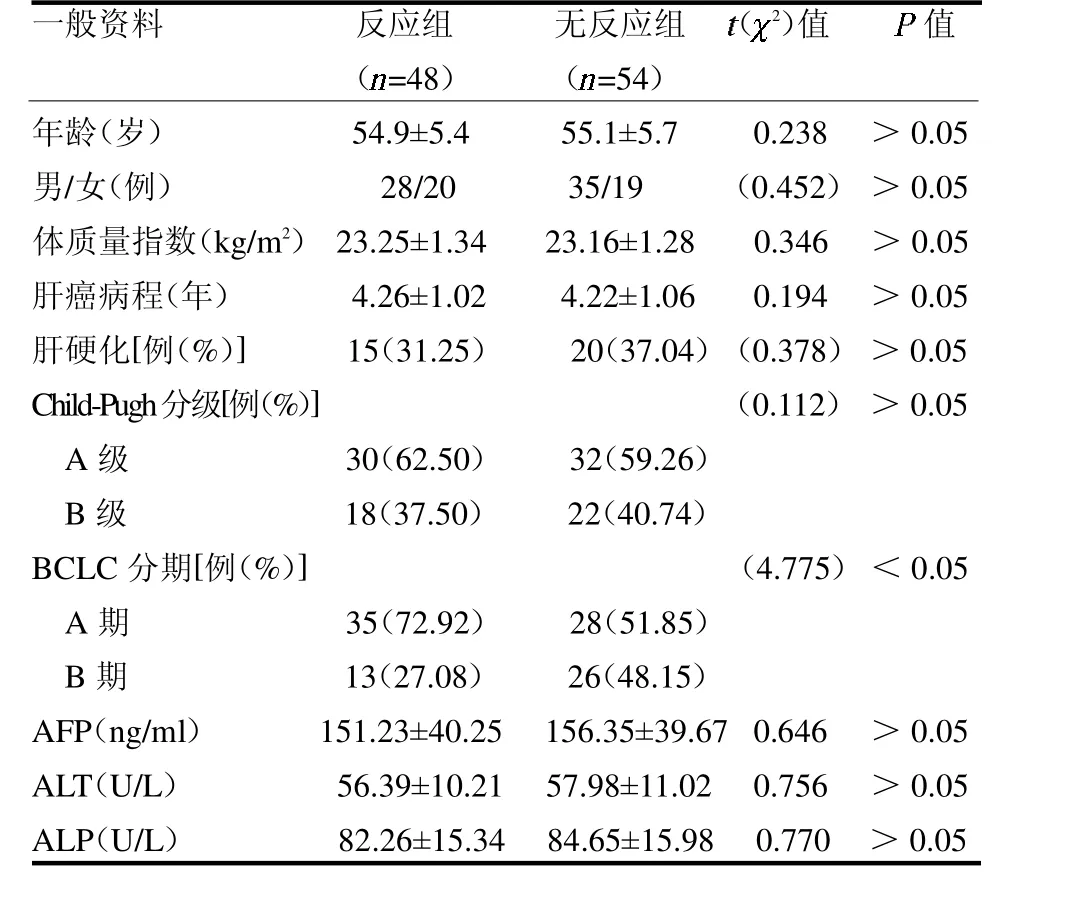
表1 两组一般资料比较
2.3 两组术前增强MRI特征比较 反应组肿瘤内脂肪存在占比高于无反应组,动脉期瘤周强化、肝胆期瘤周低信号、NHHN占比低于无反应组(均P<0.05),见表2。

表2 两组术前MRI 特征比较 例(%)
2.4 多因素Logistic回归分析 BCLC分期B期、动脉期瘤周强化、肝胆期瘤周低信号、NHHN 为肝癌患者TACE术后治疗无反应的危险因素,肿瘤内脂肪为肝癌患者TACE 术后治疗反应的保护因素(均P <0.05),见表3。

表3 肝癌患者TACE 术后治疗反应性的多因素Logistic 回归分析
2.5 术前增强MRI 特征对肝癌患者TACE 术后治疗反应性的预测效能 ROC 曲线分析结果显示:BCLC分期、动脉期瘤周强化、肝胆期瘤周低信号、NHHN、肿瘤内脂肪预测TACE 术后治疗反应性的AUC 分别为0.637(95CI%:0.535 ~0.730)、0.631(95CI%:0.530~0.724)、0.602(95CI%:0.500 ~0.697)、0.603(95CI%:0.501 ~0.699)、0.598(95CI%:0.497 ~0.694),见图1。

图1 术前增强MRI 特征预测肝癌患者TACE 术后治疗反应性的ROC 曲线
3 讨论
根据巴塞罗那临床肝癌指南的最新更新,TACE被推荐为中期肝癌患者的一线治疗[7]。且随着靶向分子和免疫疗法的发展,TACE 在临床实践中的作用逐渐增强。尽管如此,TACE 是基于局部化疗和栓塞供血血管的治疗原则,并不能使所有患者获得完全治愈,部分患者介入治疗1 年后效果逐渐下降[8]。影像学表现是评估介入治疗后疗效的主要依据,MRI诊断原发性肝癌主要基于肝癌的动脉血供和肝癌的分化程度,这为术前增强MRI 参数预测TACE治疗反应性提供了依据。
标准化的LI-RADS MR特征被认为是区分肝癌侵袭性行为和肝切除术后复发的标志物。最近一项研究报道,镶嵌结构能独立预测在LR-5 肝癌高危患者中的微血管侵犯,肿块中脂肪的缺失能预测肝癌复发[9]。本研究结果显示,在接受TACE 后获得反应的患者中,实体瘤中存在脂肪组织是一个重要和独立的标志物。Lengyel 等[10]发现实体瘤中脂肪与邻近肝脏的脂肪不同,这一结果可以解释为肿瘤中的脂肪变性往往代表高分化肝癌,而低分化肝癌则没有表现出这一特征,且低分化肝癌的生存预后较差。Ajmera等[11]发现,与不含脂肪的肝癌相比,MRI上含脂肪肝癌具有良好的预后,这与本研究结果一致。另外,与张广东等[12]研究不同的是,本研究未能发现肿瘤大小与TACE治疗反应性的关系,但BCLC分期是TACE 治疗反应性的一个独立因素。其可能为BCLC分期、肿瘤大小这两个变量具有相互作用。临床已广泛推荐BCLC分期用于肝癌的预后分析和治疗分层。Ren 等[13]研究表明,BCLC 分期系统是肝癌治疗性消融后预后的独立标志物,这与本研究结果类似。
既往研究报道,动脉期瘤周强化与肝细胞癌患者TACE 后的无复发生存率相关[14],与之研究相符的是,本研究发现动脉期瘤周强化是评估TACE 后无反应的预测因素,且肝胆期瘤周低信号也可预测TACE 治疗反应性。肿瘤边缘组织受侵犯,造成血流动力学及肝细胞功能改变,这意味着微血管侵犯,且代表了一种更具攻击性的生物学行为,使肿瘤血栓阻塞了肿瘤周围的门静脉分支,导致瘤周高灌注,而出现动脉期瘤周强化。结合Kuang 等[15]的研究结果,可以认为具有这种特征的肝癌患者无复发生存期更短。同时这些研究结果也为TACE 治疗后未达到完全缓解提供了依据,证明动脉期瘤周强化、肝胆期瘤周低信号与TACE 治疗无反应有关。
另外,随着增强MRI 在评估肝癌中的应用逐渐扩大,NHHN受到关注,作为一类具有恶性倾向的肝脏高危结节,被认为是一种边界病变,30%最终转化为高血管肝癌[16]。因此,NHHN 的存在被认为背景肝脏中的肝癌发生潜力增强。既往研究显示,NHHN是肝切除术后肝癌复发的一个重要风险因素[17]。本研究结果表明,NHHN 也是TACE 后治疗后非反应的一个重要因素。分析认为,NHHN 对TACE 的反应性较低,这是由于非血管性增生性质和TACE 后转化为肝癌的高风险所致。
综上所述,术前增强MRI特征显示肿瘤内脂肪、动脉期瘤周强化、NHHN 及肝胆期瘤周低信号有助于预测肝癌患者TACE 治疗的术后反应性。
利益冲突 所有作者声明无利益冲突

