重庆某三甲医院血培养阳性的特征分析*
阮 真,毛隆春,费 凌,李志强,张小琴,胡 娟,许商成,王 维Δ
1.重庆市第九人民医院检验科,重庆400799;2.重庆医药高等专科学校附属第一医院实验医学中心,重庆 400060
血流感染目前仍是我国乃至全球导致患者死亡的重要原因[1]。近年来由于抗微生物药物的不规范使用,血流感染的发生率及病死率都呈现上升趋势[2]。因此,临床诊疗活动中血培养检测技术和检测结果也受到广泛关注。
当临床怀疑血流感染时,血培养仍然是识别血循环中致病微生物的最佳方法,且迄今为止仍然是检测菌血症的金标准[3]。本研究收集重庆医药高等专科学校附属第一医院 2021 年1月至 2023年1月送检的血培养标本结果,并对血培养报阳后检出微生物、报阳时间、感染与污染、送检前用药情况、新型冠状病毒感染(COVID-19)等特征进行分析,以指导临床正确送检、分析、处置血培养结果。
1 资料与方法
1.1一般资料 回顾性分析2021年1月至2023年1月重庆医药高等专科学校附属第一医院住院部1 856例患者送检血培养的相关资料。
1.2仪器与试剂 采用 BacT/ALERT 3D(法国生物梅里埃公司)血培养仪及配套血培养瓶,VITEK-2 Compact(法国生物梅里埃公司)全自动微生物鉴定仪及配套鉴定药敏板,操作过程严格按照《全国临床检验操作规程》(第4版)进行。质控菌株大肠埃希菌ATCC 25922、大肠埃希菌ATCC 35218、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC 29213、粪肠球菌ATCC 29212均购自美国典型菌种保藏中心。室内质控均在控。
1.3方法 参照《临床微生物实验室血培养操作规范》采样送检血培养。成人在不同部位采集 2~3 套血培养标本,每瓶采血8~10 mL,采集结束后2 h内送入全自动血培养仪内培养,若不能及时送检,应将血培养瓶置于常温。当血培养仪报阳后取出阳性瓶,在安全柜中采用一次性注射器无菌穿刺取出血液进行涂片染色镜检,并通过电话向临床医生作初步报告。报告后根据染色结果选择接种适当平板培养。将平板中长出的纯菌落参照VITEK-2 Compact仪器操作要求配制适当浊度的菌悬液,根据纯菌落涂片染色等特征选择配套鉴定和药敏试剂卡上机并编号,仪器经过一定时间孵育后检测细菌生化反应和透光度变化,利用数值法进行鉴定和药敏试验判读,得出最终结果[4]。若出现以下情况中的一条及一条以上则判断为污染菌:无明显发热和高危因素;有明确其他原因可解释的发热和感染体征;多次血培养诊断为其他病原菌感染;使用敏感抗菌药物治疗无效;连续多次血培养仅一次阳性且为皮肤正常菌群。若出现以下情况中的一条及一条以上则判断为感染菌:发热具有感染体征,且无其他原因可解释的发热;白细胞升高或核左移;多次血培养为同一种微生物或1次血培养阳性且在患者其他感染部位存在相同耐药谱的相同微生物;具有易感危险因素如长期静脉插管或异体移植物;抗菌药物治疗有效,或拔除导管或异物后感染得到控制[5]。对于培养 5 d 仍未出现阳性的则报告阴性。

2 结 果
2.1血培养阳性检出微生物分布及送检情况 1 856例患者共送检血培养7 042瓶,其中6 389瓶(90.73%)为阴性,653瓶(9.27%)为阳性,共检出691株病原菌,见表1。691株病原菌中128株(18.52%)为仅需氧瓶报阳,57株(8.25%)为仅厌氧瓶报阳。非发酵菌和真菌均为仅需氧瓶报阳,脆弱拟杆菌为仅厌氧瓶报阳。1 856例患者中,有1 671例(90.03%)送检2套(共4瓶)血培养,173例(9.32%)送检1套(共2瓶)血培养,12例(0.65%)仅送检1瓶血培养,血培养送检2套者阳性率较高(P=0.038),见表2。
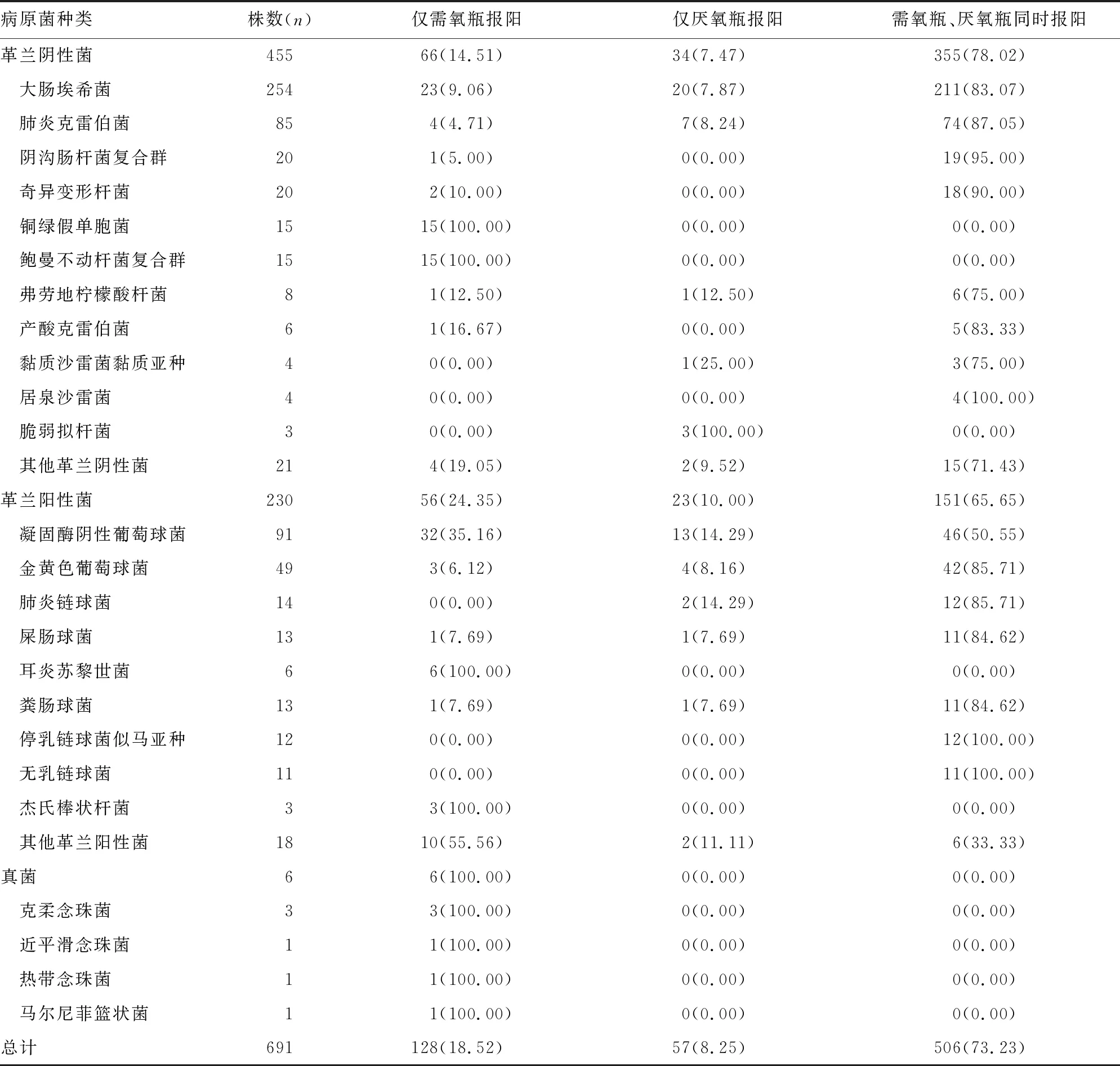
表1 血培养阳性结果病原菌的分布[n(%)]
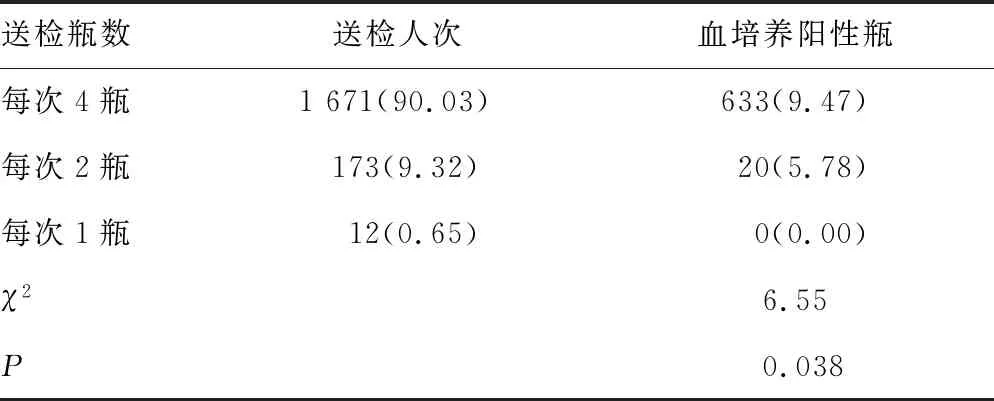
表2 血培养送检瓶数情况[n(%)]
2.2血培养阳性检出病原菌的分布情况 在691株血培养分离的病原菌中,549株(79.45%)为感染菌,109株(15.77%)为污染菌,33株(4.78%)临床意义未知,见表3。本研究中血培养总体污染率为1.55%(109/7 042)。最常见的引起血流感染的主要感染菌(分离数量≥20株)为大肠埃希菌(247株)、肺炎克雷伯菌(80株)、金黄色葡萄球菌(46株)、奇异变形杆菌(20株)。凝固酶阴性葡萄球菌检出数量较多,但仅有9.89%为感染菌。同样,80%以上检出的阳性杆菌也被判断为污染菌。而其他肠杆菌科、厌氧菌、β-溶血链球菌、真菌虽检出数量少,但均被判断为感染菌。污染菌数量分布前三科室分别为重症医学科(43株,39.45%)、康复科(22株,20.18%)、内分泌科(21株,19.27%)。
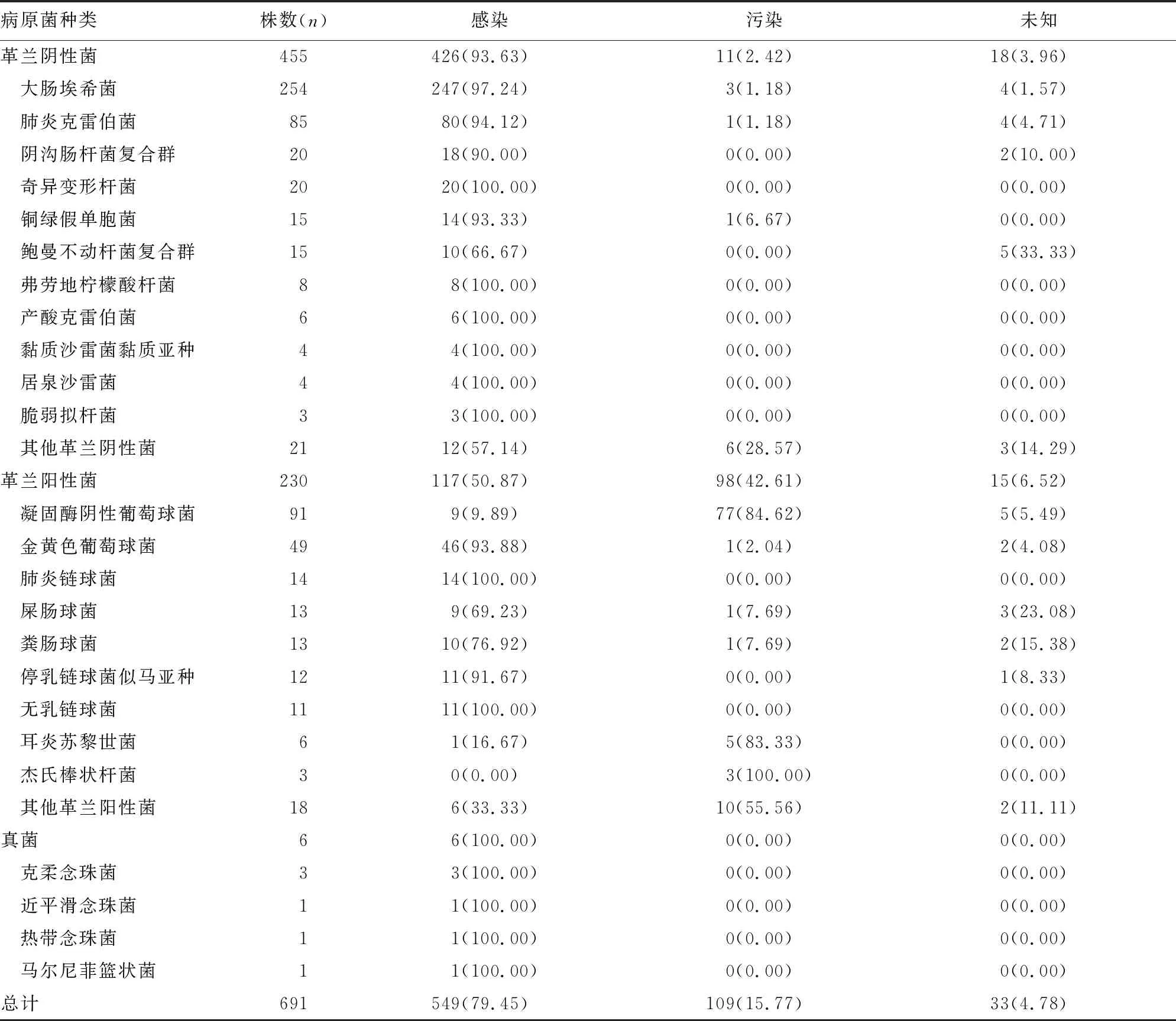
表3 血培养阳性检出病原菌分布[n(%)]
2.3血培养报阳时间分析 多数病原菌报阳时间集中在9~20 h,铜绿假单胞菌、脆弱拟杆菌、肺炎链球菌和真菌报阳时间在20 h以上。其中大肠埃希菌和凝固酶阴性葡萄球菌污染血培养报阳时间明显长于感染(P<0.05)。部分病原菌如肺炎克雷伯菌、铜绿假单胞菌和金黄色葡萄球菌等因污染数量较少尚无法进行统计学分析。见表4。

表4 血培养阳性检出病原菌报阳时间比较
绘制ROC曲线分析分离菌中常见菌株血培养报阳时间区分污染与感染的价值。结果显示:报阳时间21.96 h可作为区分血培养阳性瓶检出的大肠埃希菌污染与感染的最佳时间点,曲线下面积(AUC)为0.95,灵敏度为81.13%,特异度为93.33%;报阳时间18.12 h可作为区分血培养阳性瓶检出的凝固酶阴性葡萄球菌污染与感染的最佳时间点,AUC为0.88,灵敏度为70.00%,特异度为97.62%。见图1。
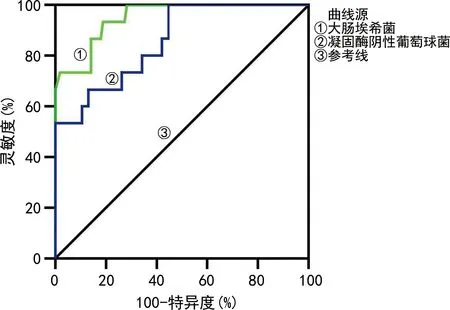
图1 大肠埃希菌、凝固酶阴性葡萄球菌血培养报阳时间区分污染与感染的ROC曲线
2.4送检时不同用药情况的血培养真阳性率比较 在送检的7 042瓶血培养中,有1 426瓶(20.25%)在送检前接受过抗微生物药物治疗,4 910瓶(69.72%)在送检前未接受抗微生物药物治疗,706瓶(10.03%)送检前用药情况未知;抗微生物药物治疗后送检的血培养真阳性率(6.31%)较抗微生物药物治疗前送检的血培养真阳性率(8.33%)低(P=0.015),见表5。主要感染菌中(检出≥20株)大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌抗微生物药物治疗前送检的血培养报阳时间明显短于抗微生物药物治疗后送检(P<0.05),见表6。
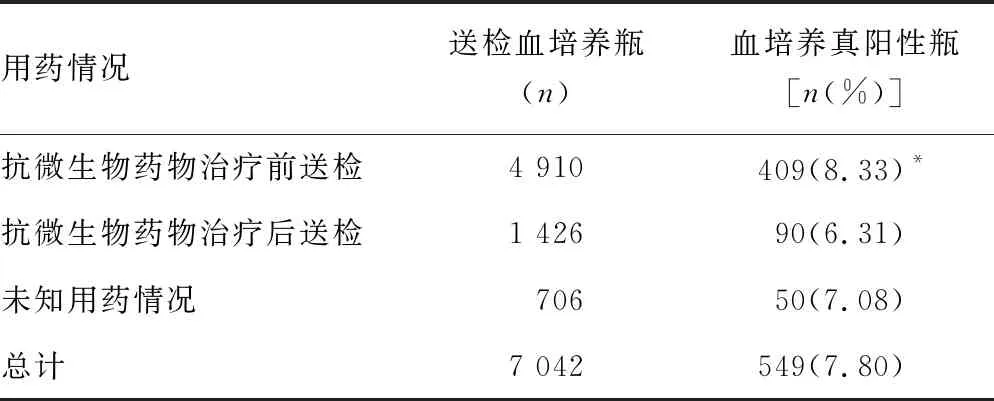
表5 送检时不同用药情况的血培养真阳性率比较

表6 送检时不同用药情况主要感染菌血培养报阳时间比较
2.5不同COVID-19情况血培养真阳性率 本研究在2022年底经历了COVID-19的暴发期,血培养送检数量明显增多,其中有1 336瓶血培养为急性呼吸综合征冠状病毒2(SARS-CoV-2)阳性患者。SARS-CoV-2阳性来源的血培养中,有41瓶(3.07%)检出致病菌,血培养真阳性率远低于SARS-CoV-2阴性来源的血培养(P<0.001),见表7。
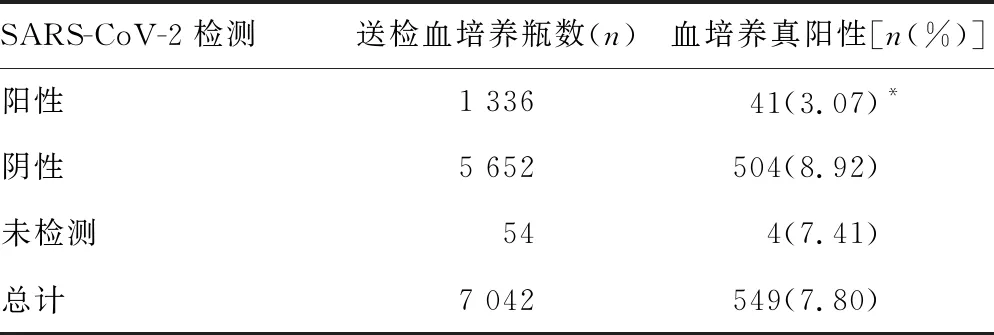
表7 不同COVID-19情况血培养真阳性率比较
3 讨 论
血流感染是指各类病原微生物及其毒素经各种途径进入血循环导致的系统性炎症反应综合征[6]。尽管医学领域研究已取得了巨大的进步,但血液感染仍然是一个日益严重的全球公共卫生问题,因其高发病率和病死率备受关注。血培养是最常见的微生物检验技术之一,目前仍是诊断血流感染的金标准[3]。本研究通过回顾重庆医药高等专科学校附属第一医院2021年1月至2023年1月血培养报阳标本检出微生物种类、报阳时间、感染与污染、送检前用药情况、COVID-19情况等特征,探讨血培养报阳相关特征在血流感染诊断中的应用价值,为临床正确分析、使用血培养结果、合理使用抗菌药物、减少耐药菌产生提供理论依据。
近年来,高效、优化的血培养检测系统能帮助临床医生实现血培养报阳后24 h内对患者进行精准的抗菌治疗[7-8]。现实验室多通过对病原菌产生二氧化碳的检测实现对血培养瓶病原菌生长的连续监测[9]。此外,血培养瓶内含有供需氧菌或厌氧菌生长的营养因子[10],检测灵敏度为1~15 CFU/mL[11]。但由于采样部位皮肤消毒不彻底或采血技术不当等原因,可能将环境中存在的微生物和皮肤正常菌群如凝固酶阴性葡萄球菌、微球菌、痤疮丙酸杆菌、芽孢杆菌和棒状杆菌等引入血培养瓶[12],引起高达30%的血培养污染率,导致不必要的抗菌药物治疗和增加患者负担[13]。研究发现血培养污染率与血容量呈负相关,可能小样本量增加了污染菌浓度[14]。近年来相继颁布了实验室血培养操作相关行业标准、专家共识和血培养技术用于诊断的实践指南[15-16],旨在规范血培养标本的采集和血培养结果分析,进一步减少血培养污染及其产生的不良影响。通常血培养污染程度可通过总体血培养污染率或阳性血培养中污染菌百分比来评估[17]。本研究血培养阳性检出的病原菌中有109株(15.77%)最终被确定为污染菌,主要为凝固酶阴性葡萄球菌、耳炎苏黎世菌和杰氏棒状杆菌,均为皮肤正常菌群,且检出的革兰阴性菌污染率远低于革兰阳性菌。真菌、β-溶血链球菌和除大肠埃希菌、肺炎克雷伯菌外的肠杆菌科均未出现污染情况。总体血培养污染率和阳性血培养中污染菌百分比分别为1.55%和15.77%,高于国家卫生健康委员会临床检验中心发布的三级医院平均水平。对本研究污染菌的科室来源和菌种分布分析发现,检出的污染菌以重症医学科来源的凝固酶阴性葡萄球菌最为突出,沟通后发现因该科室护士流动性大,培训不及时导致采血过程消毒不彻底,体表细菌随着针刺被带入到血培养瓶中,对检测结果造成影响。以上结果提示,重庆医药高等专科学校附属第一医院血培养标本采集还需进一步规范,另外,实验室应定期公布血培养污染情况,以辅助临床医师判断其作为感染菌的可能性。
血培养报阳时间是指血培养瓶从上机起至仪器发出阳性报警的时间。基于血培养检测技术原理,报阳时间与血液中的微生物含量呈反比,即菌量越多报阳时间越短[18]。报阳时间还受多种因素的影响,如培养瓶中的血容量、从血培养采集到上机的时间、血培养系统、特殊微生物及抗微生物药物使用等[3]。近年来报阳时间的潜在应用价值越来越受到重视。SIMÉON等[19]研究显示报阳时间是金黄色葡萄球菌所致菌血症患者死亡的独立预测因子。此外,有研究已证实污染菌在血液中的浓度远低于感染菌,因此报阳时间较长,提示报阳时间在区分感染菌与污染菌中有一定价值[20]。本研究发现,除铜绿假单胞菌、脆弱拟杆菌、肺炎链球菌和真菌报阳时间集中在20 h以上外,其余病原菌报阳时间均在9~20 h。其中大肠埃希菌和凝固酶阴性葡萄球菌血培养报阳时间还可作为判断其是感染还是污染的诊断指标,具有较好的诊断效能。而本研究数据显示污染菌报阳时间均>25 h。当然使用报阳时间区分感染、污染时,还应结合微生物本身病原学和生长特征进行综合分析。尽管如此,血培养阳性检出的微生物主要为大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌而非常见的污染菌,提示血培养诊断血流感染仍具有较高的特异度。
血培养相关行业标准和专家共识中均给出用药前采样的建议,也是保证血培养质量的重要措施。虽然上述建议可能延迟抗菌治疗时间,有研究显示在经验性治疗后采样送检血培养,与接受治疗前送检相比可降低约50%的阳性率,且不能通过增加采样部位和送检数量弥补[21]。本研究结果发现治疗后送检血培养的真阳性率显著低于治疗前送检,且主要检出的致病菌如大肠埃希菌、肺炎克雷伯菌和金黄色葡萄球菌治疗后送检血培养报阳时间较治疗前送检明显增加。此外,因为血流感染时体内病原微生物在血液循环中具有一过性、间歇性等特点,血培养技术客观上诊断血流感染的灵敏度无法达到100%,结合本研究结果,建议有血流感染表现的患者需在无菌技术下尽快采样送检血培养,然后再进行抗微生物药物治疗,此方案可减少治疗延误时间,同时可最大可能获得微生物结果用于指导后续治疗。
2022年底 COVID-19迅速传播,发热患者激增,导致医院资源紧张,同时实验室接受血培养的数量也急剧增加。已有较多研究显示患有严重COVID-19的患者多合并细菌感染,但这些患者中菌血症发生率尚不清楚。与SEPULVEDA等[22]相关研究结果一致,本研究发现合SARS-CoV-2阳性患者血培养真阳性率远低于SARS-CoV-2阴性患者。这可能是由于该人群真性菌血症发病率低,且存在过量使用抗菌药物的情况。LEUNG等[23]已证实SARS冠状病毒、流感病毒、呼吸道合胞病毒等严重呼吸道病毒感染且具有合并细菌感染风险的患者也存在较低的细菌血流感染发生率。上述结果表明,SARS-CoV-2阳性患者的血流感染发病率较低,在没有确凿证据表明合并细菌感染的情况下,经验性抗菌药物治疗的益处也未经证实。
综上所述,本研究通过回顾重庆医药高等专科学校附属第一医院2021年1月至2023年1月血培养报阳标本相关资料发现,血流感染病原菌多数为需氧瓶和厌氧瓶同时报阳,检出菌中约80%最终判断为病原菌,且阳性报警时间可作为鉴别分离菌污染与感染的重要指标。同时也提示临床正确采样方法和采样时机对减少血培养污染率和提高阳性率的重要性。但本研究存在一定的局限性,纳入的影响血培养阳性的因素有限,后期仍需开展多因素、大规模的研究验证。