Rab35、TRIM8在子宫内膜癌中的表达及其与患者临床病理特征和预后的关系*
李 丹,左学骞△,赵海波,孙洪芳,徐志钦,桑银洲
河北省沧州市人民医院:1.妇科;2.病理科,河北沧州 061000
子宫内膜癌(EC)是一种发生于子宫内膜上皮的恶性肿瘤,其发病与年龄增加、代谢综合征和遗传等有关。早期EC患者可通过手术、放化疗等综合治疗获得较长的生存时间,而晚期患者往往丧失手术时机,预后较差[1-2]。检测生物标志物可识别、预测疾病复发进展和死亡风险,为临床治疗提供新的靶点。Rab35是一种小鸟苷三磷酸酶(GTPase),参与膜运输、细胞极性、脂质稳态、免疫、吞噬和细胞分裂等多种细胞过程[3]。研究表明Rab35在肿瘤细胞的膜转运、信号转导、细胞分裂增殖、侵袭、转移和免疫逃避中发挥关键作用[4]。有研究报道,Rab35蛋白在EC的发展及浸润转移中起到促进作用[5]。三结构域蛋白8(TRIM8)是三结构域(TRIM)蛋白家族的成员之一,在细胞内运输、细胞增殖、细胞周期调控和肿瘤发生等方面发挥作用[6-7]。目前已有研究证实TRIM8在乳腺癌组织中的表达低于正常组织,TRIM8低表达与乳腺癌预后较差相关[8],且TRIM8在EC癌组织中表达失调,并参与了EC的发生、发展[9]。本研究检测EC癌组织中Rab35、TRIM8的表达,分析其与EC患者临床病理特征以及预后的关系,现报道如下。
1 资料与方法
1.1一般资料 选择2017年1月至2020年1月本院收治的180例EC患者为研究对象。纳入标准:(1)术后病理确诊为EC;(2)术前未接受任何形式的抗肿瘤治疗;(3)EC癌组织和癌旁正常子宫内膜组织均经病理学证实,癌旁组织无肿瘤细胞侵犯;(4)年龄18岁以上。排除标准:(1)合并其他恶性肿瘤或其他器官转移癌;(2)合并严重心、脑血管疾病;(3)合并自身免疫性疾病;(4)临床资料不完整;(5)失访。180例EC患者中年龄≥65岁124例,<65岁56例;病理类型:腺癌148例,其他32例;FIGO分期:Ⅰ~Ⅱ期106例,ⅢA期74例;分化程度:低分化113例,中高分化67例;肌层浸润深度:<1/2有74例,≥1/2有106例;有淋巴结转移63例。本研究经本院医学伦理委员会审核批准(K2016-694),所有患者或其家属均签署知情同意书。
1.2方法
1.2.1免疫组化法检测Rab35、TRIM8表达 取手术切除的癌组织以及癌旁子宫内膜组织(距离癌组织5 cm以上),10%中性福尔马林溶液(pH 7.2~7.4)固定组织,梯度乙醇脱水,二甲苯透明,石蜡包埋,制作4 μm切片。取石蜡切片,微波加热,3%过氧化氢水溶液处理石蜡切片15 min,去除内源性酶活性和氧化还原剂活性,高温修复抗原。加入兔抗人Rab35 单克隆抗体(1∶100稀释,台湾亚诺法生技股份有限公司)、兔抗人TRIM8单克隆抗体(1∶100稀释,上海西宝生物科技股份有限公司),4 ℃孵育过夜。次日滴加二抗,3,3-二氨基联苯胺四盐酸盐(DAB)显色,苏木素细胞核复染,脱水,中性树胶封片镜下观察。以PBS代替一抗为阴性对照组。读片由本院病理科2名经验丰富的医师完成,结合阳性细胞百分比(0分为≤5%,1分为>5%~25%,2分为>25%~50%,3分为>50%~75%,4分为>75%~100%)和染色强度(无染色0分,淡黄色1分,棕黄色2分,棕褐色3分)评价Rab35、TRIM8表达,2个评分相乘积分0~7分为表达阴性,8~12分为表达阳性。
1.2.2随访 Ⅰ期EC患者接受腹腔镜下筋膜外全子宫双侧附件切除术,Ⅱ期、Ⅲ期EC患者接受子宫广泛切除加盆腔淋巴结清扫以及双侧附件切除术,Ⅱ期、Ⅲ期EC患者术后接受辅助放化疗。术后定期门诊复查和电话随访,共随访3年,随访截止至2023年1月。统计随访期间患者总生存情况,总生存时间定义为确诊至死亡或随访截止时间。
1.3统计学处理 采用SPSS25.0软件进行数据分析。计数资料以例数、百分率表示,组间比较采用χ2检验。采用多因素Logistic回归分析影响EC患者预后的因素;采用Kaplan-Meier生存曲线分析EC患者生存情况,比较采用Log-Rankχ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1EC癌组织和癌旁组织中Rab35、TRIM8表达比较 EC癌组织Rab35表达阳性率高于癌旁组织(P<0.05),TRIM8表达阳性率低于癌旁组织(P<0.05),见表1。

表1 EC癌组织和癌旁组织中Rab35、TRIM8表达比较[n(%)]
2.2不同临床病理特征EC组织中Rab35、TRIM8表达比较 FIGO分期ⅢA期、低分化、肌层浸润深度≥1/2、有淋巴结转移的EC患者癌组织Rab35表达阳性率高于FIGO分期Ⅰ~Ⅱ期、中高分化、肌层浸润深度<1/2、无淋巴结转移的EC患者(P<0.05);FIGO分期ⅢA期、低分化、肌层浸润深度≥1/2、有淋巴结转移的EC患者癌组织TRIM8表达阳性率低于FIGO分期Ⅰ~Ⅱ期、中高分化、肌层浸润深度<1/2、无淋巴结转移的EC患者(P<0.05);不同年龄、病理类型EC患者癌组织的Rab35、TRIM8表达阳性率比较,差异无统计学意义(P>0.05)。见表2。
2.3不同预后的EC患者临床资料比较 所有患者均进行了3年随访,随访期间死亡58例,存活122例,总生存率67.78%。结果显示死亡组FIGO分期ⅢA期、低分化、肌层浸润深度≥1/2、有淋巴结转移、Rab35表达阳性、TRIM8表达阴性的比例高于存活组(P<0.05),见表3。
表3 不同预后EC患者临床资料比较[n(%)]
2.4多因素Logistic回归分析影响EC患者预后的因素 以EC患者预后(存活=0,死亡=1)为因变量,以FIGO分期、分化程度、肌层浸润深度、淋巴结转移、Rab35、TRIM8为自变量(赋值见表4),进行多因素Logistic回归分析,回归采用逐步后退法(α进=0.05,α出=0.10)。结果显示:FIGO分期ⅢA期、有淋巴结转移、Rab35表达阳性是EC患者死亡的危险因素(P<0.05),TRIM8表达阳性是EC患者死亡的保护因素(P<0.05)。参见表4。
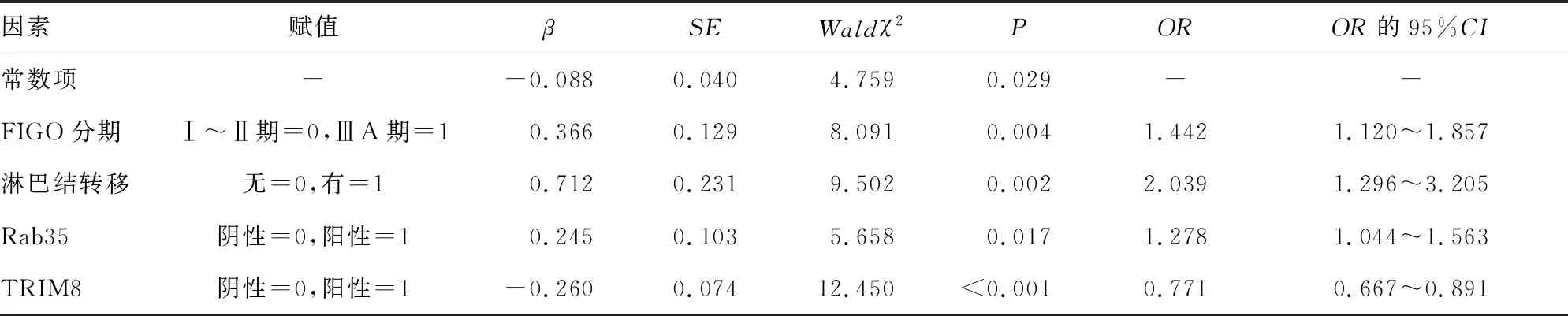
表4 影响HSCC患者预后的多因素Logistic回归分析
2.5不同Rab35、TRIM8表达EC患者生存分析 Rab35表达阳性EC患者累积生存率低于Rab35表达阴性患者(Log-Rankχ2=11.523,P<0.001);TRIM8表达阳性EC患者累积生存率高于TRIM8表达阴性EC患者(Log-Rankχ2=9.683,P<0.001)。见图1。
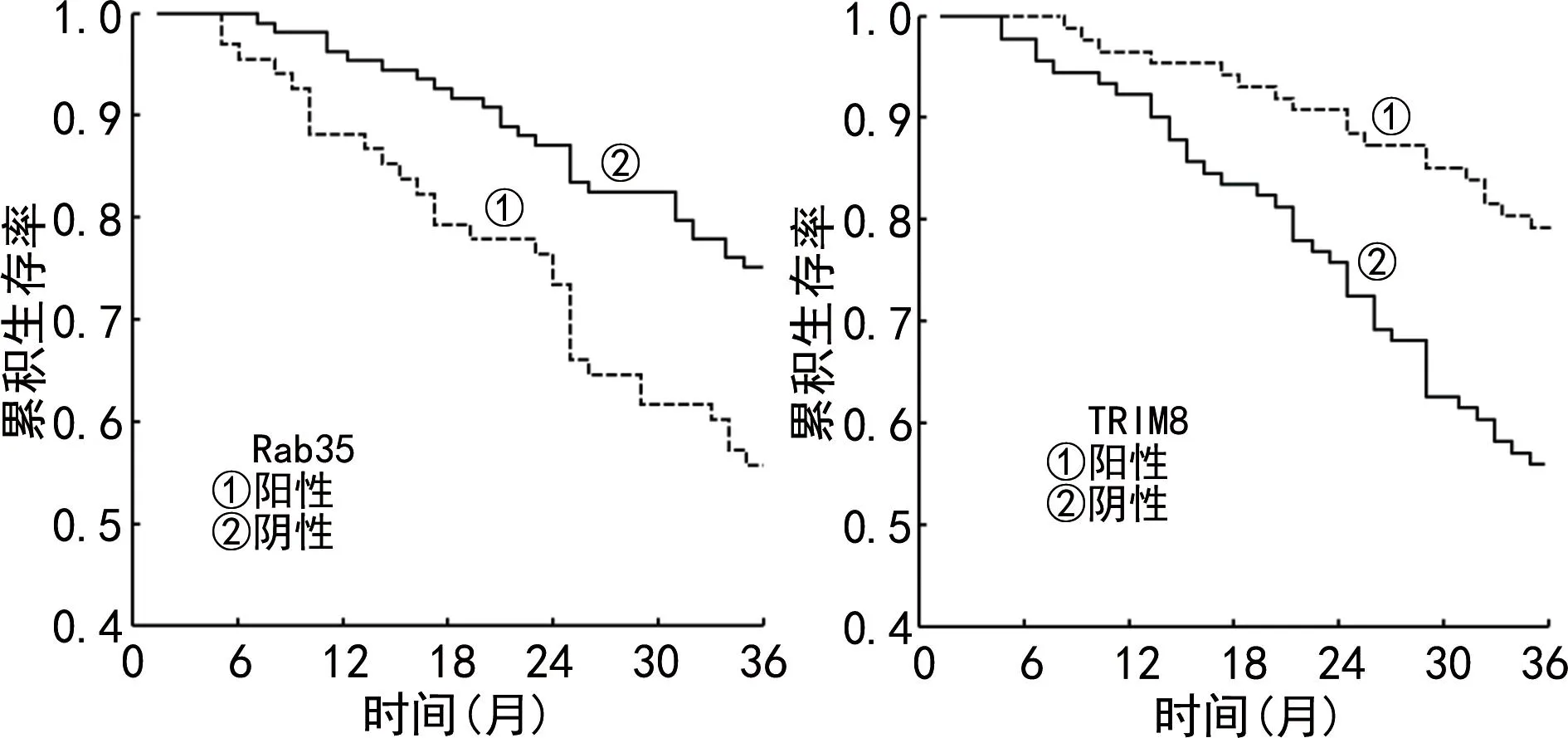
图1 不同Rab35、TRIM8表达EC患者Kaplan-Meier生存曲线
3 讨 论
EC是严重威胁女性健康的上皮组织恶性肿瘤之一,尽管手术、辅助放疗和化疗提高了早期EC患者的总生存率,但晚期转移患者预后较差。近年来发现生物标志物与EC的发生、发展和预后相关,在EC诊断和预后预测中具有一定价值[9-10]。
细胞依靠细胞膜运输来维持细胞结构、细胞形状和细胞极性,以及器官的结构和功能[11-12]。癌细胞可改变膜运输,促进上皮-间质转化和侵袭性表型,导致包括EC在内的癌症进展[13]。Rab蛋白是进化上保守的GTP结合蛋白,在所有真核细胞中调节细胞膜内运输,控制在癌症中过度表达的血小板衍生生长因子受体(PDGFR)、血管内皮生长因子受体(VEGFR)和整合素等生长因子受体的内吞运输和再循环,增加癌细胞增殖的潜力[14-15]。Rab35属于Rab蛋白家族成员,是一种致癌性GTPase,参与细胞膜内运输、细胞动力学,在恶性肿瘤中Rab35致癌体细胞突变,通过磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)依赖机制调节PDGFR运输导致细胞转化[3],在癌症侵袭、转移和免疫逃避中发挥作用[16]。既往研究显示Rab35在胃癌组织中激活和募集,并促进胃癌细胞的迁移和侵袭[17];Rab35在EC癌组织和细胞系中表达失调,与EC病情进展有关[5]。本研究发现EC癌组织中Rab35表达阳性率高于癌旁组织,Rab35表达阳性与EC低分化、FIGO分期ⅢA期、肌层浸润深度、淋巴结转移有关,是EC患者死亡的危险因素,提示Rab35可能在EC发病过程中发挥致癌基因作用。Rab35参与EC的机制尚不明确,研究显示PI3K/Akt信号通路激活促使细胞周期由S期向G2期转化,导致EC细胞增殖[18-19],Rab35蛋白可消除抑制Akt磷酸化和PI3K信号通路的活性蛋白,能激活PI3K/Akt信号通路诱导正常细胞发生癌变,并促使癌细胞增殖、侵袭和迁移[3]。因此推测Rab35可能通过调控PI3K/Akt信号通路参与EC的发生和发展。
TRIM8基因位于10q24.3染色体上,参与胚胎发育、细胞分化、炎症、先天免疫等调控,与自身免疫性疾病、心血管疾病、恶性肿瘤等有关[20]。TRIM8在多种恶性肿瘤中表达下调,其表达缺失与癌症进展有关,比如,TRIM8在乳腺癌中下调,与雌激素受体α水平呈负相关,TRIM8表达缺失显著增强乳腺癌细胞的增殖和迁移[21]。TRIM8在肾透明细胞癌和结直肠癌中表达下调,上调TRIM8可恢复p53肿瘤抑制作用,导致癌细胞增殖减少或阻滞[22]。恢复TRIM8表达可显著降低胶质母细胞瘤细胞的克隆潜能,TRIM8的转录抑制与胶质瘤患者的不良预后有关[23]。既往研究发现TRIM8表达与EC患者预后相关[9]。本研究也发现EC癌组织中TRIM8表达阳性率显著低于癌旁组织,TRIM8表达阳性率与EC恶性临床病理特征以及生存率有关,TRIM8可能在EC中发挥抑癌基因作用。p53信号通路激活可抑制EC上皮-间质转化,癌细胞侵袭和迁移[24]。p53突变在EC中发挥致癌基因作用,与EC晚FIGO病理分期、肌层浸润深度、淋巴结转移有关[25]。TRIM8作为一种p53调节剂,可稳定p53,通过钝化N-MYC活性恢复p53肿瘤抑制功能,促使癌细胞凋亡[22],TRIM8表达上调可能增强p53活性,诱导癌细胞凋亡[26]。因此推测TRIM8表达阳性可能增强p53肿瘤抑制作用,抑制EC进展,改善患者预后。
综上所述,EC组织中Rab35表达阳性率上调,TRIM8表达阳性率下调,Rab35表达阳性率增加、TRIM8表达阳性率降低与EC低分化、FIGO分期ⅢA期、肌层浸润深度、淋巴结转移以及低生存率有关。Rab35、TRIM8有望成为EC的潜在标志物和治疗靶点,对EC预后分析有着积极的意义。