阿法替尼治疗肺腺癌致EGFR T790M/C797S突变1例并文献复习
郭曼 曹玉风 王苏
[收稿日期]2023-08-08; [修订日期]2023-11-20
[基金项目]山东省医药卫生科技发展计划项目(20210310-0097)
[第一作者]郭曼(1989-),女,硕士,主治医师。
[通信作者]王苏(1986-),女,博士,主治医师。E-mail:wangsu.1986@163.om。
[摘要] 目的
探討阿法替尼获得性耐药的机制及治疗策略。
方法 报告1例经阿法替尼治疗后出现表皮生长因子受体(EGFR)T790M与C797S反式突变的晚期肺腺癌病人,结合相关的文献复习,总结其临床特点及诊治经验。
结果 本例晚期肺腺癌病人初诊时检出EGFR 19Del突变,一线阿法替尼靶向治疗后,在胸腔积液基因检测中发现了罕见的EGFR T790M/C797S反式突变。治疗方案调整为第一代酪氨酸激酶抑制剂(TKI)吉非替尼联合第三代TKI奥希替尼,病人获得了9个月的无事件生存期(EFS)和51个月的总生存期(OS)。
结论 阿法替尼治疗肺腺癌致EGFR T790M/C797S反式突变病例较为少见,C797S突变可能是其潜在的耐药机制。第一、三代TKI联合应用可有效治疗EGFR T790M/C797S反式突变的肺腺癌病人。
[关键词] 阿法替尼;肺腺癌;ErbB受体;突变;病例报告
[中图分类号] R734.2
[文献标志码] B
[文章编号] 2096-5532(2024)01-0144-04
doi:10.11712/jms.2096-5532.2024.60.012
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://link.cnki.net/urlid/37.1517.R.20240306.1552.004;2024-03-09 16:01:05
EGFR T790M/C797S mutation caused by afatinib in the treatment of lung adenocarcinoma: a case report and literature review
\ GUO Man, CAO Yufeng, WANG Su
\ (Department of Oncology, Qingdao Hiser Hospital Affiliated to Qingdao University (Qingdao Traditional Chinese Medicine Hospital), Qingdao 266011, China)
\; [Abstract]\ Objective\ To investigate the mechanism of acquired resistance to afatinib and related therapeutic strategy.
Methods\ This article reported the clinical data of a patient with advanced lung adenocarcinoma who had epidermal growth factor receptor (EGFR) T790M and C797S trans-mutations after treatment with afatinib, and a literature review was performed to summarize the clinical features and diagnosis and treatment experience of the disease.
\ Results\ In this case, the patient with advanced lung adenocarcinoma was found to have an EGFR 19Del mutation at initial diagnosis, and after the first-line targeted therapy with afatinib, the patient was found to have rare EGFR T790M and C797S trans-mutations in the genetic testing of pleural effusion. The treatment regimen was adjusted to the first-generation tyrosine kinase inhibitor (TKI) gefitinib combined with the third-generation TKI osimertinib, and the patient achieved 9 months of event-free survival and 51 months of overall survival.
\ Conclusion\ EGFR T790M/C797S trans-mutations caused by afatinib are rare in the treatment of lung adenocarcinoma, and C797S mutation may be a potential resistance mechanism of afatinib. First-generation TKIs combined with third-generation TKIs are effective in the treatment of lung adenocarcinoma patients with EGFR T790M/C797S trans-mutations.
[Key words]\ afatinib; adenocarcinoma of lung; ErbB eceptors; mutation; case reports
在肺癌病人中,表皮生长因子受体(EGFR)突变主要发生于晚期非小细胞肺癌(NSCLC)病人,尤其是肺腺癌病人[1]。酪氨酸激酶抑制剂(TKI)的治疗显著提高了这些病人的生存率和生活质量。目前,TKI主要有三代,第一代埃克替尼、厄洛替尼和吉非替尼,第二代达克替尼和阿法替尼,第三代伏美替尼、阿美替尼和奥希替尼[2]。TKI治疗后耐药的发生不可避免。研究表明,第一代和第二代TKI的主要耐药机制是继发性T790M突变[3]。第三代TKI最常见的耐药机制是C797S突变[4]。目前,国内尚无晚期肺腺癌病人服用阿法替尼后出现C797S突变的报道。研究显示,如果EGFR T790M和C797发生反式突变,联合应用第一代和第三代TKI可以达到良好的临床疗效[5-6]。本文报告1例EGFR 19Del突变的晚期肺腺癌病人在接受阿法替尼治疗后出现EGFR T790M和C797S反式突变,随后接受吉非替尼联合奥希替尼治疗,病人最终获得9个月的无事件生存期(EFS)。
1 病例报告
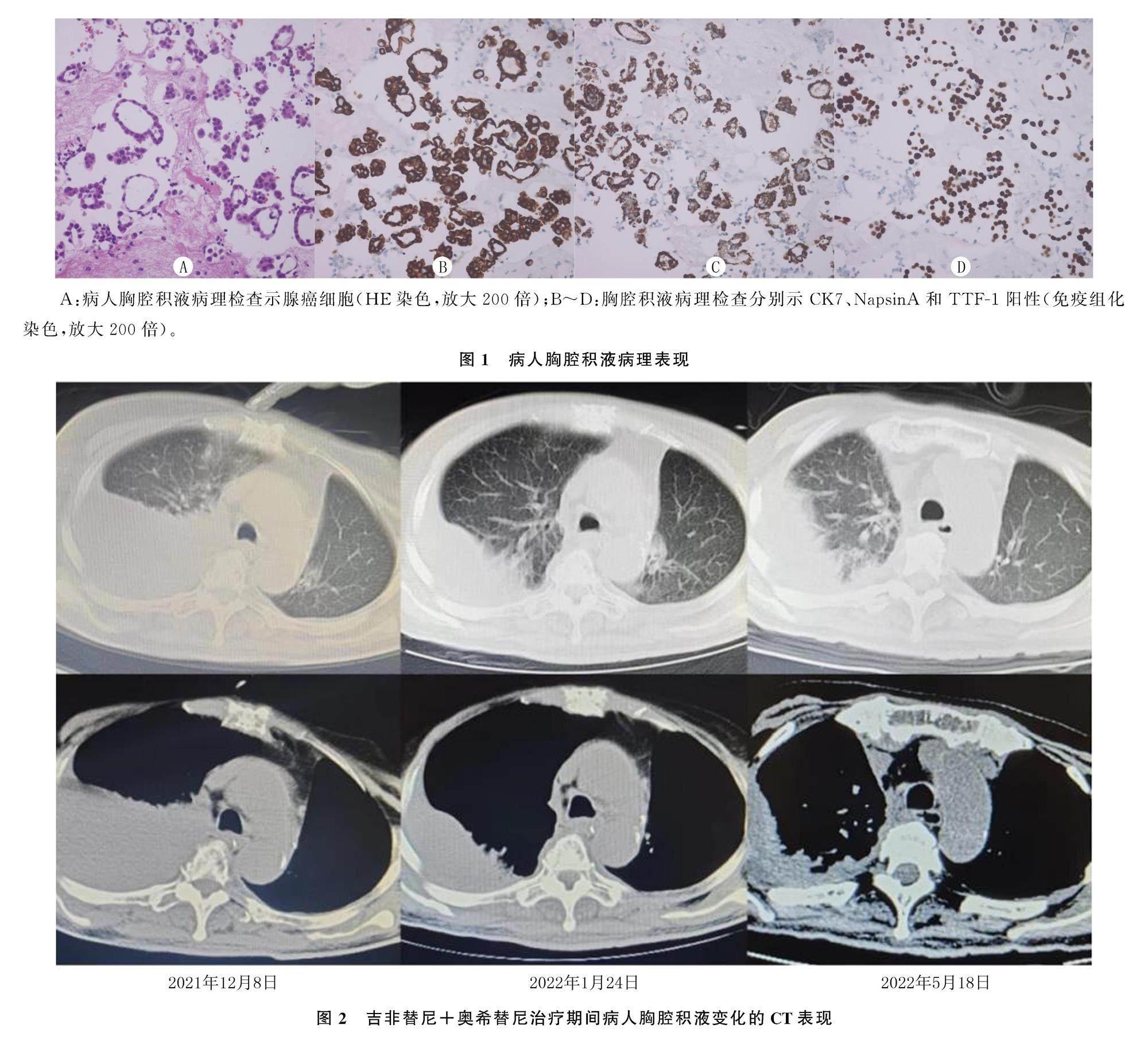
病人,女,70岁。2017年11月体检时发现左肺上叶有一磨玻璃-实质性混杂密度灶。6个月后磨玻璃样影增大,病情加重。于2018年6月13日行“左肺上叶切除+纵隔、肺门淋巴结清扫术+胸腔粘连松解术”,术后病理诊断为(左肺上叶)中央型乳头状浸润性腺癌,肿瘤最大切面为1.8 cm×1.3 cm,肿瘤周围可见大量肺泡内播散灶,可见小淋巴管内癌栓,弹力纤维染色显示静脉侵犯,未见神经及神经周围侵犯。免疫组化检查:细胞角蛋白7(CK7)(+),表皮生长因子受体(EGFR)(+)(建议基因检测),新天冬氨酸蛋白酶A(NapsinA)(+),甲状腺转录因子1(TTF-1)(+),上皮细胞膜抗原(EMA)微乳头腔缘强阳性,光谱细胞角蛋白(CKpan)(+),CK5/6(-),Ki-67(+),间变性淋巴瘤激酶(ALK)(-);CD31、D2-40染色示脉管浸润,S-100染色未显示神经及神经周围浸润。第10组淋巴结(1/2)有腺癌转移,纤维组织内见腺癌浸润伴肿瘤大块坏死;第12组淋巴结纤维组织内查见腺癌转移;第6、7、9、11组无淋巴结转移。术后分期为pT1bN1M0 ⅡB期。2018年6月19日—9月20日行4周期PP方案(培美曲塞800 mg,第1天;顺铂60 mg,第1~2天)全身化疗,后定期复查。因“胸背部疼痛”于2020年2月19日就诊我科,同日行全身骨扫描显示全身多发胸腰椎转移。6 d后开始行胸腰椎姑息性放疗,剂量为30 Gy/3 Gy/10 f,并予唑来磷酸抗骨转移治疗。2020年2月28日行基因检测示EGFR 19Del突变,开始口服阿法替尼(40 mg,每日1次)靶向治疗。后定期复查,疗效稳定(SD)。2021年12月8日病人出现胸闷、憋气,胸部CT示左侧胸膜增厚、右侧胸腔积液、少量心包积液。考虑胸闷、憋气为胸腔积液所致,病情进展(PD)。次日行胸腔穿刺置管引流术,胸腔积液中发现腺癌细胞。结合苏木精-伊红(HE)染色及免疫组化检查(图1),最终诊断为肺腺癌。免疫组化检查:TTF1(+),CK7(+),CK(+),Wilms肿瘤易感基因(WT1)(-),NapsinA(+),CK5/6(-),Ki-67阳性率约30%。行胸腔积液基因检测示EGFR 19Del突变、T790M/C797S反式突变。病人于2021年12月25日开始口服吉非替尼(0.25 g,每日1次)和奥希替尼(80 mg,每日1次)靶向治療。后定期复查,胸腔积液未再进展,无新发病灶,疗效稳定(图2)。在后续随访中,病人于2022年9月21日因意外去世。该病人术后化疗后无病生存期(DFS)为20个月,进展后一线应用阿法替尼无进展生存期(PFS)为22个月,二线应用吉非替尼+奥希替尼EFS为9个月,总生存期(OS)为51个月。
2 讨 论
EGFR-TKI靶向治疗是EGFR阳性晚期NSCLC病人的标准一线治疗方案[7-8]。不同的EGFR突变类型需要使用不同的靶向药物治疗。在我国,EGFR 19Del(19号外显子缺失)是肺腺癌病人最常见的突变,阿法替尼是19Del病人的一线治疗药物之一[9-10]。与化疗相比,阿法替尼能明显延长19Del病人的OS[11];与第一代TKI吉非替尼相比,阿法替尼能明显改善晚期EGFR突变型病人的PFS[12]。研究显示,接受阿法替尼一线治疗晚期EGFR突变NSCLC亚裔病人的PFS和OS均优于接受第一代TKI治疗者[13]。基于此,本文病人在出现EGFR 19Del突变后接受了阿法替尼的治疗。
EGFR-TKI治疗可以显著提高晚期肺腺癌病人的生存率和生活质量,但TKI获得性耐药仍是临床治疗的一大难题。EGFR-TKI耐药类型包括原发性耐药和获得性耐药,耐药机制分为EGFR依赖性耐药、非EGFR依赖性耐药和组织学或表型转化,而部分病人的耐药机制尚未明确[14-16]。其中,EGFR依赖性耐药是获得性耐药最常见的原因。第一代和第二代EGFR-TKI药物治疗后最常见的继发突变位点是EGFR T790M突变,高达50%~60%的晚期EGFR基因阳性NSCLC病人在一线治疗后会发生T790M突变[17-18],即EGFR第20号外显子790位点上甲硫氨酸取代了苏氨酸。第三代TKI药物治疗后继发突变最常见的位点是EGFR C797S突变[19-21],即丝氨酸取代EGFR 20号外显子797位点上的半胱氨酸。T790M和C797S突变在结构上又可以分为顺式突变和反式突变,若两突变位于同一条DNA链上则为顺式突变,位于不同的DNA链上则为反式突变。顺式突变率远高于反式突变率[22]。C797S通常为NSCLC病人在第三代TKI治疗后的继发耐药突变。在本病例中,病人仅服用第二代TKI药物出现耐药后即可同步检测到C797S和T790M的反式共突变。这提示C797S突变也可能是二代EGFR-TKI耐药的机制。
阿法替尼获得性耐药机制迄今为止尚没有完全阐明。KOBAYASHI等[23]的体外实验显示,携带19Del突变的肺癌细胞经阿法替尼处理后倾向于获得特异性的T790M突变,携带L858R、G719A和del18突变的细胞经过阿法替尼处理后发生了T790M突变。但因该实验为体外研究,而且样本量少,并不能完全反映临床实际情况。NAKAMURA等[24]的回顾性研究显示,在阿法替尼治疗前,20例病人中有15例T790M阴性,5例阳性,15例T790M阴性的病人中有6例(40.0%)经阿法替尼治疗后转为阳性;在阿法替尼治疗前无病人检测到C797S突变,但有3例病人在治疗后出现C797S突变。提示T790M突变与阿法替尼的获得性耐药有关,C797S突变对阿法替尼的抗性影响小于T790M突变。
但该研究并未提示此3例获得C797S突变的病人在阿法替
尼治疗前的EGFR突变类型,也未提示T790M与C797S为
顺式突变还是反式突变。大多数相关研究提示,C797S是第三代TKI奥希替尼的主要耐药突变。在本病例中,阿法替尼治疗后也出现了C797S突变,考虑到奥希替尼和阿法替尼的分子结构有类似之处,这可能是阿法替尼治疗后出现C797S突变的原因。本研究在胸腔积液中检测到阿法替尼耐药后发生的T790M和C797S突变,为罕见的反式突变,为国内首次报道。
目前,针对EGFR T790M和C797S顺式突变或者反式突变的靶向治疗尚无公认的方法,许多探索性方案尚处于临床研究或病例报道阶段。NIEDERST等[25]和CHABON等[26]的研究提示,C797S与T790M如为反式突变,可采用第一代TKI+第三代TKI治疗。WANG等[27]也证实了第一代TKI联合第三代TKI可以有效治疗T790M/C797S反式突变的肺腺癌病人,其研究提示C797S从反式到顺式的克隆进展可能是疾病进展过程中的另一种潜在耐药机制。
综上所述,本文病人在一线应用阿法替尼耐药后出现恶性胸腔积液,胸腔积液基因检测发现罕见的EGFR 19Del突变和T790M/C797S反式突变。我们为该病例选择了第一代TKI吉非替尼联合第三代TKI奥希替尼的治疗方案,病人二线治疗后达到了9个月的EFS,这为临床治疗提供了参考;同时,本研究提示EGFR C797S突变不仅是奥希替尼的耐药机制,也可能是阿法替尼的潜在耐药机制。
[参考文献]
[1]李锐,叶胜兵,时姗姗,等. 1 470例非小细胞肺癌EGFR基因突变与临床病理特征的关系[J].诊断病理学杂志, 2019,26(9):607-608.
[2]PAO W, CHMIELECKI J. Rational, biologically based treatment of EGFR-mutant non-small-cell lung cancer[J]. Nature Reviews Cancer, 2010,10(11):760-774.
[3]ATTILI I, KARACHALIOU N, CONTE P, et al. Therapeutic approaches for T790M mutation positive non-small-cell lung cancer[J]. Expert Review of Anticancer Therapy, 2018,18(10):1021-1030.
[4]LEONETTI A, SHARMA S, MINARI R, et al. Resistance mechanisms to osimertinib in EGFR-mutated non-small cell lung cancer[J]. British Journal of Cancer, 2019,121(9):725-737.
[5]ARULANANDA S, DO H, MUSAFER A, et al. Combination osimertinib and gefitinib in C797S and T790M EGFR-Mutated non-small cell lung cancer[J]. Journal of Thoracic Onco-
logy, 2017,12(11):1728-1732.
[6]王小艷,汪睿,姚圆圆,等. 奥希替尼联合厄洛替尼治疗EGFR-T790M与C797S反式突变的肺腺癌一例并文献复习[J]. 中国肿瘤生物治疗杂志, 2020,6(8):951-953.
[7]中华人民共和国国家卫生健康委员会. 原发性肺癌诊疗指南(2022年版)[J]. 中国合理用药探索, 2022,19(9):1-28.
[8]杨文洁,严福华. 2022年美国国立综合癌症网络(NCCN)《肺癌筛查临床实践指南》(第2版)解读[J]. 诊断学理论与实践, 2023,22(1):14-20.
[9]ETTINGER D S, WOOD D E, AISNER D L, et al. Non-
small cell lung cancer, version 3.2022, NCCN clinical practice guidelines in oncology[J]. Journal of the National Comprehensive Cancer Network, 2022,20(5):497-530.
[10]BANNO E, TOGASHI Y, KOBAYASHI Y, et al. Afatinib is especially effective against non-small cell lung cancer carrying an EGFR exon 19 deletion[J]. Anticancer Research, 2015,35(4):2005-2008.
[11]YANG J C H, WU Y L, SCHULER M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials[J]. The Lancet Oncology, 2015,16(2):141-151.
[12]PARK K, TAN E H, O'BYRNE K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial[J]. The Lancet Oncology, 2016,17(5):577-589.
[13]LU S, SHIH J Y, JANG T W, et al. Afatinib as first-line treatment in Asian patients with EGFR mutation-positive NSCLC: a narrative review of real-world evidence[J]. Advances in Therapy, 2021,38(5):2038-2053.
[14]李詠生,孙建国,李梦侠. 第三代EGFR-TKI耐药后诊疗策略专家共识[J]. 中华肺部疾病杂志(电子版), 2023,16(2):145-155.
[15]JOHNSON M, GARASSINO M C, MOK T, et al. Treatment strategies and outcomes for patients with EGFR-mutant non-small cell lung cancer resistant to EGFR tyrosine kinase inhibitors: focus on novel therapies[J]. Lung Cancer, 2022,170:41-51.
[16]SONG Z B, YU X M, ZHANG Y P. Mutation and prognostic analyses of PIK3CA in patients with completely resected lung adenocarcinoma[J]. Cancer Medicine, 2016,5(10):2694-2700.
[17]王晨,陈淑珍. 非小细胞肺癌治疗药物EGFR-TKIs获得性耐药机制的研究进展[J]. 药学学报, 2019,54(8):1364-1371.
[18]WU S G, LIU Y N, TSAI M F, et al. The mechanism of acquired resistance to irreversible EGFR tyrosine kinase inhibitor-afatinib in lung adenocarcinoma patients[J]. Oncotarget, 2016,7(11):12404-12413.
[19]MEHLMAN C, CADRANEL J, ROUSSEAU-BUSSAC G, et al. Resistance mechanisms to osimertinib in EGFR-mutated advanced non-small-cell lung cancer: a multicentric retrospective French study[J]. Lung Cancer, 2019,137:149-156.
[20]CHO B C, CHENG Y, ZHOU C, et al. Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase Ⅲ FLAURA study[J]. Annals of Oncology, 2018,29:ix177.
[21]THRESS K S, PAWELETZ C P, FELIP E, et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M[J]. Nature Medicine, 2015,21(6):560-562.
[22]PIOTROWSKA Z, NAGY R, FAIRCLOUGH S, et al. OA 09.01 characterizing the genomic landscape of EGFR C797S in lung cancer using ctDNA next-generation sequencing[J]. Journal of Thoracic Oncology, 2017,12(11):S1767.
[23]KOBAYASHI Y, AZUMA K, NAGAI H, et al. Characte-
rization of EGFR T790M, L792F, and C797S mutations as mechanisms of acquired resistance to afatinib in lung cancer[J]. Molecular cancer therapeutics, 2017,16(2):357-364.
[24]NAKAMURA T, NAKASHIMA C, KOMIYA K, et al. Mechanisms of acquired resistance to afatinib clarified with li-
quid biopsy[J]. PLoS One, 2018,13(12):e0209384.
[25]NIEDERST M J, HU H C, MULVEY H E, et al. The allelic context of the C797S mutation acquired upon treatment with third-generation EGFR inhibitors impacts sensitivity to subsequent treatment strategies[J]. Clinical Cancer Research, 2015,21(17):3924-3933.
[26]CHABON J J, SIMMONS A D, LOVEJOY A F, et al. Circulating tumour DNA profiling reveals heterogeneity of EGFR inhibitor resistance mechanisms in lung cancer patients[J]. Nature Communications, 2016,7:11815.
[27]WANG Z, YANG J J, HUANG J, et al. Lung adenocarcinoma harboring EGFR T790M and InTrans C797S responds to combination therapy of first- and third-generation EGFR TKIs and shifts allelic configuration at resistance[J]. Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer, 2017,12(11):1723-1727.
(本文編辑 牛兆山)

