探究式教学中实验“引导”的适切性刍议
汪 序
所谓探究式教学一定是以问题情景或认知冲突为起点的,“问题情景或认知冲突”在探究式学习中的重要性,主要体现在它对学生是否合适,故问题情景的创设应该由教师在备课时精心设计,同一个问题可以设置多个探究的角度,并且在教学实践中还需要根据实际情况不断地改进。在化学学科中,重要的环节之一就是实验,那么通过实验的“现象观察”、“现象解释”和“引导得出结论”是探究性实验教学的关键之处。
一、探究式教学中实验的作用
探究式教学的模式有很多种,如“实验引入、原理分析、理论指导、实验验证、知识运用”或“假设→实验→探究→结论”等模式。由此可见实验在其中的重要性是不容质疑的。学生不仅要在教师的引导下观察实验现象、进行实验操作,还要通过现象发现问题,并能挖掘出本质的内容,进而解决问题;学生不仅要在教师的指导下完成实验,还要培养自己能设计有关的实验方案;学生不仅要在教师的引导下学会处理信息,还要培养自己获取新知识的能力、分析和解决问题的能力。
在几年的教学中,体会到原来许多验证性的实验都能用探究的方式进行。大多数探究的过程需要实验来支持,也就是说,实验是研究问题的主要手段。化学实验产生出可以探究的问题,又能提供给学生感性材料,而实验不一定难做或复杂,关键是教师如何运用、引导和重组,同时也需要教师和学生共同进行实验创新(包括方案、原理和装置),并引导学生对观察到的现象进行本质分析和探究,从而完成对某个知识的认知,或对某个概念的建立,这是学生探究过程也是学习过程,从感性到理性的上升过程。
二、探究式教学过程中“引导”的程度
探究活动肯定需要教师的引导,这是毫无疑问的,但问题是需要教师什么样的引导,怎样把握“引导”的程度呢?
1.要把握“引导”的度,就应先理解“引导”。引导不是告诉,应是提示。如果把答案告诉他们,就不能发挥探究的功能,就失去了探究的意义和价值。同时引导也不应是“控”,而应是“放”。教师要处理好“控”与“放”的关系,该控的时候,要控制好;该放的时候,要放充分。在化学教学中如何体现“放控”?凡是学生经过讨论或实验、调查能够弄清楚的地方,就要放;凡是放开后学生无法探究(超出了学生的可接受能力)的地方,就要控。
2.要把握好“引导”的度,就应做好充分备课,把握课堂教学时间。在课堂教学时间有限的情况下,哪些教学内容让学生自己探究,哪些内容要教师给出相关信息或启发讲授,哪些内容教师直接讲授,这个问题需要教师课前仔细斟酌。特别是对于学生已有的经验基础,或学生已经达成的共识,不要再占用时间进行专门的探究活动。对一些学生自己探究起来非常困难,又不是关键或重要的教学内容,不要在上面花费较多的时间。
3.要把握好“引导”的度,就应抓住最佳教学时机。在探究式教学的实验讨论过程中,教师要融入探究活动中,及时给予必要的帮助和辅导。当学生的认识出现迷惑不解时,教师要及时掌握他们哪里有认识的障碍,纠正学生的错误认识,给学生正确的指导。必要的时候,教师还可以让学生暂停探究,对存在的较为普遍的问题进行及时评价反馈,这是教师探查学生情况的良好时机。一旦错过良机,不但不能取得好的教学效果,而且往往会扰乱学生的思路,导致教师牵着学生鼻子走的局面,使学生陷入被动接受的境地。
4.要把握好“引导”的度,就应多创设适宜的教学情景。引发学生思考,要给学生为自己的想法或假设寻找证据的机会,进行同伴间的交流活动,尤其是要给学生机会阐释自己的见解和为自己的观点进行辩护。
5.要把握好“引导”的度,就应帮助学生抓住探式教学过程中的重难点。在探究式教学过程中往往会出现学生不会记笔记或难于下笔的情形,这主要是由于探究式教学知识点比较分散,重难点知识难以集中体现。因此,要求教师在教学时更要及时地对知识进行梳理,同时培养学生抓住重难点的能力。
三、探究式教学中的实验案例
案例1:钠与水的反应
[引言]同学们,请你们推测一下,金属钠可能具有怎样的化学性质?你的依据是什么?
[学生讨论]可能性质较活泼,具有较强的还原性。因为根据钠原子的结构,极易失去最外层的一个电子,故作此推测。
[教师活动]事实果真如此吗?现将金属钠投入水中,并引导学生从三个方面思考:①观察并描述现象;②推测产生这些现象的原因可能是什么?③可以体现金属钠的哪些物理性质和化学性质。
[实验现象]①金属钠浮在水面上;②钠熔化成银白色光亮的小球;③熔融的钠块四处作无规则运动,有“嘶嘶”的声响,钠块逐渐变小,最后消失;④向反应后的溶液中滴加酚酞,溶液显红色。
这是整个实验的现象,需要学生和教师共同探讨,才可以对钠的性质有比较完整和正确的认识。否则就是属于为观察而观察的实验,意义不大。所以教师此时应不断地引导学生往正确的方向思考,并运用已有的知识,对实验事实进行分析推理,学生之间可以互相交流自己的结论。
[学生讨论,教师提示]现象①表明钠的密度比水小,教师此时可以进一步引导,提出钠可以保存在煤油中这一事实,学生就可以综合得出结论:钠的密度大于煤油的密度而小于水的密度;现象②说明钠的熔点低,但是这样分析并不完整,教师反问:是否熔点低就一定可以熔化呢?有没有其它条件必须满足呢?学生很快回答,该反应放热。通过这样分析,可以使学生得到完整考虑问题的锻炼,一个现象的背后往往有多种原因共同决定;现象③是钠块的运动,说明钠受到了外力,许多学生猜测有气体生成,但是在推测是何种气体时,意见很不统一,有的认为是氢气,有的则保留意见,教师此时也不宜马上说出结论,因为气体的推测又可以设计探究活动,引导学生自己分析并得出结论。同时可以向学生展示推测未知物质的方法和思考的角度,远比直接呈现结论要好得多,学生受到的启发更大;现象④是酚酞由无色变成红色,可以肯定产物中有碱性物质生成,因为反应物是钠与水,可以肯定该碱性物质就是氢氧化钠。
但是以上的分析是片段的、零散的,无法系统揭示钠与水反应的实质。可以进一步设计探究活动,引导学生分析产生的气体是何种气体,用什么方法可以证明,理论方法和实际方法均可以。这样的问题抛出后,学生的思路很广阔。
[学生讨论]学生甲认为在反应Na+H2O→NaOH+?中,Na的化合价是升高的,根据氧化还原的知识,必定有元素的化合价要降低,O元素已经最低价-2价,不可能再下降,所以只有H元素的化合价会降低,生成氢气。学生乙认为在反应Na+H2O→NaOH+?中,H2O中的H和O的个数比是2:1,而NaOH中的H和O的个数比是1:1,说明有H元素多余,那么产物中必定是含有H元素的气体,也就是氢气。学生丙认为刚才的仅仅是推测,最有说服力的是做实验验证。
这三位学生的回答,正好揭示了理论推理和实验论证的双重思考方法,也正是探究活动中必须具有的素质。综上所述,得到结论:钠和水反应生成氢气和氢氧化钠。
上述过程表明,诸多实验事实经过分析比较、抽象、归纳、综合及判断推理等一系列复杂思维活动,才得到结论,学生经过教师适切的引导并经历这一分析过程,可以从“感性认识”加工成“理性认识”。提高了探究性思维的质量,学生的思维角度和方式得到了锻炼和提高,“钠和水的反应”的实验就是一个高效的探究性实验,发挥了实验应有的作用。
案例2:氯水的成分与性质
[演示实验一]观察塑料瓶中的氯气,向瓶中加入一定量的蒸馏水,用力振荡,观察现象。
[思考与交流] 加入一定量的蒸馏水后,塑料瓶发生变形,说明氯气的量减少了。那么,氯气是一个简单的物理溶解过程呢,还是与水反应的化学变化呢?或是两者兼而有之呢?如何证明你的结论呢?
这样的问题抛出之后,学生基本没有反应,但是隐约知道要检验是否有新的物质生成,却没有下手的方向。于是教师就必须进一步有目的地引导。
[引导]可供选择的药品:硝酸酸化的AgNO3溶液 、NaHCO3固体、新制氯水。那么,这些药品能否给你提供一些猜测的方向呢?
经过这样的引导之后,很多学生设计出了自己的方案,其实质是相同的,都知道检验溶液中是否存在H+和Cl-。
[学生探究实验]
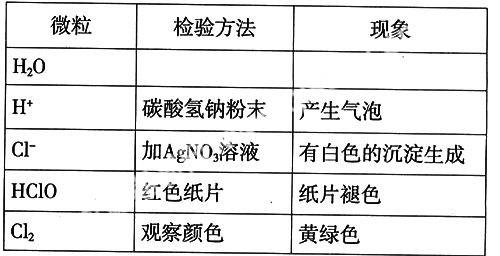
1.在洁净的试管中加入少量的碳酸氢钠粉末,再加入2mL的氯水,振荡试管。
现象及结论:固体溶解,试管中产生气泡。说明氯水中含有H+。
2.在洁净的试管中加入几滴硝酸酸化的硝酸银溶液,再向试管中加入2mL新制氯水。
现象及结论:产生白色沉淀。说明溶液中含有Cl-。
[说明]氯气溶于水,发生了化学反应。且溶液中存在H+和Cl-。
但是氯气溶于水除了有化学反应外,也是存在物理变化的,那么怎样让学生能自己体会到呢?于是教师提出下面的问题,学生肯定是有些莫名其妙的,于是就产生了认知冲突,明明已经证明是有化学变化的,怎么还有物理变化呢?什么意思呢?
[设问]根据前面的实验,我们可以确定Cl2和H2O发生了反应,并且生成了H+和Cl-,那么这个反应有没有特别的地方呢?
[学生观察实验]教师展示一瓶新制氯水,让学生观察。
现象及结论:氯水显淡黄绿色,且有刺激性气味。
[提问]为什么会显黄绿色呢?黄绿色是谁的颜色?说明什么问题?
[学生]黄绿色是氯气的颜色。说明氯水中含有Cl2。
[追问]明明已经发生了反应而且水肯定是过量的,怎么还有氯气多余呢?
对于这个问题,学生是没有办法回答的,于是正好很顺利地提出“可逆反应”的知识。在探究性教学中,需要有知识的直接呈现,但是这并不意味着直接介绍,需要教师在设计时创设适当的问题情景来自然带出概念。
[讲解]像这种反应物和生成物同时存在的反应,称为可逆反应,我们用“?葑”来连接。
氯气溶于水,既有化学反应,又有物理变化。
氯气和水的反应已经了解了大半,但还有一个重要的知识,就是有关“次氯酸”的内容。怎样能把知识讲透,但又不是简单的介绍,以及怎样在探究的过程中引导学生分析问题和培养设计实验的能力呢?
[设问]让我们从化合价的角度来分析这个反应:H2O+Cl2?葑HCl+?,Cl2→Cl-化合价是降低的,根据氧化还原的知识,化合价有降低,就必然有升高。那么,会是什么元素的化合价升高呢? “?”又将代表什么物质呢?该物质又有怎样的性质呢?
[学生探究实验]在洁净的小烧杯中加入一小片红色纸条,再向小烧杯中滴加2mL新制氯水,盖上玻璃片。
现象:红色纸条褪色。说明氯水有漂白性。
[设问]1.使红色纸条褪色的物质是什么呢?
2.能否说明一定就是“?”代表的物质具有漂白性呢?为什么?
3.你认为还应该补充什么实验,才可以进一步得出结论?
因为氯水是混合物,存在的微粒很多,使红色纸条褪色,表现出的是整体性质。所以必须对氯水中的主要微粒逐一进行验证,才能得出结论。这样的目的是让学生明白,化学实验简单现象的背后,原因是复杂的,要敢于质疑。经常这样思考,学生就会自己有所感悟,面对后面所学的知识,就会轻松应对。
有了思考的方向,那么怎样设计实验证明呢?氯水中已经证明存在的微粒有:Cl2、H2O、H+、Cl-。所以必须逐一验证它们是否具有漂白性。特别注意,氯气与水会反应,所以必须使用干燥的氯气进行实验,这样既让学生有思考必须严密的意识,还借机说明干燥的氯气没有漂白性。
应该补充下列几组实验:
1.将有色纸条放入收集有干燥氯气的试管中;
2.将有色纸条放入盛有蒸馏水的试管中;
3.将有色纸条放入盛有盐酸的试管中。
现象及结论:均没有颜色的变化,说明干燥氯气、蒸馏水、盐酸都没有漂白性!
[说明]我们可以肯定“?”代表的物质具有漂白性。
[介绍]氯气与水部分发生了化学反应,生成了盐酸和具有漂白作用的物质——次氯酸(HClO)
HClO的性质和用途:①次氯酸是弱酸②不稳定,在光照下易分解③次氯酸具有强氧化性,因此,能杀死水中的病菌起到消毒作用和漂白作用。
用途:自来水多用氯气来杀菌消毒。
[小结]现在对上述分析和探究做一个简单的归纳。并介绍OH-和 ClO-的由来。
新制氯水中的成分有三分子: Cl2、HClO、H2O;四离子: H+、OH- 、Cl-、ClO-。
设计几个小实验,既是考试中经常出现的,也是对上述知识的巩固。
[思考]:1.氯水呈酸性(H+) ,还能用什么方法来检验其酸性呢?
2.请你推测其对应的现象,并解释。
现象及结论:无论是石蕊指示剂,还是pH试纸,均为先变红后褪色。
通过在探究式教学中开展“实验”中的“引导”活动,教师与学生互相作用、互相促进、共同提高。一方面,教师要在引导过程中不断思考、琢磨,提高自身的教学、科研水平;另一方面,学生在教师的引导下积极思维、热烈讨论,在探究活动的过程中获得成就感,激发了他们学习的热情,而且还把探究精神和创新意识延续到课外,从而提高了学生的综合素质。

