斜卧青霉纤维素酶和木聚糖酶高产菌株的选育
刘新育,靖梅贞,宋安东,刘亮伟,陈红歌
(河南农业大学生命科学学院,河南郑州 450002)
天然纤维素原料是地球上最丰富的可再生资源,但目前被利用的只有11%。纤维素大多被半纤维素包裹,其降解必然受到半纤维素(大多是木聚糖)的制约,所以纤维素酶和木聚糖酶两种酶的联合使用,广泛应用到造纸、食品加工、纺织、动物饲料和能源工业等诸多领域[1-2],具有明显的应用效果。自然界中的微生物通常能同时产生纤维素酶和木聚糖酶,但目前同时产纤维素酶和木聚糖酶的菌株产酶能力还不理想,所以获得既产纤维素酶又产木聚糖酶的微生物成为高效降解纤维素原料的热点途径[3]。本研究利用纤维素酶活力为目前国内领先水平的斜卧青霉A50作为出发菌株,通过原生质体诱变育种方式获得了产双酶且双酶酶活都很高的6号菌,并对该菌株双酶的酶学性质进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 实验菌株 斜卧青霉(Penicillium decumbens)A50,由山东大学微生物技术国家重点实验室曲音波教授馈赠。
1.1.2 试剂与仪器 桦木木聚糖是Sigma产品,蛋白质分子量Marker为TaKaRa产品;DNS溶液配置参照文献[4]方法。UN ICO-7200型可见分光光度计为上海尤尼柯仪器有限公司产品;凝胶成像系统为Gene公司产品。
1.1.3 培养基 ①菌丝生长培养基:改良Mandels营养盐液中加总液量10%的麸皮,煮沸10~15 min。4层纱布过滤,滤液5 000 r/min离心5 min,上清液即为菌丝生长培养基;②再生高渗培养基:向生长培养基中加入0.6 mol/L的葡萄糖;③孢子萌发培养基:生长培养基中加入0.059%的柠檬酸三钠,0.1%的丙酮酸钠,0.05%的L-天冬酰胺,0.005%的MgSO4·7H2O,0.015%的KH2PO4,0.005%的KCl,0.004%的NH4NO3,0.06%的葡萄糖,pH 6.0;④诱变筛选培养基:4%麸皮培养基。
1.2 方法
1.2.1 孢子悬浮液的制备 新鲜斜卧青霉A50菌株斜面,用少量无菌水洗脱后转入50 mL装有玻璃珠的孢子萌发培养基中,30℃静置培养8~12 h,然后200 r/min震荡培养3 h,用于原生质体的制备。
1.2.2 原生质体的紫外诱变 将制备好的原生质体悬浮液(纤维素酶:蜗牛酶:溶菌酶=7.5:7.5:2.5 mg/mL,30℃酶解3 h)稀释至浓度为1×106~5×106个/mL,置于15W紫外灯下25 cm处理20 min。
1.2.3 诱变菌株的筛选 处理过的原生质体适当稀释后涂布于添加0.1%樟脑(10%的乙醇溶液)的再生平板中。33℃恒温避光培养4~6 d,随机挑取菌落转接至菌丝生长斜面,然后接入4%麸皮液体培养基中摇瓶发酵76 h,4层纱布过滤培养液,4℃下10 000 r/min离心10 min,上清即为粗酶液,测定酶活,筛选高酶活的菌株。
1.2.4 木聚糖酶活的测定[5]在最适反应条件下,以每分钟产生1μmol木糖所需要的酶量为一个酶活力单位( IU)。
1.2.5 纤维素酶活的测定[6]在最适反应条件下,以每分钟产生1μmol葡萄糖所需要的酶量为一个酶活力单位( IU)。
1.2.6 胞外蛋白的酶谱检测 分离胶中添加1%木聚糖用于检测木聚糖酶酶谱;分离胶中添加2%羧甲基纤维素钠用于检测纤维素酶酶谱[7-8]。
1.2.7 孢子形态的电镜观察 用碳胶带印上菌落表面的孢子粉,喷镀金原子后,在日立S-3400NⅡ型扫描电子显微镜下观察。
2 结果与分析
2.1 突变株的初筛
A50的原生质体紫外诱变筛选结果见表1,从中筛选出木聚糖酶活和纤维素酶活都比较高的突变株6号菌,其纤维素酶活比亲本A50有稍许提高,木聚糖酶活为67.3 IU/mL,是亲本的1.86倍。经传代10次,6号菌遗传稳定性较好。
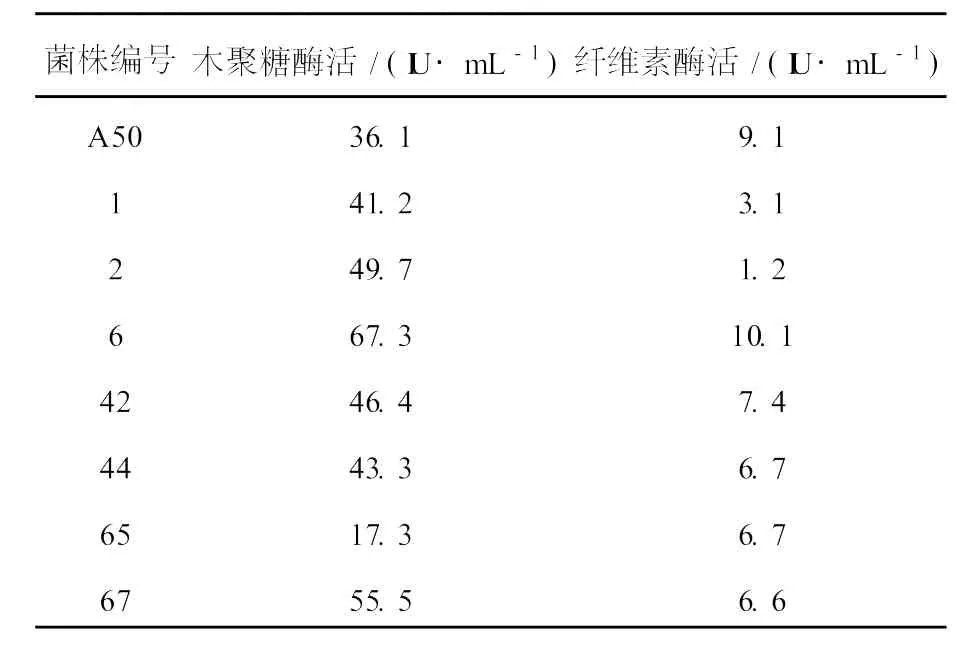
表1 A50诱变部分结果Table 1 The partial results of mutation of strain A50
2.2 菌落和孢子形态观察
在相同生长条件下,A50和6号菌菌落形态相似;培养第10 d,6号菌菌落饱满,而A50菌落出现褶皱。将A50和6号菌的孢子影印、处理,置电镜下观察,结果见图1。A50的孢子为椭圆形,而6号菌的孢子较A50钝圆。
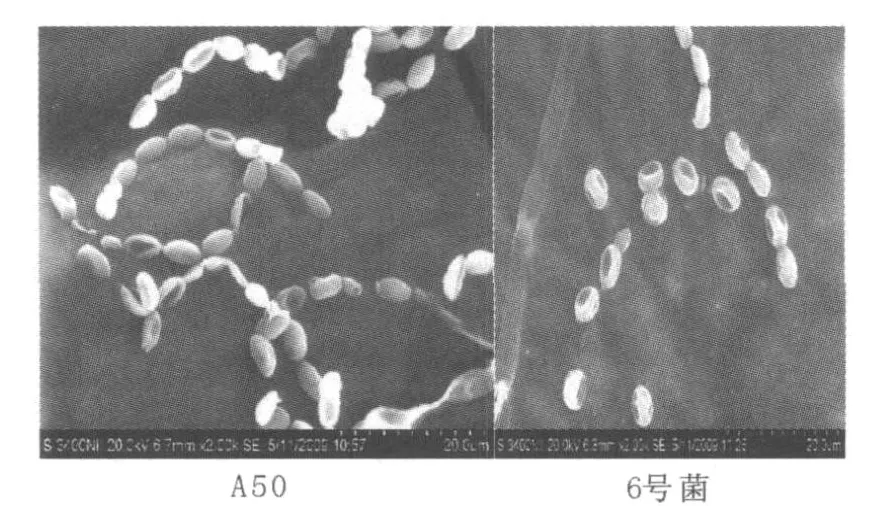
图1 A50和6号菌孢子电镜形态Fig.1 The spores of strain A50 and No.6 strain by SEM
2.3 木聚糖酶和纤维素酶的酶谱检测
将A50和6号菌的粗酶液进行酶谱电泳SDS-PAGE,电泳结束后进行蛋白质复性、反应、染色,结果见图2。酶谱检测表明,6号菌和A50的纤维素酶谱条带基本一致,6号菌条带亮度略强。两菌的木聚糖酶谱差异明显,6号菌比A50多了一条29 ku左右的木聚糖酶条带(PAGE上条带较弱)。由此推测,6号菌木聚糖酶活力的提高可能是因为它的木聚糖酶系发生了变化。
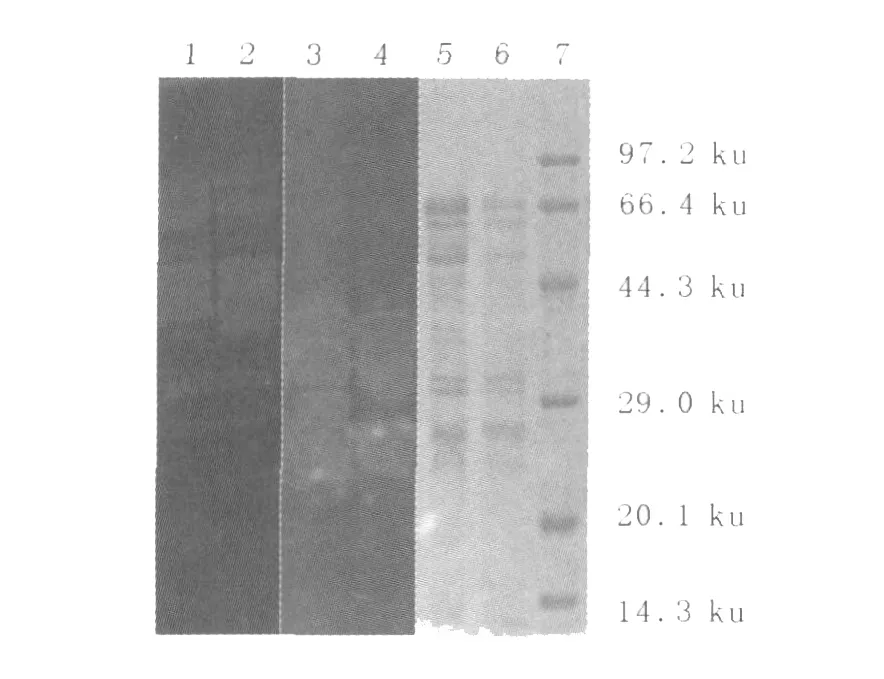
图2 A50和6号菌培养液的SDS-PAGE和酶谱检测Fig.2 Detection of SDS-PAGE and zymogram of cultures from strain A50 and No.6
2.4 麸皮浓度对菌株产酶的影响
选取不同浓度麸皮进行发酵,产酶情况见图3。结果表明,当麸皮浓度为7%时,木聚糖酶活和纤维素酶活都达到最高。

图3 麸皮浓度对6号菌产酶的影响Fig.3 Effects of concentration of bran on strain No.6 producing xylanase and CMCase
2.5 辅加碳源对菌株产酶的影响
在主碳源为7%麸皮的条件下,选择葡萄糖和蔗糖作为辅加碳源,添加浓度为0.1%~0.5%。液体发酵76 h测定双酶活性,结果见表2。从表2可以看出,随着葡萄糖浓度的增大,木聚糖酶活逐渐升高,纤维素酶活稍有下降,可见低浓度的葡萄糖可以促进木聚糖酶的产生;随着蔗糖添加量的增大,纤维素酶活基本不变;蔗糖添加量从0.1%增加到0.2%时木聚糖酶活力有小幅升高,大于0.2%时基本不变。从生产成本的角度,选择0.1%的葡萄糖作为辅加碳源。
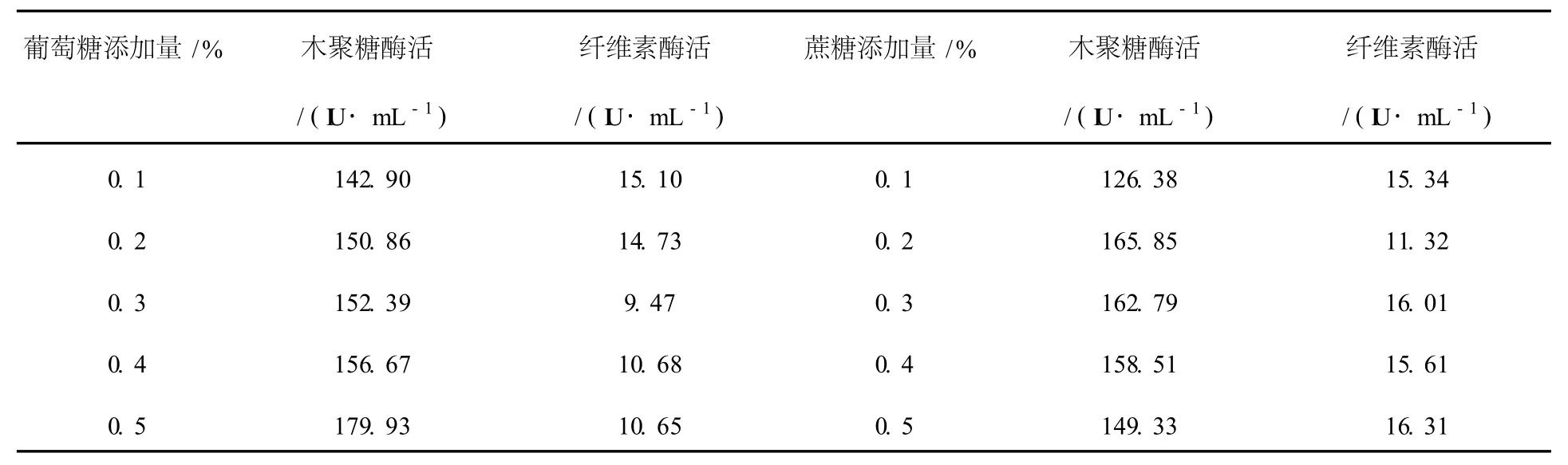
表2 葡萄糖和蔗糖添加量对产酶的影响Table 2 Effects of addition of glucose and sucrose on strain No.6 producing xylanase and CMCase
2.6 突变6号菌在不同温度下的产酶曲线
将突变株6号菌接入上述优化培养基,并在不同温度下摇床培养,从24 h开始,每隔12 h测定双酶酶活,直到96 h结束,结果见图4、图5。结果表明,不同温度下木聚糖酶的产量不同,在28℃和30℃时,木聚糖酶均在84 h到达产酶高峰期,28℃最高酶活力比30℃高,33℃产酶高峰期提前到72 h,且最高酶活比28℃略高;对于纤维素酶,6号菌在28℃和30℃下产酶比较缓慢,菌丝从36 h才开始产酶,84 h达到产酶高峰期,最高酶活性也相差不大,之后产酶能力逐渐下降,33℃时72 h即达到产酶高峰期,最高酶活比前两者也要高。
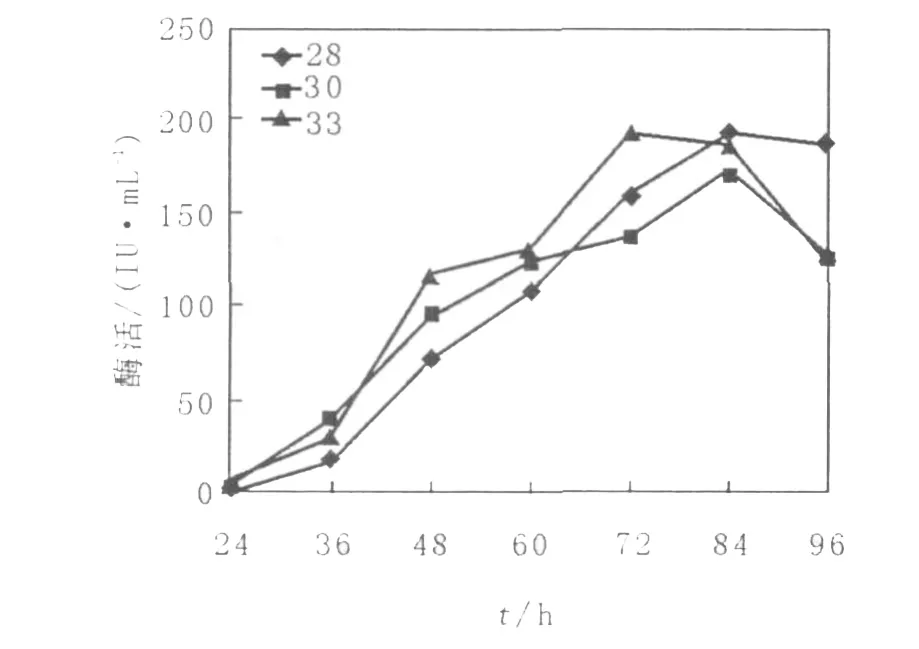
图4 不同温度下6号菌木聚糖酶的产酶曲线Fig.4 The course of strain No.6 producing xylanase under different temperature
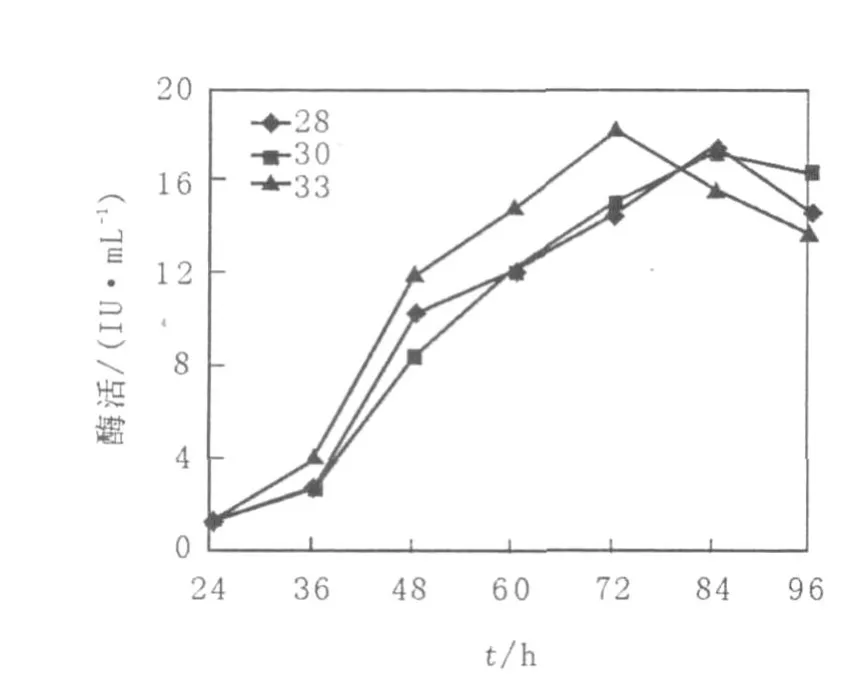
图5 不同温度下6号菌纤维素酶的产酶曲线Fig.5 The course of strain No.6 producing cellulase under different temperature
由于木聚糖酶和纤维素酶产酶期同步,所以选择33℃作为最适发酵温度。
3 讨 论
突变株6号菌的木聚糖酶谱比亲本A50多了一条带,相同培养条件下两者的孢子形态也不同,表明6号菌确实发生了突变,可能是由于基因的表达调控因子得到了诱导或者是抑制因子被解除,使得受抑制的木聚糖酶基因得到表达,从而使木聚糖酶的酶活得到很大提高。
该菌遗传稳定性良好,同时具备纤维素酶和木聚糖酶较高的产酶能力。另外,产酶培养基简单,只需要7%的麸皮和0.1%的葡萄糖,不需要添加其他任何碳源、氮源以及表面活性剂等物质(数据未显示),所以该菌株是一株非常适合工业生产的纤维素酶/木聚糖酶复合酶生产菌株,将有效地提高对纤维素原料的利用效率,在生物转化和饲料等领域将具有很好的应用前景。
[1] P.I.P.Ponte,L.M.A.Ferreira,M.A.C.Soares.Use of Cellulases and Xylanases to SupplementDiets ContainingAlfalfa for Broiler Chicks:Effects on Bird Performance and Skin Color[J].J.Appl.Poult.Res.,2004,13(1):412-420.
[2] 陈朝银,石家骥,钱世钧.纤维素酶的研究进展与发展趋势[J].微生物学杂志,2008,28(1):83-87.
[3] Subramaniyan S,Prema P.Cellulase-free xylanases from Bacillus and othermicroorganis ms[J].FEMSMicrobio Lett,2000,183:1-7.
[4] 北京大学制药厂.微生物和酶学基本知识[M].北京:科学出版社,1971:201.
[5] 陈红歌,朱静,梁改芹,等.黑曲霉木聚糖酶的纯化与性质[J].菌物系统,2000,19(1):111-116.
[6] 孙宪昀.斜卧青霉木质纤维素酶系的合成调控研究[D].山东大学博士论文,2007.
[7] Bartley TD,Murphy-Holland K,Eveleigh DE,A method for the detection and differentiation of celluase compotents in polyacrylamide gels[J].Anal.Biochem.,1984,140-157.
[8] Biely P,Mislivicova D,oman R.Soluble chromogenic substrates for the assay of endo-1,4-β-xylanase and endo-1,4-βglucanases[J].Anal.Biochem.,1985,144:140-142.

