羊驼胎盘(胎膜)形态结构研究
赫晓燕,刘丹丹,曹 靖,郝欢庆,邢海权
(山西农业大学动物科技学院,太谷 030801)
哺乳动物的胎盘是胎儿和母体之间进行物质交换的临时性器官,因其特殊的屏障功能与内分泌功能,自古以来就为人们所重视,中医将经过简单加工和炮制后的人胎盘称为“紫河车”,被认为有养血、益气、补精、滋肾、助孕之功效,具有药用价值。近年来,人们对胎盘的研究逐步深入,已由过去单一的人胎盘研究扩展到羊、鹿、牛、猪等动物的胎盘[1],研究各种动物的胎盘在畜牧业生产中具有重要意义。羊驼是我国近年来新引进的一种经济和生态价值很高的经济动物,它们对不良环境和疾病有强大的抵抗力,羊驼胎盘中所含的有益成分值得关注,到目前为止,国外仅部分学者对羊驼胎盘的结构有过研究[2-4],但其中有很多问题未涉及到。本实验拟对羊驼胎盘的大体结构和组织结构进行系统研究,旨在为研究羊驼胎盘的功能和再利用提供形态学基础。
1 材料和方法
1.1 材料 来自山西农业大学中华羊驼养殖基地的足月正常分娩、产后自然排出的胎盘,共4只。
1.2 方法 羊驼生产后,一方面观察产下的胎盘的颜色、厚度、质地,同时立即取小块组织固定于10%甲醛溶液中,按常规方法制成石蜡切片,片厚5 μm,HE染色,光学显微镜下观察。
2 结果
2.1 羊驼胎盘外观 肉眼观察,羊驼胎盘呈弯曲的钩状囊,绒毛散布于胎盘表面,排出的尿囊中充满尿液,羊膜随胎盘排出,为白色的薄膜,卵黄囊退化,只留少量痕迹,除此之外,刚产下的新生儿羊驼的躯干、头部、颈部和四肢表面覆盖着一种不透明的白色膜,称表皮膜或上皮膜(epidermal membrane,EM),厚度为1~2 mm。表皮膜紧贴于新生儿羊驼皮肤与黏膜交界处,如嘴唇、鼻孔、肛门、阴门、阴茎、包皮等处,也紧贴于皮肤与足垫连接处、蹄冠及脐带等处,并且在这些部位EM明显增厚。新生儿羊驼产出后,迅速从胎儿表面将EM剥离,足月胎儿的EM是纤维性的,很容易从新生儿表面脱落,甚至轻轻地动作或摩擦,EM会很快干燥并且脱落。
2.2 羊驼胎盘的显微结构
2.2.1 表皮膜(EM) 光镜下可见,EM属复层扁平上皮,表层和中间层细胞均呈扁平鳞片状。正面观,上皮细胞为多边形,体积较大,细胞界限清晰,边缘为锯齿状,很多细胞中央有核,核为圆形,淡染,有些核中央可见到明显的核仁,细胞质淡染,呈空网状(图1)。侧面观,表皮膜由多层扁平细胞构成,很多细胞中央可见扁平的核。
2.2.2 羊膜和尿囊 光镜下观察,羊驼羊膜为一很薄的膜,表层有一层排列较紧密的扁平细胞,深层为结缔组织,浅层为较薄的致密结缔组织,可见长梭形的成纤维细胞,深层为疏松的结缔组织膜(图2)。
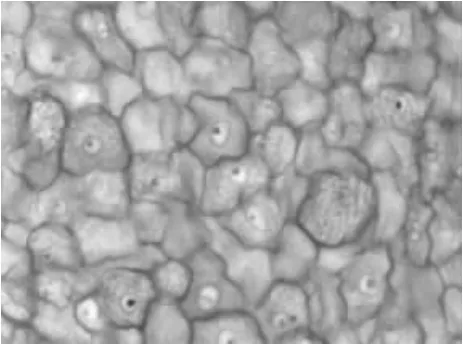
图1 羊驼表皮膜正面观(HE)40×
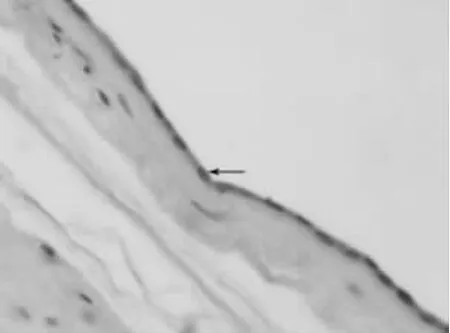
图2 羊驼羊膜光镜结构(HE)400×
羊驼的羊膜和尿囊膜的结构类似于其他哺乳动物。没有“自由”的膜,整个胎盘被绒毛和滋养层覆盖着。通常在尿囊会发现尿囊小体。
2.2.3 绒毛膜 光镜下可见许多大小不等、形态不一的绒毛断面,有些部位的绒毛呈块状,绒毛表面的滋养层细胞大部分呈柱状或立方形,但有些部位为扁平细胞,大量的毛细血管侵入滋养层上皮(图3A、B、C)。在一些绒毛的顶端可见体积较大的、多核的巨大细胞,这些细胞形态不规则,内有3~5个大细胞核(图4A、B)。
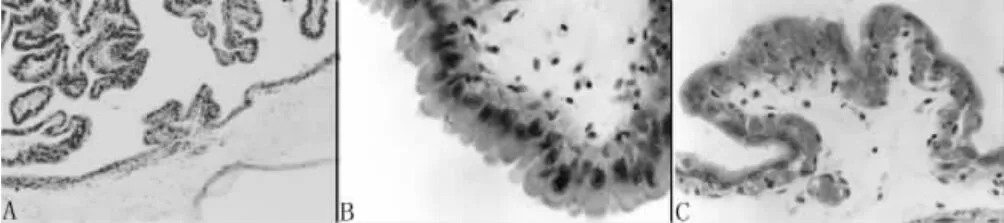
图3 羊驼绒毛膜的绒毛及滋养层上皮细胞
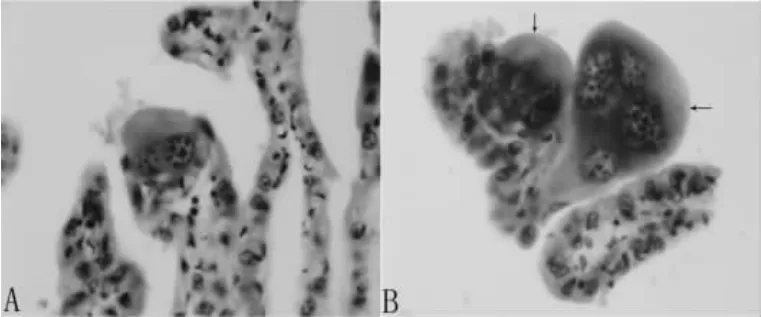
图4 羊驼绒毛顶端的巨大细胞
3 讨论
3.1 羊驼胎盘的结构特征 经学者对单峰驼、双峰驼、美洲驼(llama)和羊驼等的研究认为,骆驼科动物的胎盘与猪和马相似,属上皮绒毛膜胎盘,胎膜包括绒毛膜、卵黄囊、尿囊、羊膜及特有的表皮膜[2-5],我们对羊驼胎盘的肉眼和组织学观察结果与此相符。
羊驼所特有的胎膜是上皮膜,它由鳞状上皮构成,这种膜被认为是来自于胎儿表皮,其功能不清[6]。表皮膜(epidermal membrane,EM)是骆驼科动物所特有的,一般易与羊膜混淆[7-8]。因为EM没有覆盖鼻孔或嘴,所以即使出生后没有立即移走新生儿的EM,也很少造成新生儿的产后窒息,这与羊膜形成对照。在大多数哺乳动物羊膜可能完全覆盖住鼻子和嘴,使其窒息几乎不能挣扎。Steven等(1980)描述羊驼羊膜上皮由成层的鳞状上皮组成,有6~8层[2]。Fowler观察到EM由很厚的一层复层鳞状上皮细胞构成,外层为角化层,细胞界限清晰,但没有细胞核,膜上没有弹性纤维,组织化学技术显示,二硫化物和巯基是很丰富的[3],但本实验所观察的EM切片中的很多细胞有细胞核,这些有核细胞与无核细胞在功能上是否有别还有待于研究。
神经胚形成之后,覆盖胚胎表面的细胞构成预定表皮。开始,表皮只由一层细胞组成,但在多数脊椎动物中,表皮很快成为两层结构,外面一层形成胚皮(periderm),胚皮是临时性结构,一旦底层细胞分化成表皮,胚皮便脱落[8],羊驼的EM是否是未脱落的胚皮及其功能有待于进一步研究。
绒毛膜滋养层细胞大部分是单核细胞,它们可能参与母—胎物质交换的大部分过程,另外从妊娠后2个月直到分娩可见许多形状不规则的多核滋养层细胞[4-5]。我们的研究显示在娩出的羊驼胎盘的绒毛顶端也有许多滋养层多核巨大细胞。Gorkhovskii等认为这些巨大细胞是由于核内有丝分裂形成的多倍体,并推测它们有内分泌功能[9]。Skidmore等发现在小的、着床的样本中,这些巨大细胞位于腺体的顶部,但认为其功能不清[5]。Wooding等则认为这些巨大细胞可表达类固醇生成酶[10]。Klisch等用光镜、电镜观察和Feulgen染色等方法研究了妊娠150 d、264 d、347 d和足月的羊驼胎盘的滋养层多核巨大细胞,认为羊驼滋养层多核巨大细胞有丝分裂时DNA含量的增加是由于染色体多倍体化而不是核内复制,羊驼滋养层多核巨大细胞中的染色体增殖具有高水平的多倍体化性质而不同于其他物种的动物,但他并没有研究这种细胞的功能[11]。本实验中我们只观察了这种多核巨大细胞,在以TGF-β1、GH、PRL作为一抗,以胎盘为组织进行免疫组织化学染色时,这种多核巨大细胞没有阳性细胞出现,提示了与其他滋养层细胞相比,这种细胞内分泌功能的有限性。但有关羊驼滋养层多核巨大细胞的功能有待于进一步研究。
羊驼绒毛膜滋养层的另一个特点是滋养层上皮有丰富的毛细血管,血管深陷在两层上皮之间。据Steven等的观察、测量,两个血管之间的距离降至2 μm[2]。有学者评论这种现象并且推测这对于高海拔地区胎儿的发育是很有益的。然而,这种情况也发生在海平面或单、双峰驼,因此推测这种情况并不是由于低氧压所引起的。
4 结论
利用肉眼、光学显微镜观察羊驼胎盘,羊驼胎盘的类型同其他骆驼科动物的胎盘,属上皮绒毛膜胎盘,胎膜包括绒毛膜、卵黄囊、尿囊、羊膜及特有的表皮膜。绒毛膜细胞的顶端也有巨型多核细胞;表皮膜由多层扁平细胞构成,与其他学者研究不同的是,我们发现很多外层细胞中央有扁平的细胞核,但其功能不清。
[1]张淑二,陶勇,张运海,等.胎盘的有效成分及其应用[J].动物医学进展,2007,28(9).
[2]Steven D H,Burton G J,Sumar J,et al.Ultrastructural observations on the placenta of the alpaca(Lama pacos)[J].Placenta,1980,1:21-32.
[3]Fowler M E,Harvey J Olander. Fetal membranes and ancillary structure of llamas(Lama glama)[J].Am J Vet Res,1990,51(9):1495-1500.
[4]Olivera L D,Zago R,Leiser C,et al.Placentation in the alpaca Lama pacos[J].Anat Embryol(Berl),2003,207:45-62.
[5]Skidmore J A,F B Wooding,W R Allen.Implantation and early placentation in the one-humped camel(Camelus dromedarius)[J].Placenta,1996,17:253-262.
[6]Fowler M E.Medicine and surgery of south American camelids.llama,alpaca,vicuña,guanaco.Seconded[M].Ames,Iowa:Iowa State University Press,1998.
[7]Merkt H,Böer M,Rath D,et al.The presence of an additional fetal membrane and its function in the newborn guanaco Lama guanacoe[J].Thrriogenology,1988,30:437-439.
[8]张红卫.发育生物学[M].北京:高等教育出版社,2001.
[9]Gorokhovskii N L,Shmidt G A,Shagaeva V G,et al.Giant cells in the placenta of the Bactrian camel in the fetal period of development[J].Arkh Anat Gistol Embriol,1975,69:41-46.
[10]Wooding F B,M Ozturk,J A Skidmore,et al.Developmental changes in localization of steroid synthesis enzymes in camelid placenta[J].Reproduction,2003,126:239-247.
[11]K Klisch,E Bevilacqua,L V M Olivera.Mitotic polyploidization in trophoblast giant cells of the alpaca[J].Cells Tissues Organs 2005,181:103-10.

