机械力作用下人牙周膜细胞Osterixm RNA和蛋白的表达
赵艳红 李洪发 王春玲 郑朝 付雅丽 魏福兰
(1.天津医科大学口腔医院 正畸科,天津 300070;2.山东大学口腔医院 正畸科,山东 济南 250012)
机械力作用下人牙周膜细胞Osterixm RNA和蛋白的表达
赵艳红1李洪发1王春玲2郑朝1付雅丽1魏福兰2
(1.天津医科大学口腔医院 正畸科,天津 300070;2.山东大学口腔医院 正畸科,山东 济南 250012)
目的 研究在机械力作用下人牙周膜细胞内Osterix(Osx)mRNA和蛋白的表达变化,探讨Osx与正畸牙周组织骨改建的关系。方法 组织块法培养人牙周膜细胞,采用离心加力装置对细胞分别加载1、2、4、6、8、12 h的机械力。逆转录聚合酶链反应(RT-PCR)、Western blot及细胞免疫荧光化学技术分别检测不同时间点Osx mRNA和蛋白的表达变化及其细胞定位。结果 在正常人牙周膜细胞中,Osx mRNA表达微弱,蛋白未见表达;在机械力加载4 h后,Osx mRNA表达开始明显增强(P<0.01),蛋白呈现弱表达(P<0.05);加载8 h时,Osx mRNA和蛋白表达显著增强(P<0.01);持续增加至加力12 h。同时,加力4 h后,少量细胞的胞质内开始呈现微弱的绿色荧光;12 h后,阳性表达主要集中在胞核内。结论 机械力可诱导人牙周膜细胞Osx表达增强及活化。Osx可能参与了细胞内生物力学信号的转导,从而可能在正畸牙周组织的骨改建过程中发挥着重要作用。
人牙周膜细胞; 机械刺激; 成骨分化; 骨改建
正畸牙移动是通过机械力作用下牙周组织发生改建来完成的,其中以牙槽骨改建为主。在此改建过程中,牙周膜的生物力学反应起着至关重要的介导和调控作用[1]。其中,牙周膜细胞是矫治力的直接效应细胞[2],在牵张力的作用下可向成骨样细胞分化,发生成骨反应,促进骨改建。牙周膜细胞受力后骨向分化过程中,机械物理信号转化为细胞内生化信号的分子机制比较复杂,包含多条信号转导途径[3-4]。近年的研究表明,一些核内转录因子也参与了细胞内调控途径,将细胞外物理或机械刺激转化为协调的细胞反应[5-6]。
Osterix(Osx)[7]是新近发现的一种含有锌指结构的骨形成转录因子。它是成骨细胞分化和骨形成不可缺少的一个关键调节因子。近来少量研究发现,Osx在牙胚、造釉细胞瘤牙源性组织中均有阳性表达,表明Osx可能在牙齿、牙周组织的发育中发挥着重要的作用[7-8]。同时,已有研究证实机械力在诱导部分非成骨细胞系发生成骨反应过程中,能显著增强Osx的表达,指出Osx介导了细胞外机械刺激向细胞内成骨反应的信号转化[9]。基于以往研究,推测Osx可能参与了机械力诱导的牙周膜细胞成骨分化,从而在正畸牙周组织的骨改建中发挥一定作用。本实验采用离心加载装置对体外培养的人牙周膜细胞加载机械力,观察人牙周膜细胞在持续受力下Osx mRNA和蛋白的表达,从细胞基因和蛋白水平初步探讨Osx在正畸牙周组织骨改建中的作用机制。
1 材料和方法
1.1 材料
DMEM培养基(高糖)、胰蛋白酶(Sigma公司,美国),胎牛血清(fetal bovine serum,FBS)(杭州四季青生物工程材料有限公司),波形丝蛋白和角蛋白抗体(武汉博士德生物工程有限公司),即用型SP免疫组化检测试剂盒、FITC标记兔抗山羊IgG(北京中杉金桥生物技术有限公司),cDNA反转录试剂盒(Fermentas公司,美国),聚偏二氟乙烯(polyvinylidene fluorid,PVDF)膜(Amersham Biosciences公司,瑞典)。
IXZ-ILL100型倒置相差显微镜、CX71显微镜及照相系统(OLYMPUS公司,日本),CO2细胞培养箱、台式冷冻高速离心机(Heraeus公司,德国),5810R型高速台式离心机(Eppendoff公司,德国),梯度PCR仪(Biometra公司,德国),电泳槽、电泳仪、电转仪、制胶器(BIO RAD公司,美国)。
1.2 方法
1.2.1 人牙周膜细胞的原代培养和鉴定 取11~14岁青少年因正畸拔除的牙周健康的前磨牙。采用组织块法原代培养人牙周膜细胞,取第2代细胞爬片,用免疫组化SP法进行波形丝蛋白和角蛋白染色,进行来源鉴定。
1.2.2 人牙周膜细胞的体外加力 本研究采用离心加力法对细胞加载机械力[10-11]。取生长良好的第2~3代人牙周膜细胞,按每孔2.5×105个接种于6孔细胞培养板。待细胞融合80%,换用含2%FBS的条件培养液继续培养24 h,倒置相差显微镜观察细胞生长及贴壁情况。实验组与对照组同时种板。将六孔板在无菌条件下用无菌密封胶密封,置于37℃离心机加力支架中,实验组以离心机加力(631 r·min-1,约80 g相对离心力),加力时间分别为1、2、4、6、8、12 h。此加力方式相当于对人牙周膜细胞施加一个接近正畸临床的持续压力,大小约为16 g·cm-2,属于正畸临床轻力范围[12]。
1.2.3 逆转录聚合酶链反应 采用Trizol法提取细胞总RNA,并进行质量测定。应用cDNA反转录试剂盒建立反应体系,离心混匀后置于循环变温加热器进行反转录。反应条件为:37℃ 1 h,95℃ 5min。生成的cDNA置冰上行后续实验或-20℃保存备用。
取2μL cDNA,采用LightCycler FastStart DNA Master SYBR GreenⅠ建立反应体系,放入LightCycler机器内,按照实验说明进行逆转录聚合酶链反应(reverse transcription-polymerase chain raction,RT-PCR)。反应程序为:95℃预变性10min;95℃变性10 s、55℃退火10 s、72℃延伸5 s,循环45次。融解分析产物特异性,电泳鉴定产物大小正确。以β-actin作为内参照,用LightCycler Software Ver. 4.0分析目的基因的相对表达水平。本实验中除Osx mRNA外同时检测了成骨标志基因碱性磷酸酶(alkaline phosphatase,ALP)和骨钙素(osteocalcin,OC)mRNA的表达,以反映细胞的成骨分化情况。其中所用基因引物序列具体见表1。

表1 基因引物序列列表Tab 1 Specific primers used for RT-PCR
1.2.4 Western blot检测 收集细胞5×106个,冰上加入适量(200μL)细胞裂解液(50mmol·L-1Tris-HCl、150 mmol·L-1NaCl、1%Triton X-100、1mmol·L-1乙二胺四乙酸、10%丙三醇、0.5mmol·L-1苯甲基磺酰氟化物、10μg·mL-1亮肽酶素和1μg·mL-1抑酞酶),裂解细胞,低温离心,获取全蛋白上清,-80℃保存备用。采用BCA蛋白检测试剂盒测定蛋白浓度。
取等量蛋白样品,进行SDS-PAGE蛋白电泳,后将蛋白带转移到PVDF膜上,封闭液封闭,加入山羊抗人、鼠Osx多克隆抗体(1∶250)4℃过夜,漂洗后加入用TBS稀释的辣根酶标记兔抗山羊二抗(1∶2 500),摇动反应1~2 h进行杂交,显色。实验以actin作为内参照,应用JD801图像分析系统测定目的条带的相对积分光密度,分析Osx蛋白表达水平。
1.2.5 细胞免疫荧光检测 细胞免疫荧光技术可直观地阐述Osx蛋白的表达、亚细胞定位,并间接反映其活性状态[13]。首先将长有细胞的玻片放于玻璃器皿内,冷丙酮固定,2%Triton-X 100的PBS透化,正常兔血清封闭,滴加用抗体稀释液稀释的山羊抗人Osx一抗(1∶100),湿盒中4℃过夜,漂洗后滴加用FITC标记的兔抗山羊二抗(1∶100),暗室中在室温孵育30~60min,PBS彻底漂洗,90%甘油封片。荧光显微镜下进行观察,随机选取3个视野,记录绿色荧光着色分布情况,并拍照,据此统计分析Osx蛋白阳性表达的细胞数量及其核内阳性表达的细胞比例。
1.3 统计学分析
采用SPSS 12.0统计软件包对数据进行分析,对数据进行单因素方差分析和t检验。
2 结果
2.1 人牙周膜细胞体外培养及鉴定
倒置显微镜下观察,牙周膜组织块在5~10 d内开始有细胞游出,以组织块为中心呈放射状排列生长,20 d左右爬满培养瓶。人牙周膜细胞呈长梭形,胞体丰满,胞浆均匀,胞核呈圆形或卵圆形,传代后细胞生长旺盛、性状稳定,具有成纤维细胞特性。免疫细胞化学检测结果为抗波形丝蛋白阳性、抗角蛋白阴性(图1)。
2.2 机械力作用下人牙周膜细胞中ALP和OCmRNA的表达
在正常人牙周膜细胞内,ALP mRNA表达较强,而OCmRNA表达极其微弱。加力1 h后,ALP表达水平明显升高,而在加力4 h后,OC表达水平开始增强,此后两者持续增强至加力12 h(图2)。

图1 人牙周膜细胞的来源鉴定 SP ×200Fig 1 The identification of human periodontal ligament cells SP ×200
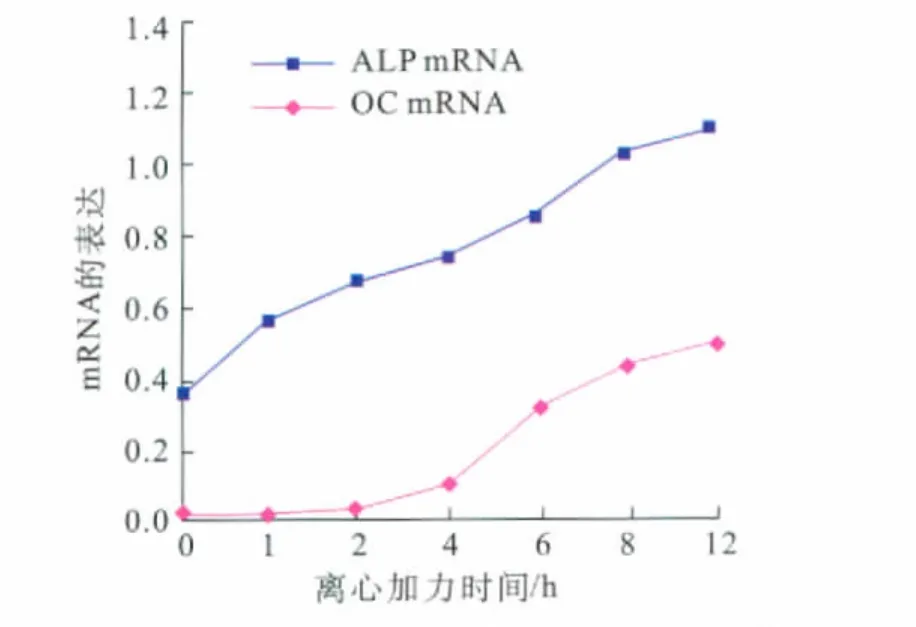
图2 机械力作用下人牙周膜细胞中ALP和OCmRNA的表达Fig 2 Expression of ALP and OC mRNA in human periodontal ligament cells under mechanical stimulation
2.3 人牙周膜细胞加力不同时间点Osx mRNA的表达
RT-PCR检测发现,Osx mRNA在正常人牙周膜细胞中的表达极其微弱。加载离心力后,Osx mRNA的表达发生一系列变化:加力1、2 h时,OsxmRNA的表达略升高,但变化无统计学意义(P>0.05);加力4h时,Osx mRNA开始明显增强(P<0.01);加力8 h时,OsxmRNA表达显著增强(P<0.01);此后Osx mRNA表达缓慢增加,持续到12 h加力结束(图3)。
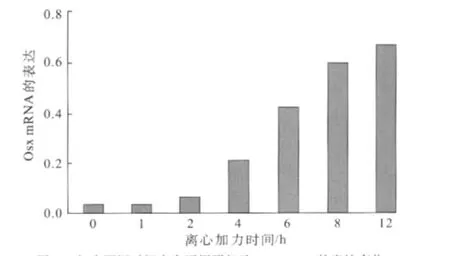
图3 加力不同时间点人牙周膜细胞Osx mRNA的表达变化Fig 3 Effect of mechanical force on expression of OsxmRNA in human periodontal ligament cells
2.4 人牙周膜细胞加力不同时间点Osx蛋白的表达
经Western blot检测,Osx蛋白在正常人牙周膜细胞中未见表达。细胞加载离心力1、2 h时,仍未检测到Osx蛋白表达(P>0.05);加力4 h时,检测到一条相对分子质量为4.6×104的微弱蛋白条带,说明Osx蛋白开始呈现弱表达(P<0.05);加力6、8 h时,Osx蛋白表达逐渐增加(P<0.01);加力12 h时,Osx蛋白表达显著增强,达到最高水平。变化具有时间依从性(图4)。
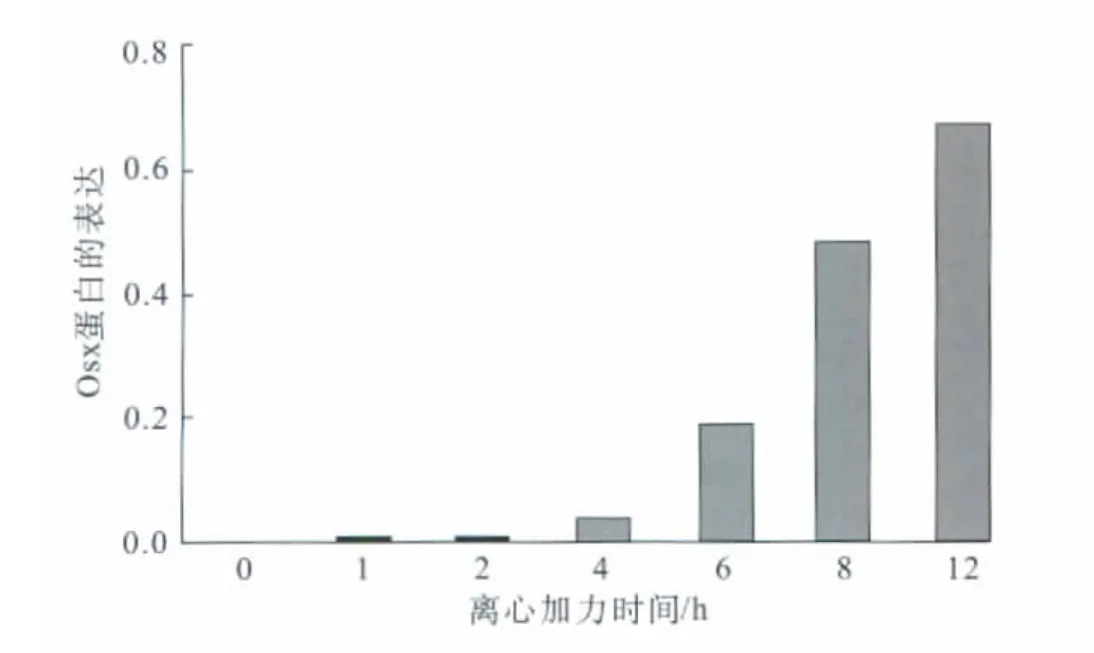
图4 加力不同时间点人牙周膜细胞Osx蛋白的表达变化Fig 4 Effect of mechanical force on expression of Osx protein in human periodontal ligament cells
2.5 免疫荧光检测结果
免疫荧光检测结果显示,正常人牙周膜细胞内无绿色荧光着色;加力1、2 h的细胞内未检测到Osx阳性表达产物;加力4 h后,少量细胞的细胞质内开始呈现微弱的绿色荧光(P<0.01);加力8 h时,约40%~50%的细胞发出明显的绿色荧光,细胞质、细胞核内均有阳性表达产物;加力12 h时,大部分细胞(约87%)呈现强阳性表达,且主要集中在细胞核内(图5、6)。

图5 机械力作用下人牙周膜细胞Osx蛋白绿色荧光阳性表达的细胞比例及其核内阳性表达的细胞比例Fig 5 Percentage changes of Osx protein-positive cells under mechanical stimulation

图6 机械力作用下人牙周膜细胞Osx蛋白绿色荧光表达情况 免疫荧光 ×200 Fig 6 Expression of green fluorescence of Osx protein under mechanical stimulation immunofluorescence ×200
3 讨论
3.1 机械力的体外加载
在细胞生物力学研究中,如何模拟体内的生理水平,对体外细胞施加机械力刺激并进行精确的控制一直是众多学者研究重点之一。近几十年来,对体外培养的细胞施加机械刺激的装置已有多种,如流体剪切力[14]、流体静压力[15]、膜机械拉伸[16]、离心力[7,10]等方式。本研究采用了离心加力法。施加离心力是可靠的加力方式之一,力值稳定,重复性好。本研究所采用的离心加力方式与一些学者[7,10]所提出的加力方式类似,即使培养细胞在培养板上贴壁,然后加载离心力,克服了以往悬浮离心加力时细胞间或细胞与基质间无附着的缺陷。并在加力前换用含2%FBS的培养基使细胞同步化,使尽可能多的细胞处于同一细胞周期,减少不确定因素的影响。本研究为了模拟临床生理性的正畸轻力并保证细胞活力,采用了80 g的离心力。此离心力使贴壁生长的牙周膜细胞受到一个顶-底轴向的持续压力,力值为 16 g·cm-2,经观察对细胞形态及活力无明显影响。
3.2 在机械力作用下人牙周膜细胞向成骨样细胞分化
本研究对体外培养的人牙周膜细胞加载离心力后,早期ALP mRNA表达水平明显升高,随后,OC mRNA表达也逐渐增强。这与以往研究结果[17]相一致,ALP和OC都是成骨细胞的标志产物,说明机械力可以诱导人牙周膜细胞向成骨样细胞分化。人牙周膜细胞在牵张力作用下,ALP分泌活性增加,OC蛋白出现较缓慢和晚期的表达增强,提示人牙周膜细胞在机械力诱导下能向成骨样细胞分化成熟[17]。
3.3 Osx在机械力诱导人牙周膜细胞成骨分化过程中的表达
Osx[7]是新近发现的调控成骨细胞分化和骨形成的一个关键转录因子。人类Osx同源物又称为Sp7,属于Sp/XKLF家族[18]。Osx调控许多重要的成骨基因的表达,如骨钙素、骨黏素、骨桥素、骨涎蛋白和Ⅰ型胶原蛋白。Osx单独作用就可有效诱导鼠胚胎干细胞、骨髓基质细胞[19]和脂肪干细胞[20]分化为成骨细胞系。Osx基因剔除小鼠胚胎中,成骨细胞的分化受到阻碍,不能发生矿化反应,完全丧失骨形成能力;出生后不久即因呼吸困难而死去。这些研究说明Osx是成骨细胞分化和骨发育不可缺少的调节因子。Osx mRNA在牙胚、造釉细胞瘤牙源性组织中均有阳性表达。这些表明Osx可能在牙齿、牙周组织的发育中具有重要的作用[7-8]。
已有研究表明机械力刺激能够诱导Osx的表达。Fan等[21]发现对永生化前成骨细胞进行2%牵张刺激过夜后,Osx的表达强度增加了2倍。而Mitsui等[22]报道1.0 g·cm-2的持续压力在诱导人成骨细胞Saos-2发生成骨反应过程中,能显著增强Osx的表达。Kanno等[5]研究指出单轴正弦式牵张应力(牵张15%)不仅能够增加成骨样细胞MC3T3-E1和原代成骨细胞ALP活性和OC的表达,并显著增强Osx和核心结合因子α1表达。Fan等[9]实验不仅证实了机械应力能够诱导TOLF细胞Osx mRNA明显表达,并进一步验证了Osx是机械信号的一个关键靶目标。
本实验采用离心加力法对人牙周膜细胞加载机械力,诱导其向成骨样细胞分化,以检测Osx是否在人牙周膜细胞内机械应力转化为成骨反应的信号转导途径中发挥作用。本实验发现Osx mRNA在正常人牙周膜细胞中有极其微弱的表达,但未检测到Osx蛋白表达;在离心力作用的12 h内,人牙周膜细胞内Osx mRNA表达逐渐增强,Osx蛋白表达从无到有,并逐渐增强,说明机械力能够显著增强人牙周膜细胞内Osx基因和蛋白表达,Osx可能参与了机械力诱导的人牙周膜细胞成骨分化的过程。
细胞免疫荧光检测技术通过呈现一定绿色荧光可以对Osx蛋白的活性状态提供一个间接的视觉评测[13]。通常情况下,转录因子在细胞浆内激活后,会自细胞浆移入细胞核,在细胞核内与其他因子协同调控其下游基因的表达[23]。因此,动态的核转移表明了转录因子已被激活[13],具有转录作用。本实验结果显示,在机械力的持续作用下,Osx蛋白绿色荧光最先在胞浆内发生,后逐渐集中于细胞核,核内荧光逐渐增强,说明Osx蛋白在胞浆内合成并发生活化,逐渐从胞浆转移到胞核,从而发挥信号转导和分化调控作用[13],即调控着其下游矿化基因的表达[24]和细胞的成骨分化成熟。由此可见,Osx是机械刺激和人牙周膜细胞成骨分化间的一个关键性的中间分子环节,参与了机械应力诱导的牙周膜细胞成骨分化及矿化反应,进而在正畸牙周组织的骨改建中发挥着重要的信号转导和转录调控作用。
[1] Kawarizadeh A,Bourauel C,Götz W,et al.Early responses of periodontal ligament cells to mechanical stimulus in vivo[J].J Dent Res,2005,84(10):902-906.
[2] Basdra EK,Komposch G.Osteoblast-like properties of human periodontal ligament cells:An in vitro analysis[J].Eur J Orthod, 1997,19(6):615-621.
[3] Bakker AD,Soejima K,Klein-Nulend J,et al.The production of nitric oxide and prostaglandin E(2)by primary bone cells is shear stress dependent[J].J Biomech,2001,34(5):671-677.
[4] Ryder KD,Duncan RL.Parathyroid hormone enhances fluid shear-induced[Ca2+]signaling in osteoblastic cells through activation of mechanosensitive and voltage-sensitive Ca2+channels[J].J Bone Miner Res,2001,16(2):240-248.
[5] Kanno T,Takahashi T,Tsujisawa T,et al.Mechanical stressmediated Runx2 activation is dependent on Ras/ERK1/2 MAPK signaling in osteoblasts[J].J Cell Biochem,2007,101(5):1266-1277.
[6] Wei F,Wang C,Zhou G,et al.The effect of centrifugal force on the mRNA and protein levels of ATF4 in cultured human periodontal ligament fibroblasts[J].Arch Oral Biol,2008,53(1):35-43.
[7] Nakashima K,Zhou X,Kunkel G,et al.The novel zinc fingercontaining transcription factor osterix is required for osteoblast differentiation and bone formation[J].Cell,2002,108(1):17-29.
[8] Kumamoto H,Ooya K.Expression of bone morphogenetic proteins and their associated molecules in ameloblastomas and adenomatoid odontogenic tumors[J].Oral Dis,2006,12(2):163-170.
[9] Fan D,Chen Z,Wang D,et al.Osterix is a key target for mechanical signals in human thoracic ligament flavum cells[J].J Cell Physiol,2007,211(3):577-584.
[10]Fitzgerald J,Hughes-Fulford M.Mechanically induced c-fos expression is mediated by cAMP in MC3T3-E1 osteoblasts[J]. FASEB J,1999,13(3):553-557.
[11] Redlich M,Asher Roos H,Reichenberg E,et al.Expression of tropoelastin in human periodontal ligament fibroblasts after simulation of orthodontic force[J].Arch Oral Biol,2004,49(2):119-124.
[12]Davidovitch Z.Tooth movement[J].Crit Rev Oral Biol Med,1991, 2(4):411-450.
[13] Tai G,Christodoulou I,Bishop AE,et al.Use of green fluorescent fusion protein to track activation of the transcription factor osterix during early osteoblast differentiation[J].Biochem Biophys Res Commun,2005,333(4):1116-1122.
[14]Kapur S,Baylink DJ,Lau KH.Fluid flow shear stress stimulates human osteoblast proliferation and differentiation through multiple interacting and competing signal transduction pathways [J].Bone,2003,32(3):241-251.
[15] Yousefian J,Firouzian F,Shanfeld J,et al.A new experimental model for studying the response of periodontal ligament cells to hydrostatic pressure[J].Am J Orthod Dentofacial Orthop,1995, 108(4):402-409.
[16]Liu J,Zou L,Zheng Y,et al.NF-kappaB responds to mechanical strains in osteoblast-like cells,and lighter strains create an NF-kappaB response more readily[J].Cell Biol Int,2007,31(10):1220-1224.
[17]Yang YQ,Li XT,Rabie AB,et al.Human periodontal ligament cells express osteoblastic phenotypes under intermittent force loading in vitro[J].Front Biosci,2006,11:776-781.
[18] Gao Y,Jheon A,Nourkeyhani H,et al.Molecular cloning, structure,expression,and chromosomal localization of the human Osterix(SP7)gene[J].Gene,2004,341:101-110.
[19] Tu Q,Valverde P,Chen J.Osterix enhances proliferation and osteogenic potential of bone marrow stromal cells[J].Biochem Biophys Res Commun,2006,341(4):1257-1265.
[20] Wu L,Wu Y,Lin Y,et al.Osteogenic differentiation of adipose derived stem cells promoted by overexpression of osterix[J].Mol Cell Biochem,2007,301(1/2):83-92.
[21] Fan X,Rahnert JA,Murphy TC,et al.Response to mechanical strain in an immortalized pre-osteoblast cell is dependent on ERK1/2[J].J Cell Physiol,2006,207(2):454-460.
[22] Mitsui N,Suzuki N,Maeno M,et al.Optimal compressive force induces bone formation via increasing bone morphogenetic proteins production and decreasing their antagonists production by Saos-2 cells[J].Life Sci,2006,78(23):2697-2706.
[23] Villard J.Transcription regulation and human diseases[J].Swiss Med Wkly,2004,134(39/40):571-579.
[24] Hatta M,Yoshimura Y,Deyama Y,et al.Molecular characterization of the zinc finger transcription factor,Osterix[J].Int J Mol Med,2006,17(3):425-430.
(本文编辑 王晴)
Expression of Osterix mRNA and protein levels in cultured human periodontal ligament cells after mechanical stimulation
ZHAO Yan-hong1,LI Hong-fa1,WANG Chun-ling2,ZHENG Zhao1,FU Ya-li1,WEI Fu-lan2.(1.Dept.of Orthodontics,Stomatological Hospital of Tianjin Medical University,Tianjin300070,China;2.Dept.of Orthodontics,School of Stomatology,Shandong University,Jinan250012,China)
ObjectiveTo examine the expression of Osterix(Osx)mRNA and protein after application ofmechanical force on human periodontal ligament cells(HPDLCs),and to investigate the role of Osx in orthodontic alveolar bone remodeling.MethodsHPDLCs were isolated and culturedin vitrowith explant method.Approximately 2.5×105cells were seeded onto six-well cell culture plates and then were exposed to centrifugal force for 1,2,4,6,8 or 12 h at 631 r·min-1.The expression of Osx mRNA and protein was measured by reverse transcription-polymerase chain raction(RT-PCR)and Western blot respectively.Immunofluorescence assay was used to detect the expression and subcellular localization of Osx protein by green fluorescence.Results At the initial time point,OsxmRNA had a weak expression and protein was not detected.Under the mechanical stimulation,both mRNA and protein levels of Osx were upregulated in a time-dependent manner.Furthermore,Osx protein was translocated gradually from the cytosol into the cell nuclei.ConclusionThe expression and activation of Osx were enhanced by mechanical stress in HPDLCs, which indicates that Osx may play an important role in HPDLCs osteogenic differentiation and periodontal tissue remodeling induced by mechanical stress.
human periodontal ligament cells;mechanical stimulation;osteogenic differentiation;bone remodeling
Q 786
A
10.3969/j.issn.1000-1182.2010.02.025
1000-1182(2010)02-0214-05
2009-07-23;
2010-01-29
天津医科大学科学基金资助项目(2008ky09)
赵艳红(1979—),女,山东人,讲师,博士
王春玲,Tel:0531-88382070
·病例报告·

