不同酪蛋白添加水平对湖羊肠系膜排流组织、门静脉排流组织中游离氨基酸和肽结合氨基酸净流量的影响
孙龙生 王春梅,2 赵国琦* 吴 敏 王雅倩栗文钰
(1.扬州大学动物科学与技术学院,扬州 225009;2.徐州生物工程高等职业学校,徐州 221006)
对反刍动物来说,肽吸收具有重要的生理意义。反刍动物对肽和氨基酸的吸收存在2种途径,即肠系膜系统和非肠系膜系统,且非肠系膜系统是反刍动物肽吸收的主要途径,其中瘤胃和瓣胃是肽吸收的主要部位[1]。但也有研究认为,小肠吸收的肽可能是门静脉排流组织(portal-d rained viscera, PDV)中肽的主要来源[2]。一般认为,二肽、三肽被吸收摄入肠细胞后,再被肠细胞中的肽酶水解,主要以游离氨基酸(free am ino acid,FAA)的形式进入血液循环。近年来的研究发现,循环中肽量的变化与底物中某些肽的完整吸收有关,蛋白质降解产生的一些肽可以被动物完整吸收[3]。乐国伟等[4]也证实,动物的消化道能以完整形式吸收肽进入血液循环,肠壁具有利用FAA合成肽的能力。多数研究者提出,循环中肽的重要来源可能是食物中的肽。目前,人们重点研究了反刍动物瘤胃内小肽吸收的情况[5-6]。王玲等[7]通过从十二指肠直接灌注大豆小肽,研究其对小肠中肽的吸收与利用的影响,认为小肠中肽含量的增加可以促进其在小肠的吸收。有关饲粮蛋白质在反刍动物体内的代谢过程与利用规律一直是研究的重点[8],特别是有关湖羊血浆中FAA和肽结合氨基酸(peptide-bound am ino acid, PAA)释放量与饲粮蛋白质水平之间的关系,目前尚未见报道。本试验主要研究饲粮中不同酪蛋白添加水平对湖羊血浆中FAA和PAA的释放量以及肠系膜排流组织(mesenteric-d rained viscera, MDV)和PDV中FAA与PAA净流量的影响,为小肽营养理论提供参考依据。
1 材料和方法
1.1 试验动物
选取3只体况良好的成年空怀母湖羊,体重(35±3)kg,安装肠系膜静脉插管(共2根,分别用于灌注和采血)、门静脉插管和颈动脉插管。
1.2 试验饲粮与饲养管理
基础饲粮组成及营养水平见表1,按粗精比7∶3配制。A组饲喂基础饲粮,较高水平的蛋白质饲粮由酪蛋白调节(食用级干酪素,粗蛋白质92.03%),酪蛋白添加量分别为3.0%(B组)、6.0%(C组)、9.0%(D组)。4组饲粮蛋白质水平分别为8.4%、11.2%、14.0%、16.8%。试验羊单笼饲养,按体重的2.5%给料(干物质),于每日08:00和18:00 2次等量饲喂,自由饮水。
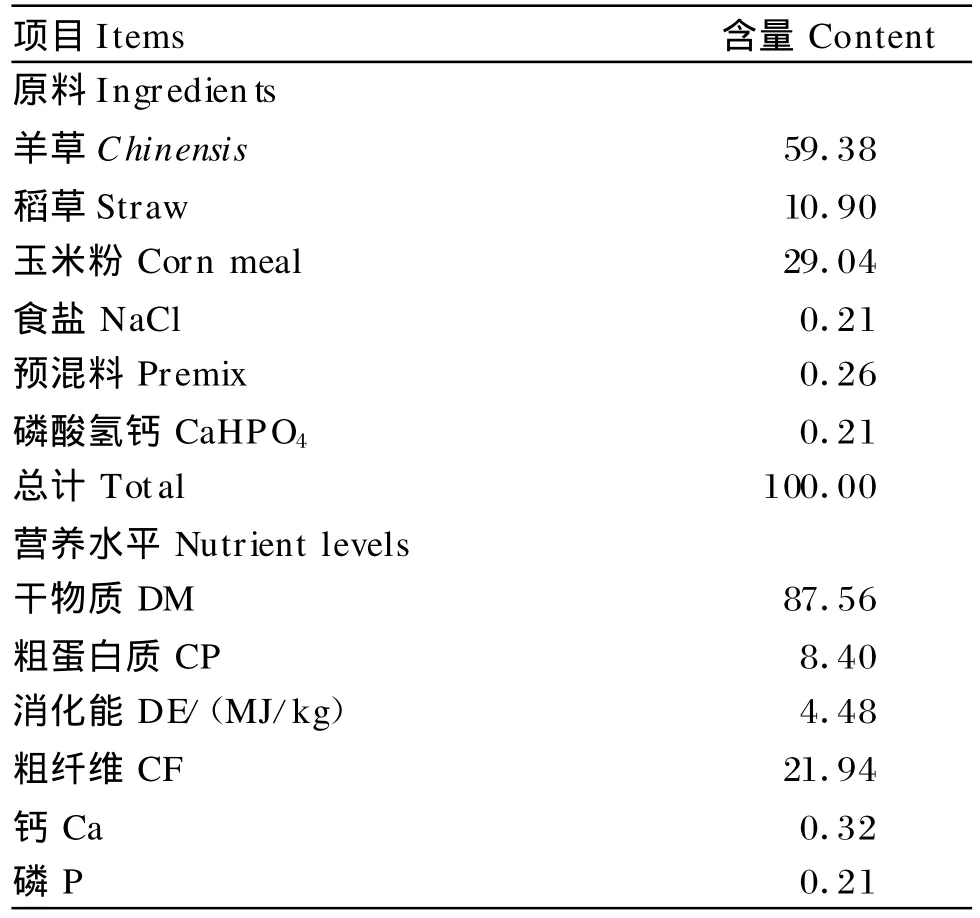
表1 基础饲粮组成和营养水平(风干基础)Tab le 1 Com position and nutrient levels of basal diet (air-dry basis)%
1.3 试验设计
4种不同蛋白质水平饲粮和3只湖羊按4×3不完全拉丁方设计进行试验,试验共分4期,每期分别饲喂不同饲粮。试验预试期12 d,采样期1 d。
1.4 试验方案
从第13天早晨06:00开始向肠系膜静脉持续灌注对氨基-马尿酸(p-amino hippuric acid, PAH)配制液。PAH的配制参考Huntington等[9]的方法进行,即用灭菌生理盐水将PAH配制成15 mg/m L的工作液,并用NaOH或HC l调pH至7.0。灌注时,先灌注15 m L基本剂量的PAH,然后以PAH 12 mg/min(即0.8 m L/m in)的流速由肠系膜静脉持续灌注7 h。PAH灌注2 h后每隔1 h分别同时从每只羊的门静脉、肠系膜静脉(另1根)、颈动脉血管中各采血2 m L,连续采5次,用于PAH的测定。在08:00(喂前)、10:00、12:00、14:00、16:00同时采集门静脉、肠系膜静脉和颈动脉血液,各取8m L血样于肝素化的试管中,摇匀, 30 m in内于4℃以5 000×g离心15 min。上清液置于-20℃保存待测。
1.5 样品的处理与分析
1.5.1 样品预处理
取2 m L血浆加入2 m L 10%三氯乙酸, 2 000×g离心20 m in,除去血浆中的蛋白质。
1.5.2 FAA的测定
参照Rubio[10]介绍的方法。将去蛋白质的血浆过0.22μm滤膜。取100μL滤液真空干燥后加入50μL干燥剂(甲醇∶水∶三乙胺=2∶1∶1),真空干燥后,再加入50μL衍生剂(甲醇∶水∶三乙胺∶异硫氰酸苯酯=7∶1∶1∶1),衍生15m in,再次真空干燥,然后加入0.5 m L稀释剂(10%磷酸∶乙腈=95∶5)稀释,超声波震荡溶解后上机测定。
1.5.3 总氨基酸的测定
取过滤膜的无蛋白质血浆2 m L,加入浓盐酸2m L于水解管中,抽真空后110℃水解23 h,冷却后定容至10 m L,取部分滤液过0.22μm滤膜。其他处理方法同FAA的测定。
1.5.4 PAA的计算
PAA的测算公式:样品PAA含量=样品酸解后总氨基酸含量-样品酸解前总FAA含量
1.5.5 色谱条件
色谱柱:Lichrospher C18分析柱(4.6 mm× 250mm,5μm),柱箱温度:46℃,紫外检测器波长: 254 nm。
1.5.6 PAH的分析测定
参照甄玉国等[11]介绍的方法。
1.5.7 门静脉和肠系膜静脉血浆流速、MDV和PDV中FAA或PAA流量的测定与计算
参照王岗[12]和Backwell等[13]介绍的方法:
1)门静脉和肠系膜静脉血浆流速
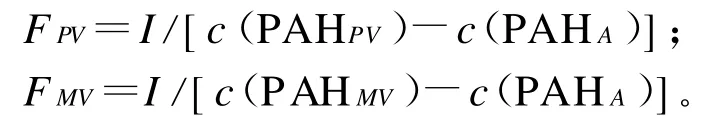
式中:I为肠系膜静脉PAH灌注速度(m g/m in),c(PAHPV)、c(PAHMV)、c(PAHA)分别为PAH在门静脉、肠系膜静脉和颈动脉血浆中的浓度(m g/L),FPV、FMV分别为门静脉、肠系膜静脉的血浆流速(L/m in)。
2)MDV和PDV中FAA或PAA的流量
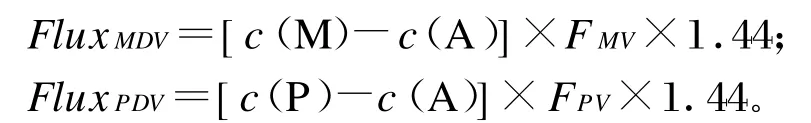
式中:c(M)、c(P)、c(A)分别为FAA或PAA在肠系膜静脉、门静脉和颈动脉血浆中的浓度(mg/L),FMV、FPV分别为FAA或PAA在肠系膜静脉和门静脉的血浆流速(L/m in),1.44为血氧饱和度。
1.6 统计分析
试验数据用Excel整理,运用SPSS 12.0统计软件GLM模块进行显著性检验,多重比较采用Duncan氏法。试验数据表示为平均数±标准差(¯χ±SD)。
2 结果与分析
2.1 饲粮酪蛋白添加水平对血浆FAA和PAA浓度的影响
不同蛋白质水平饲粮下湖羊血浆FAA、PAA浓度的测定结果见表2。由表2可知,4种蛋白质水平饲粮下,肠系膜静脉血浆中,D组FAA浓度最高,A组最低,D组显著高于A组(P<0.05)。血浆中PAA浓度较FAA浓度的2倍还高,说明在反刍动物消化道对营养物质的吸收中,以肽形式吸收入血液的比例很高。组间比较表明,血浆中PAA浓度A组最低,C、D组显著高于A组(P<0.05)。
门静脉血浆中,FAA浓度以D组最高,A组最低,D组显著高于A组(P<0.05)。组间PAA浓度比较结果显示,C、D组显著高于A组(P<0.05)。
颈动脉血浆中,不同处理FAA浓度差异不显著(P>0.05)。PAA的浓度随着蛋白质水平的升高而升高,且D组显著高于A组(P<0.05)。

表2 饲粮酪蛋白添加水平对湖羊血浆FAA、PAA浓度的影响Table 2 Effects of dietary casein supplemen tal levels on concen trations of FAA and PAA in plasm a of Hu sheep mg/100 m L
2.2 饲粮酪蛋白添加水平对湖羊MDV、PDV中FAA和PAA净流量的影响
湖羊门静脉、肠系膜静脉血浆流速及MDV、PDV中FAA和PAA净流量的测定结果见表3。由表3可知,随饲粮蛋白质水平的升高,湖羊肠系膜静脉和门静脉血浆流速显著增加。肠系膜静脉中, C、D组血浆流速较高,A组最低,C、D组极显著高于A组(P<0.01),B组显著高于A组(P<0.05)。门静脉血浆流速也是以C、D组较高,A组最低,C、D组显著高于A组(P<0.05)。
由表3可见,饲粮蛋白质水平对湖羊MDV和 PDV中FAA和PAA净流量有显著影响。随饲粮酪蛋白添加水平增加,从肠系膜系统中吸收的FAA相应增加,D组极显著高于A组(P<0.01),显著高于B组(P<0.05),C组显著高于A组(P<0.05);以肽形式吸收的氨基酸以C组最高,并显著高于A、B组(P<0.05),C组与D组间差异不显著(P>0.05)。PDV中FAA净流量以C组最高,极显著高于A组(P<0.01),与B、D组差异显著(P<0.05)。PDV中存在明显的PAA净流量,C、D组极显著高于A组(P<0.01),显著高于B组(P<0.05)。

表3 饲粮酪蛋白添加水平对湖羊门静脉、肠系膜静脉血浆流速及MDV、PDV中FAA和PAA净流量的影响Table 3 Effects o f dietary casein supplemental levels on plasm a flows in portal andm esenteric vein as well as the net flux of FAA and PAA in MDV and PDV of Hu sheep
3 讨 论
3.1 饲粮蛋白质水平对湖羊血浆FAA、PAA浓度及血浆流速的影响
在动物体内,小肽与FAA 2种吸收机制对氨基酸吸收的贡献大小,取决于胃肠道蛋白质消化过程中释放的肽与FAA的数量及比例[14]。在反刍动物营养中,血浆FAA的探讨对湖羊氨基酸营养需要和利用的研究具有重要作用。本试验中,在一定范围内,随饲粮酪蛋白添加水平的提高,肠系膜静脉和门静脉血浆中FAA浓度显著增加,但饲粮蛋白质水平较高时,血浆FAA浓度增加趋缓,这是动物机体通过对氨基酸代谢的调节,以保持血液内环境的相对稳定。Y ang等[15]认为,一般情况下,反刍动物血浆FAA保持恒定,只有当饲粮中氨基酸水平超过动物最大生长需要时,血浆FAA水平才会增加。也有认为,高的血浆FAA水平或许是由于饲粮蛋白质过量或体蛋白质的大量分解所致。本试验结果表明,随着饲粮蛋白质水平的提高,肠系膜静脉和门静脉PAA浓度呈增加趋势,并且远远高于FAA浓度。这不仅表明湖羊血浆PAA浓度与饲粮蛋白质水平密切相关,同时也提示PAA可能是反刍动物消化道吸收的主要方式。Zhang等[16]比较了大豆小肽与FAA对山羊的利用情况,结果表明,大豆小肽在改善氮平衡状况、提高蛋白质生物学价值及养分的消化率等方面均优于FAA。本试验中,无论是肠系膜静脉还是门静脉,其总氨基酸中PAA所占比例比相关报道要高[17],可能与试验所选蛋白质种类不同有关。
血浆流速能反映动物的代谢状况,饲粮营养水平往往影响动物的代谢水平与强度。本试验结果表明,湖羊肠系膜静脉和门静脉血浆流速随饲粮蛋白质水平的升高而显著增加。这就解释了饲粮蛋白质水平较高时,血浆氨基酸水平能保持相对恒定的现象。王玲等[7]在比较经十二指肠灌注大豆小肽和FAA时发现,大豆小肽有提高肠系膜静脉和门静脉血浆流量的趋势。甄玉国等[11]的研究结果表明,小肠可吸收氨基酸模式对绒山羊血液流速没有影响。这进一步表明,动物机体代谢强度与饲粮营养水平特别是蛋白质水平间存在动态调节与平衡机制。
3.2 饲粮蛋白质水平对湖羊MDV、PDV中FAA和PAA净流量的影响
反刍动物MDV、PDV中FAA和PAA的净流量能够反映饲料蛋白质经消化道消化后其FAA与小肽的吸收与分布情况。王岗[13]研究发现,从肠系膜系统中吸收的FAA较多,而从非肠系膜系统吸收的PAA较多,表明非肠系膜系统是反刍动物肽吸收的主要途径。王玲等[17]研究了经十二指肠灌注不同水平大豆小肽后,奶山羊MDV总FAA和PAA的净流量,结果表明,2种净吸收进入肠系膜静脉的氨基酸流量均随大豆小肽灌注水平的提高而显著提高,进一步证实了小肠是机体小肽吸收的另一贡献者。本试验得到了类似的结果,饲粮蛋白质水平对MDV和PDV中PAA净流量有显著影响,并且随饲粮蛋白质水平升高,湖羊PDV和MDV中FAA和PAA净流量显著增加,特别是PDV存在明显的PAA净流量。当饲粮蛋白质达到较高水平时,PDV和MDV中PAA净流量并不随饲粮蛋白质水平的增加而增大,原因可能与动物为保持血液内环境相对稳衡而进行的代谢性调节有关,也可能与饲粮酪蛋白的添加水平过高有关。李海燕等[5]研究了瘤胃灌注不同水平酪蛋白后瘤胃蛋白质代谢的变化,结果发现,60 g/d灌注的羊其瘤胃微生物蛋白质产量并不比50 g/d灌注的羊高。Seal等[18]在阉牛、绵羊和大鼠门静脉内没有发现肽的净流量。Seal等[19]研究后认为,小肽基本上不影响反刍动物门静脉的血氨浓度。Backwell等[13]研究也发现,连续饲喂条件下,绵羊动脉、门静脉和肠系膜血液中肽的浓度非常接近,消化道对肽没有明显的净吸收利用。实际上,影响动物对蛋白质消化、吸收的因素,如饲粮蛋白质水平与品质、不同蛋白质饲料与投喂方式、肽的氨基酸组成与结构等,都会对肽的净流量产生影响。由于反刍动物肽吸收的主要器官是瘤胃和瓣胃,即非肠系膜系统,MDV肽的吸收只是其有益补充,所以,就MDV和PDV中PAA和FAA净流量而言,小肠中肽浓度的增加对MDV的影响大于对PDV的影响。本试验初步探讨了饲粮蛋白质水平与湖羊体内肽和氨基酸吸收周转情况的关系,在小肽种类及吸收机制与效率方面还需做深入研究。
4 小 结
①湖羊肠系膜静脉和门静脉血浆中FAA和PAA浓度随饲粮蛋白质水平的增加而升高,并且PAA浓度高于FAA浓度,表明在反刍动物蛋白质吸收中,以小肽形式的吸收占有重要地位。
②饲粮蛋白质水平对MDV和PDV中FAA和PAA净流量有显著影响。较高的蛋白质水平饲粮下,MDV和PDV中FAA和PAA净流量也较高,特别是PDV中存在明显的PAA净流量。
[1] W EBB JK E,D IRIENZO D B,MATTHEWS JC. Recent developments in gastrointestinal absorption and tissue utilization o f pep tides:a review[J].Journalof Dairy Science,1993,76(1):351-361.
[2] RÉMOND D,BERNARD L,PONCET C.Free and peptide am ino acid net f lux across the rumen and the mesenteric-and portal-drained viscera o f sheep[J]. Journal of Animal Science,2000,78(7):1960-1972.
[3] KOELN L L,SCHLAGHECK T G,W EBB JK E. Am ino acid f lux across the gastrointestinal tract and liver of calves[J].Journal of Dairy Science,1993, 76(8):2275-2285.
[4] 乐国伟,施用晖,胡祖禹,等.小肽与游离氨基酸对雏鸡血液循环中肽的影响[J].畜牧兽医学报,1997,28 (6):481-488.
[5] 李海燕,徐凤霞,王中华.酪蛋白灌注水平对瘤胃蛋白质代谢的影响的研究[J].山东农业大学学报:自然科学版,2008,39(3):345-349.
[6] 欧宇,李胜利,陈萍.不同蛋白质饲料对瘤胃内小肽浓度的影响[J].畜牧兽医学报,2006,37(3):257-261. [7] 王玲,刘辉,李胜利,等.十二指肠灌注大豆小肽和氨基酸对奶山羊小肠吸收的影响[J].动物营养学报, 2010,22(2):318-326.
[8] SCHROEDER G F,TITGEMEYER E C,AW AWDEH M S,et al.Effects of energy level on m ethionine utilization by growing steers[J].Journal of Animal Science,2006,84(6):1497-1504.
[9] HUNTINGTON G B,REYNOLDS C K,STROUD B H.Techniques for measuring b lood flow in sp lanchnic tissues o f cattle[J].Journal o f Animal Science,1989,72(6):1583-1595.
[10] RUBIO L A.Determ ination o f diam inopimelic acid in rat feces by high performance liquid chromatography using the Pico Tag method[J].Journal o f Chromatography B,2003,784(1):125-129.
[11] 甄玉国,卢德勋,王洪荣,等.内蒙古白绒山羊小肠可吸收氨基酸模式对MDV和PDV组织游离氨基酸代谢影响的研究[J].畜牧兽医学报,2005,36(4):337-342.
[12] 王岗.绵羊小肠寡肽吸收规律的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2001:57-69.
[13] BACKW ELL F R,H IPOLITO-REIS M,WILSON D,et al.Quantification of circulating peptides and assessmen to f peptide up take across thegastrointestinal tract o f sheep[J].Journal o f Animal Science, 1997,75(12):3315-3322.
[14] CAM PBELL C G,TITGEMEYER E C,ST-JEAN G.Sulfur am ino acid utilization by growing steers [J].Journal of Anim al Science,1997,75(1): 230-238.
[15] YANG C M,RUSSELL JB.Resistance of p rolinecontaining pep tides to rum inal degradationin vitro[J].Applied and Environmental M icrobiology, 1992,58(12):3954-3958.
[16] ZHANG B,XUE L Q,LI L L,et al.Effects of soybean small pep tides on nitrogen balance,nutrient digestibility and several indices in the portal veinous p lasma o f goats[J].Small Rum inant Research, 2007,72:1-10.
[17] 王玲,刘辉,李胜利,等.十二指肠灌注不同水平大豆小肽对奶山羊小肠小肽吸收的影响[J].畜牧兽医学报,2010,41(4):425-433.
[18] SEAL C J,PARKER D S.Iso lation and characterization of c irculating low mo lecular weigh t pep tides in steer,sheep,and rat portal and peripheral blood [J].Comparative Biochem istry and Physio logy B, 1991,99(3):679-685.
[19] SEAL C J,PARKER D S.Effect o f intrarum inal propionic acid infusion on metabolism of mesenteric and portal-drained viscera in growing steers fed a forage diet:ammonia,urea,am ino acids,and peptides[J].Journal of Anim al Science,1996,74(1): 245-256.
*Correspond ing au thor,p rofessor,E-m ail:jszhaoguoqi@hotmail.com
(编辑 尚彬如)

