基于SPR生物传感器的抗生素残留检测及影响因素分析
石 婷,刘 瑾,张婉洁,苏 洋,张增福,徐可欣
(天津大学精密测试技术及仪器国家重点实验室,天津 300072)
抗生素是一种杀菌、消毒和抗炎症的药物,广泛应用于许多疾病的治疗.若抗生素残留在牛奶中,长期食用就会导致人体对抗生素的免疫,对健康不利,也可能引起对抗生素过敏的人产生过敏反应.目前鲜奶中抗生素残留的检测方法大致分为 3类[1-2]:生物测定法(微生物测定法和放射受体测定法等)、理化分析法(波谱法和色谱及联用技术等)、免疫法(放射免疫法、荧光免疫法和酶联免疫法等).但这些方法都有各自的缺点,如耗时长、检测程序复杂、费用高等.微生物受阻法则必须经过几小时甚至数十小时的培养过程才能观察到结果;色谱检测法操作过程虽然简便,但前处理耗时耗力;微生物检测法则需要培养细菌,制备培养基和抗生素标准残留奶样,准备过程比较复杂;酶联免疫法检测精度高,但是其耗材为一次性的,且成本很高.因此,牛奶中抗生素残留的检测领域一直受制于检测技术的发展,不能实现真正的强制性检测,在与发达国家的贸易中也屡遭禁止.
笔者主要研究和发展一种新型的基于表面等离子体的光学生物传感技术,用于抗生素残留快速检出.该检测法较上述几种方法有明显的优点:①检测时间短,20,min即可分析1个样品;②操作简便;③表面等离子体共振(surface plasmon resonance,SPR)检测法敏感性高,准确度高.青霉素 G的检测限为1~2,μg/kg,其他青霉素类药物的检测限也低于欧盟规定的标准[3],低于色谱检测限 3~5 μg/kg和微生物受阻检测法的检测限[4].
2001年 Gaudin V等[5]首次开展了利用 SPR生物传感器和免疫测定原理进行牛奶中的氯霉素和青霉素的检测研究.2002年瑞典大学农学院的Gustavsson等[6-7]也报道了利用SPR方法检测牛奶中的β-内酰胺类抗生素含量,并且对青霉素 G的检测极限达到了 1~2,μg/kg,远低于欧盟对青霉素 G 的最低检出量(maximum residue limit,MRL)(4,μg/kg)的要求.但是他们采用的是DD-carboxypeptidase酶与 β-内酰胺类抗生素的相互作用以及 β-内酰胺类抗生素与其相应抗体的相互作用,该方法首先需要DD-carboxypeptidase酶与 3-羧胺酸在 47,℃下进行 5,min的孵化形成结合物后才能使用,在检测过程中一般保持37,℃,且用到的试剂也比较多:penicillin G抗体、3-羧胺酸、3-羧胺酸抗体或者 2-羧胺酸抗体,至少需要 2种抗体,且为间接检测,通过检测 3-羧胺酸或者 2-羧胺酸间接获得penicillin G的含量.因此,该方法测试环节比较繁琐,外界条件要求高,不适于应用场合.德国的 Wuppertal大学的食品化学系[8],研究了采用青霉素绑定蛋白2x*(penicillium-binding protein 2x*,PBP 2x*)进行抗生素的测量.他们利用了 digoxigeninlabelled ampicillin(DIG-AMPI)与 PBP 2x*之间的绑定作用,这种方法是非特异性的绑定,采用涂抹 PBP 2x*的SPR传感器,除了可以检测到DIG-AMPI 外,还检测到了脱脂牛奶中的 benzylpenicillin、ampicillin、amoxicillin、cloxacillin、cephalexin 和 cefoperazone.现阶段,所有这些研究小组都是采用了BIAcore仪器.
综上所述,利用 SPR生物传感器进行抗生素残留的免疫测定方法已经得到了很好的实验验证,检测精度相对其他抗生素检测方法是非常高的,但同时也存在以下不足:①检测方法繁琐,有待于改进和发展,需要发展一种相对适用性较强、可推广的检测方法;②国外这些研究机构均采用 Pharmacia公司生产的BIAcore仪器,但 BIAcore仪器的价格非常高,采用现成的CM5芯片,成本太高不利于此项技术的推广,笔者采用 SPR传感器进行系统集成,以求突破受制于BIAcore仪器的现状;③现有的研究成果大多是研究可以检测到哪种抗生素,以及可以达到的检测极限精度,对实验条件、影响抗原抗体的特异性反应的各种因素的讨论相对较少,研究不够全面和深入.因此,发展一种流程简单、检测效率高、成本低的检测方法是将 SPR检测技术向抗生素残留检测领域的应用推进的必然趋势.
笔者提出了一种基于抗原抗体相互作用原理的SPR检测抗生素的新方法,该方法检测流程相对简单,对 SPR传感器预处理后,可以进行反复多次测量,且传感器的制备成本非常低,利于该方法的推广和应用.为此研究了基于 SPR传感器金膜的分子固定技术,将用于检测的抗生素抗体固定到金膜表面,制成对某种抗生素有特异性吸附作用的生物传感器,摆脱了对BIAcore公司的芯片的制约,实现了传感器的自制备.通过抗生素与相应抗体之间的相互作用原理,实现了抗生素的直接测量.并针对兽药中常用的氨苄青霉素进行了实验研究,采用氨苄青霉素单克隆抗体固定到传感器金膜表面,获得该传感器的工作曲线及最低检出限.最后,探讨了实验条件对测量方法的影响,考察流速、温度、pH 值及离子浓度对测量的影响,以期获得最佳的测量条件,对该方法的使用和推广具有很好的指导意义.
1 实验原理
1.1 表面等离子体共振技术用于生物分子相互作用分析
SPR是电磁波所激励的在金属和电介质交界面上形成的影响电磁波传播的谐振波,是一种光学现象,一种消逝波.表面等离子体共振技术是 19世纪70年代开始逐渐发展起来的一项新型的测量测试技术.利用 SPR制成的生物传感器进一步利用了生物分子相互作用分析(bio-molecular interaction analysis,BIA)这一原理.BIA 现象的本质是,产生表面等离子共振现象时的光入射角称为 SPR角,SPR角随金膜表面折射率的变化而变化,而折射率的变化又与金膜表面结合的分子质量成正比.SPR 生物传感器正是基于 BIA这一原理,将探针或配体固定于传感器芯片镀着的金膜表面,含分析物的液体流过传感片表面,分子间发生特异性结合时可引起传感片表面折射率改变,通过检测 SPR信号改变而监测分子间的相互作用.在分子作用过程中,靶物质可以天然状态存在于分析物中,在自然条件下进行分析,因此保证了所得结果的真实性.因此,该技术具有实时、免标记、无需事先纯化地定量检测生物分子和监测两种或多种分子间的结合的优点.
1.2 传感器表面的分子自组装分子层的建立
采用免疫技术对传感器进行化学处理,将其制作成对抗生素有特异性吸附作用的生物传感器,将抗体固定在传感器表面.目前抗体在传感器表面的固定方法主要包括:氨基偶联法、巯基偶联法、醛基偶联法、组氨酸-镍螯合法及亲和吸附法等.在实验中采用常用的方法,即氨基偶联法,其原理为羧甲基化葡聚糖表面羧基与蛋白质的氨基通过化学交联反应,将抗体通过形成共价键的形式固定在金膜表面.具体流程如图1所示,在金膜表面形成BSA蛋白质层;再通过 EDC/NHS的混合液活化羧化的 BSA蛋白质层,形成有活性的 NHS酯蛋白层;抗体通过与活化的NHS酯蛋白层发生反应,通过氨基形成共价键连接;最后用乙醇胺封闭没有反应的活化NHS酯蛋白层.该化学处理过程中金膜表面的微观分子变化如图2所示.
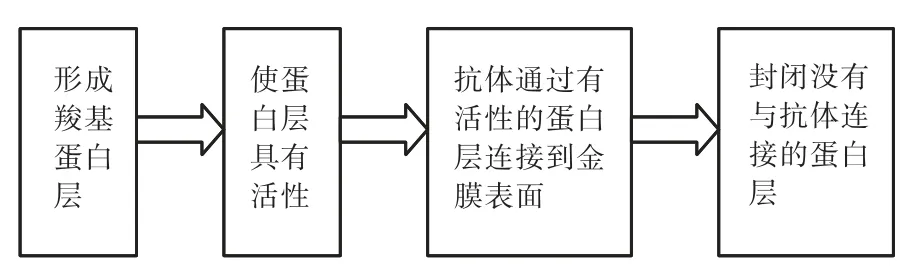
图1 传感器表面分子自组装分子层的建立流程Fig.1 Establishment of molecular self-assembly molecular film on sensor surface

图2 传感器金膜表面结构示意Fig.2 Schematic diagram of gold film sensor surface
2 实验与结果
2.1 仪器装置与试剂
2.1.1 仪器装置
采用的实验系统如图 3所示.微量注射泵(Kd Scientific Inc.)能够自动控制注射器来恒速注射液体,Spreeta表面等离子体共振测量系统(TI 美国德州仪器公司)用来监测流过传感器金膜表面的液体折射率的变化[9],六通道选择阀(Upchurch公司)可以进行不同试剂间的选择切换,根据需要向传感器选择注入不同试剂.
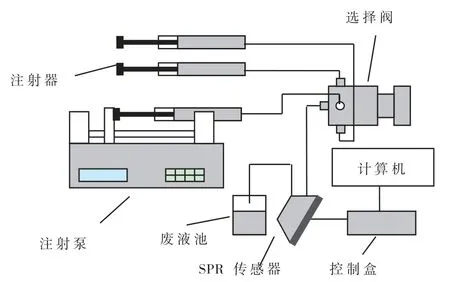
图3 表面等离子体共振测量实验装置示意Fig.3 Schematic diagram of SPR measurement equipment
2.1.2 试剂
磷酸盐缓冲液(PBS),10,mmol/L,pH7.4;牛血清白蛋白(BSA),美国 Amresco 公司生产;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC.HCL),上海延长生化有限公司生产;N-羟基琥珀酰亚胺(NHS)上海延长生化有限公司生产;丁二酸酐(succinic anhydride),美国 Amresco 公司生产;二甲亚砜(DMSO),美国 Amresco 公司生产;大鼠单克隆抗氨苄青霉素抗体(mouse mono-clonal antibody antiampicillin,McAb),美国 USBiological 公司生产;乙醇胺(ethanolamine hydrochloride),美国 Sigma-Aldrich公司生产;氨苄青霉素(ampicillin),生物分子级,德国SERVA公司生产.实验中用到所有的试剂均为分析纯,水为去离子水.
2.2 SPR生物传感器的制备
预处理过程:在金膜表面修饰一层用 EDC/NHS活化的 BSA,混合溶液中各溶液的体积比为 VBSA∶VEDC∶VNHS=5∶2∶2(室温下保持 15,min),形成均匀的交叉连接的蛋白层;再利用磷酸二氢钠盐和DMSO配置的丁二琥珀酸酐溶液(pH为 6.5)浸泡蛋白质层(室温下保持 12,h),使蛋白质层羧化,成为金膜和抗体的连接纽带.
抗体的固定过程:调节液体流速为 10,μL/min,向传感器内通入 PBS溶液,待基线稳定后通入 EDC/NHS(体积比为 1∶1)5~10,min,活化羧化的 BSA 蛋白质层,形成有活性的 NHS酯蛋白层,通入 PBS缓冲液冲洗,待基线稳定后再通入McAb10,min,McAb通过与活化的蛋白层发生反应,通过氨基形成共价键连接,为了封住未反应的活化羧基官能团,通入1,mol/L乙醇胺溶液,封闭没有反应的活化NHS酯蛋白层.
图 4显示了抗氨苄青霉素抗体在传感器金膜表面固定时折射率的变化,通入抗体前后的折射率变化为 2,224×10-6,说明抗体已固定在金膜表面,折射率变化为 1,相当于 1,pg/mm2的量[10],以此计算表面抗体的覆盖量为2.2,ng/mm2.

图4 单克隆抗氨苄青霉素抗体固定时典型的折射率的变化Fig.4 Typical binding refractive index of antiampicillin McAb
2.3 抗生素水溶液测量实验
实验过程中,测量基线去离子水的折射率标准差约为15×10-6,因此传感器金膜表面的响应,即所测溶液的折射率变化值应大于3倍的基线标准差 45×10-6,才能作为可信测量值.
首先配置含氨苄青霉素质量浓度为 2,000,ng/mL的水样品待用,再分别取一定量的所配样品并将其按比例分别稀释为 1.25,ng/mL、2.5,ng/mL、5,ng/mL 的水样品待测.测量时(流速 10,μL/min)先通入纯水样品,稳定后通入一种质量浓度的氨苄青霉素水样品,测量结果为两种样品折射率的差值,再通入氢氧化钠进行表面重建(流速为 20,μL/min),以便进行下次测量.每种质量浓度的测量都重复上述过程.
图 5是 3种质量浓度氨苄青霉素水溶液通入传感器后的折射率的变化曲线,而表1是通入前后的折射率差值.从图 5中可以看出,不同质量浓度的氨苄青霉素水样品达到动态平衡后有很好的区分(每次测量的纯水的折射率都修正到 1.333 000),并且随着浓度的增大,折射率也增大,存在正比关系.1.25,ng/mL的折射率差值为 80×10-6左右,大于 45×10-6,认为是可信测量,因此,该方法的检出限低于1.25,ng/mL.该方法的检出限远远低于欧盟规定的最大残留限量(4,μg/kg)[3],也是其他方法不能比拟的.

图5 不同质量浓度的氨苄青霉素水溶液的折射率比较Fig.5 Comparison of different concentrations of ampicillin Fig.5 solution

表1 通入氨苄青霉素水溶液后的折射率Tab.1 Refractive index at different ampicillin solution
图 6建立的是不同质量浓度的氨苄青霉素水样折射率的模型曲线.整体工作曲线呈单调上升,且在低质量浓度段,线性关系较好;而到了高质量浓度段,曲线上升减弱.测量未知样品时,先测量未知浓度样品与纯水的折射率差值,带入到工作曲线中对应的横坐标即为待测样品的质量浓度.
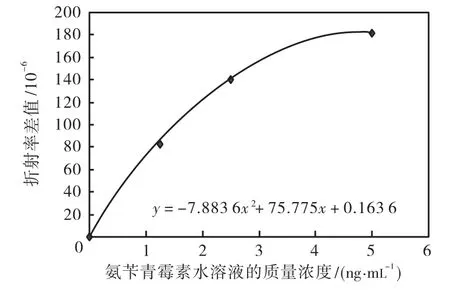
图6 氨苄青霉素水溶液折射率模型曲线Fig.6 Refractive index model curve of ampicillin solution
3 测量条件的影响研究
3.1 进样流速对氨苄青霉素在抗体表面吸附的影响
在表面等离子体共振测量控制系统中,氨苄青霉素在大鼠单克隆抗体表面吸附过程(宏观动力学过程)包括两个连续的步骤,即本体溶液中的氨苄青霉素传输到传感片表面(传质过程)及其与芯片表面大鼠单克隆抗体的吸附作用(本征吸附动力学)过程[11],即
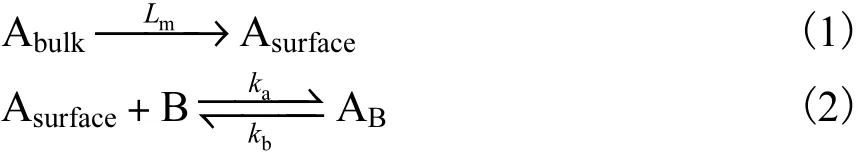
式中:Abulk表示本体溶液中的被吸附物质(氨苄青霉素);Asurface表示到达传感片表面的氨苄青霉素;B表示固定在传感片表面的大鼠单克隆抗体;AB表示吸附于大鼠单克隆抗体的被吸附物质(氨苄青霉素);Lm表示质量传输系数;ka、kb表示动力学常数[12].SPR的折射率表示传感片表面吸附AB的量.在低流速阶段,被吸附物的传质速度慢于吸附作用的速度,即式(1)慢于式(2)时,吸附过程受传质过程控制,折射率的变化速率是由式(1)中的 Lm决定的.一般而言,对特定的被吸附物质而言,其本征吸附动力学常数是一定的,增大流速会加快传质速度,吸附过程经历由传质过程控制→传质速率与本征吸附动力学控制→本征动力学控制的过程.当样品流速过大时,传质速度快于本征吸附动力学速度,吸附过程由本征吸附动力学控制,折射率的变化速率是由式(2)中的平衡常数ka/kb决定.
对 5,ng/mL氨苄青霉素水溶液在 5个不同流速下的折射率进行了比较,结果见图 7.流速与折射率差值的关系见图8.
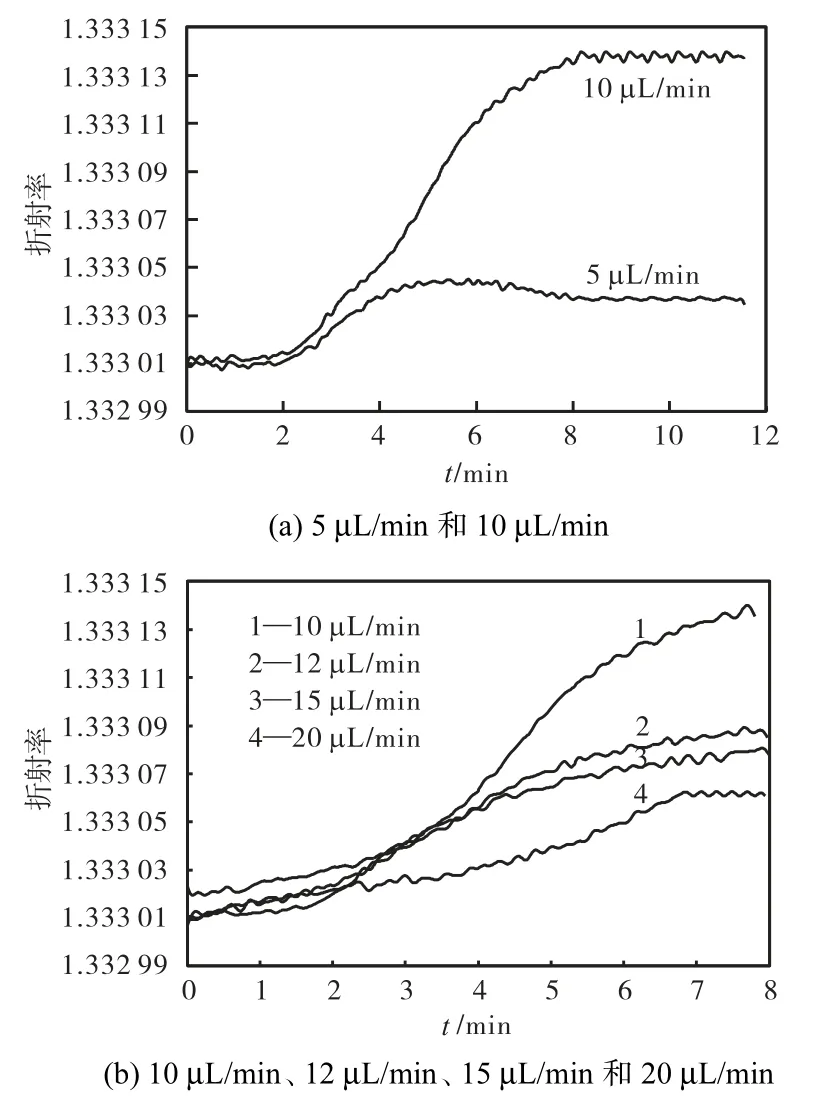
图7 不同流速下5 ng/mL氨苄青霉素水溶液折射率的比较Fig.7 Comparision of refractive index with 5 ng/mL ampicillin solution at different flow velocities

图8 流速与折射率差值的关系曲线Fig.8 Relatlion curve of different flow velocities and refracttive index
图8中的曲线反映了抗体过剩时,流动的氨苄青霉素溶液(抗原)与大鼠单克隆抗体结合反应变化规律.由于反应后的抗原抗体复合物会附着到棱镜金膜表面,因此,折射率的变化将能反映出复合物量的变化.当流速很低时,吸附过程主要受传质过程控制,形成的抗原抗体复合物较少,折射率差值变化较小.随着流速的不断提高,抗原分子数不断增加,形成的抗原抗体复合物也随之增多,折射率差值增大.当流速为 10,μL/min时,折射率差值达到了极值.流速继续增大时,由结合和解离系数控制,折射率差值又逐渐变小.
3.2 温度对氨苄青霉素在抗体表面吸附的影响
抗体抗原反应,受温度的影响较大.在一定范围内,温度升高可促进分子运动,使抗原抗体分子碰撞机会增多,二者的结合反应加速.但温度过高(56,℃以上),可导致抗原抗体变性或遭破坏,补体被灭活,已形成的免疫复合物亦将发生解离.一般实验常在37,℃恒温条件下进行.
图9为5,ng/mL氨苄青霉素水溶液在3个不同温度下的折射率结果.从图 9中可看出,37,℃时折射率最大,25,℃和 50,℃时的折射率都小于 37,℃时的,说明 37,℃是本实验的最适宜温度,折射率达到最大.
3.3 pH值的影响
氨苄青霉素在大鼠单克隆抗体表面的静电吸附量的大小受氨苄青霉素和大鼠单克隆抗体的电荷类型及二者表面电荷密度的影响,两者带相反的静电荷有利于静电吸附的发生.氨苄青霉素带有正电荷有利于氨苄青霉素在抗体表面的静电吸附.当氨苄青霉素溶液 pH 大于其等电点 pI 时,氨苄青霉素表面带有净的负电荷;pH 小于其等电点 pI 时,氨苄青霉素表面带有净的正电荷.传感片表面的大鼠单克隆抗体在pH 值大于3.0 左右时带负电荷,当pH 值小于3.0左右时带正电荷[13-14].因此,当pH > pI 时,氨苄青霉素与大鼠单克隆抗体均带负电荷,不利于两者的静电吸附;当3.0 〈pH 〈 pI 时,氨苄青霉素带正电荷,抗体带负电荷,有利于两者的静电吸附,并且吸附量随着两者电荷密度的增强而增加;当pH 〈 3.0 时,氨苄青霉素与大鼠单克隆抗体均带正电荷,同样不利于两者的静电吸附.另外在低 pH 环境下,蛋白质容易产生变性,失去其天然构象,所以偶联蛋白的 pH值不应低于3.0,并高于蛋白质变性失活的pH.
3.4 离子浓度的影响
抗原与抗体特异结合后,亲水胶体变为憎水胶体.如有适当浓度的电解质存在,可中和其表面电荷,使电势降低,促进二者相互凝聚出现可见的沉淀或凝集现象.若无电解质存在,则不易出现可见反应.但如电解质的浓度过高,则会引起蛋白质非特异性沉淀.此种作用称为盐析,常用于抗体的提纯.在实验中为了不使抗原与抗体特异结合后出现沉淀或凝集现象,用去离子水作为抗原和抗体的稀释剂.
4 结 论
(1)详细考察了利用 SPR生物光学传感器测量牛奶中抗生素的可行性,利用了特异性的氨苄青霉素抗体对金膜表面进行修饰,折射率大大提高,成功地测量了不同质量浓度的氨苄青霉素水溶液折射率,能够分辨最低质量浓度为 1.25,ng/mL的样品;同时根据不同质量浓度样品的折射率不同建立了模型曲线.
(2)当流速很低时,吸附过程主要受传质过程控制,流速增大折射率增大,当增大到一定程度后主要受本征动力学过程控制,即结合和解离系数的控制,流速增大折射率减小;通过实验可知,10,μL/min是一个最佳流速,同种质量浓度的样品此时折射率最大.
(3)温度对氨苄青霉素与抗体的结合也有很大的影响,温度过高可能会使抗原抗体失活,温度过低分子运动不积极结合程度不高. 根据理论与实验研究得出,在 37,℃恒温条件下,分子碰撞机会最多,折射率最大,所以选择此温度为实验时温度.
(4)pH值的选择要根据抗原抗体的等电点不同,使抗原抗体带相反的电荷,这样有利于二者的结合,实验中 pH值选择 7.0左右,反应在中性环境下进行时不会影响抗原抗体的理化性质,并且结合程度最大.
(5)实验中所需溶液全部用去离子水配置以消除离子对抗原抗体反应的影响,且不会出现沉淀或凝集现象.
本文的研究为牛奶中抗生素残留检测奠定了良好的基础.在牛奶中对氨苄青霉素残留实现成功检测后,还可将此检测方法推广到其他抗生素,为探索适合我国的抗生素测量方法提供了可靠的依据,具有广泛的市场前景.
[1]Monteroa A,Althausb R L,Molinac A,et al. Detection of antimicrobial agents by a specific microbiological method(Eclipse 100)for ewe milk[J].Small Ruminant Research,2005,57(2/3):229-237.
[2]Bertram G K,Angelika S,Richard D,et al. Automated microarray system for the simultaneous detection of antibiotics in milk [J].Anal Chem,2004,76(3):646-654.
[3]Gustavsson E. SPR Biosensor Analysis of β-Lactam Antibiotics in Milk [D]. Uppsala:Swedish University of Agricultural Sciences,2003.
[4]李延华,张兰威,王伟君. 国标 TTC法与 AOAC纸片法检测乳中β-内酰胺类抗生素残留对比研究[J]. 中国乳品工业,2006,34(5):57-59.
Li Yanhua,Zhang Lanwei,Wang Weijun. Evaluation of two microbial standards for detecting β-lactams in milk[J].China Dairy Industry,2006,34(5):57-59(in Chinese).
[5]Gaudin V,Fontaine J,Maris P. Screening of penicillin residues in milk by a surface plasmon resonance-based biosensor assay:Comparison of chemical and enzymatic sample pretreatment [J].Anal Chim Acta,2001,436(2):191-198.
[6]Gustavsson E,Bjurling P,Sternesjo A. Biosensor analysis of penicillin G in milk based on the inhibition of carboxypeptidase activity[J].Analytica Chimica Acta,2002,468(1):153-159.
[7]Gustavsson E,Degelean J,Bjurling P,et al. Determination of β-lactams in milk using a surface plasmon resonance-based biosensor [J].J Agric Food Chem,2004,52(10):2791-2796.
[8]Cacciatore G,Petz M,Rachid S,et al. Development of an optical biosensor assay for detection of β-lactam antibiotics in milk using the penicillin-binding protein 2x*[J].Analytica Chimica Acta,2004,520(1/2):105-115.
[9]Alexei N N,Scott D S,Di K N,et al. Detection of Staphylococcus aureus enterotoxin B at femtomolar levels with a miniature integrated two-channel surface plasmon resonance(SPR)sensor [J].Biosensors and Bioelectronics,2002,17(6/7):573-584.
[10]Stenberg E,Persson B,Roos H,et al. Quantitative determination of surface concentration of protein with surface plasmon resonance using radiolabeled proteins[J].J Colloid Interface Sci,1991,43(2):513-526.
[11]崔小强,沙宇芳,杨 帆,等. 应用表面等离子体共振技术在传质控制下检测铁蛋白[J]. 分析化学,2005,33(11):1639-1642.
Cui Xiaoqiang,Sha Yufang,Yang Fan,et al. Detection of ferritin by surface plasmon resonance under mass transport-limited[J].Chinese Journal of Analytical Chemistry,2005,33(11):1639-1642(in Chinese).
[12]Glaser R W. Antigen-antibody binding and mass transport by convection and diffusion to a surface:A twodimensional computer model of binding and dissociation kinetics[J].Analytical Biochemistry,1993,213(1):152-161.
[13]裴仁军,崔小强,杨秀荣,等. 表面等离子体子共振技术实时研究蛋白质在修饰表面的静电吸附行为[J].高等学校化学学报,2001,22(7):1128-1130.
Pei Renjun,Cui Xiaoqiang,Yang Xiurong,et al.Studies on electrostatic adsorption of proteins on modified surface[J].Chemical Research in Chinese Universities,2001,22(7):1128-1130(in Chinese).
[14]Lofas S,Johnsson B. A novel hydrogel matrix on gold surfaces in surface plasmon resonance sensors for fast and efficient covalent immobilization of ligands[J].Journal of the Chemical Society Chemical Communications,1990,21:1526-1528.

