复原胶囊对脓毒症大鼠肾组织HIF-1α表达的影响
毛健,李荣亨
(重庆医科大学附属第一医院中西医结合科,重庆市 400016)
脓毒症是由感染因素造成的全身性炎症反应,其危重患者常发生多器官功能障碍综合征(MODS),肾脏是最常受累的器官之一。目前有学者认同脓毒症是包括微循环障碍的不可控的全身炎症反应[1]。缺氧诱导因子-1α(HIF-1α)是低氧应答过程中起重要作用的转录因子,参与能量代谢、血管生成、细胞凋亡、应激等相关基因的表达调控。研究表明,HIF-1α与缺血缺氧性炎症反应密切相关[2]。笔者研究脓毒症时应用复原胶囊,观察其对模型大鼠肾组织HIF-1α表达的影响,以探讨其对肾脏的保护作用机制。
1 材料
1.1 仪器
BX51T32E01型正立式显微镜(日本Olympus公司);550型酶标仪(美国Bio-med公司);5810R型冷冻离心机(德国Eppendorf公司);22331型梯度PCR仪(德国Eppendorf公司);MDF-U50V型超低温冰箱(日本Sanyo公司);UV-160IPC型紫外-分光光度计、AX200型精密电子天平(日本Kyoto公司);RM2135型切片机(德国Leica公司)。
1.2 试药
复原胶囊(重庆希尔安药业股份有限公司);大鼠IL-6ELISA试剂盒、DEPC、PCR引物(上海Invitrogen公司);SYBR Primer Ex Taq Kit(大连宝生物工程有限公司);4%PFA、依红、苏木紫、PBS粉(北京中杉金桥公司)。
1.3 动物
SD大鼠,♂,体质量200~300 g,第三军医大学大坪医院野战外科研究所动物中心提供(动物合格证号:SYXK(渝)2007-0017)。
2 方法
2.1 模型复制及分组、给药
模型复制参照文献[3]。大鼠麻醉、固定后,沿腹中线作一条长2 cm的切口,分离出盲肠,在回盲瓣下端以1号丝线结扎盲肠。用16号针头在肠系膜对侧盲肠表面上下两端各穿孔1个形成盲肠漏,将盲肠还纳腹腔,逐层缝合腹壁切口。大鼠苏醒后观察其体态及行为,以判断模型的成功与否。术后大鼠予以自由摄食和饮水。假手术组只行腹腔关闭,不做结扎和穿孔。实验分为4组,即假手术、模型及复原胶囊高、低剂量(6.65、3.325 g·kg-1)组。每组分为3、6、12、24 h 4个时相点,每个时相点4只大鼠。ig给药,1天1次,连续给药4 d后复制模型。
2.2 RT-PCR检测肾组织HIF-1α mRNA的表达
按Trizol试剂盒说明提取组织总RNA。HIF-1α:被扩增的 cDNA引物长 200 bp,上游 5′-TGCTTGGTGCTGATTTGTGA-3′,下游 5′-GGTCAGATGATCAGAGTCCA-3′;CyclophilinA作内参:被扩增的cDNA引物长192 bp,上游5′-GCATACAGGTCCTGGCATCT-3′,下 游 5′-TCTTGCTGGTCTTGCCATTC-3′。采用TAKAKA试剂盒一步法。PCR反应条件为94 ℃5 min,1个循环;94 ℃45 s,60 ℃45 s,72 ℃1 min,25个循环;72℃10 min,1个循环。琼脂糖电泳PCR产物,凝胶成像处理系统拍摄图像,记录光密度值。产物含量=HIF-1α扩增产物光密度值/CyclophilinA扩增产物光密度值。
2.3 ELISA检测血清IL-6水平
大鼠心脏取血0.5 μL,室温放置后离心取血清,-20℃贮藏。参照大鼠血清IL-6 ELISA试剂盒说明书进行。
2.4 生化指标检测
大鼠心脏取血0.5 μL,室温放置后离心取血清,检测血清中尿素氮(BUN)指标的变化。
2.5 HE染色病理学观察
取肾组织用4%多聚甲醛固定,PBS浸泡过夜,梯度乙醇脱水处理,二甲苯透明,石蜡包埋切片,常规HE染色,显微镜下观察结果。
2.6 统计学方法
3 结果
3.1 复原胶囊对模型大鼠肾组织HIF-1α mRNA表达的影响
与假手术组比较,模型组大鼠肾组织HIF-α mRNA表达水平在各时相点显著升高(P<0.01或P<0.05)。与模型组比较,复原胶囊高剂量组在3 h时相点HIF-1α mRNA表达水平显著增高(P<0.05),其余各时相点均显著降低(P<0.01);复原胶囊低剂量组24 h时相点HIF-1α mRNA表达水平显著降低(P<0.05)。复原胶囊对模型大鼠肾组织HIF-1α mRNA表达的影响见表1、图1。
表1 复原胶囊对模型大鼠肾组织HIF-1α mRNA表达的影响(±s,n=4)Tab 1 Effect of Fuyuan capsule of mRNA expression of HIF-1α in kidney of model rats(±s,n=4)
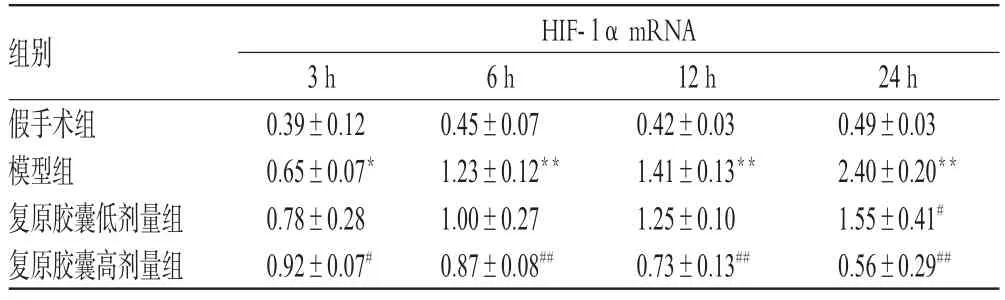
表1 复原胶囊对模型大鼠肾组织HIF-1α mRNA表达的影响(±s,n=4)Tab 1 Effect of Fuyuan capsule of mRNA expression of HIF-1α in kidney of model rats(±s,n=4)
与假手术组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01vs.sham group:*P<0.05,**P<0.01;vs.model group:#P<0.05,##P<0.01
组别假手术组模型组复原胶囊低剂量组复原胶囊高剂量组HIF-1α mRNA 24 h 0.49±0.032.40±0.20**1.55±0.41#0.56±0.29##3 h 0.39±0.120.65±0.07*0.78±0.280.92±0.07#6 h 0.45±0.071.23±0.12**1.00±0.270.87±0.08##12 h 0.42±0.031.41±0.13**1.25±0.100.73±0.13##
3.2 复原胶囊对模型大鼠血清IL-6含量的影响
与假手术组比较,模型组大鼠血清IL-6含量随时间逐渐增高(P<0.01);与模型组比较,复原胶囊高剂量组各时相点IL-6含量均显著降低(P<0.05)。复原胶囊对模型大鼠血清IL-6含量的影响见表2。
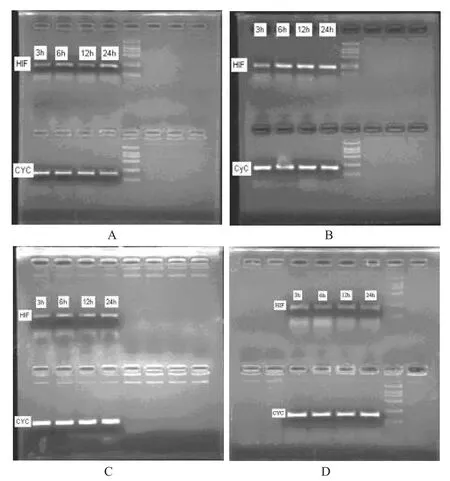
图1 复原胶囊对模型大鼠肾组织HIF-1α mRNA表达的影响A.假手术组;B.模型组;C.复原胶囊低剂量组;D.复原胶囊高剂量组Fig 1 Effect of Fuyuan capsule of mRNA expression of HIF-1α in kidney of model ratsA.sham group;B.model group;C.Fuyuan capsule low dosage group;D.Fuyuan capsule high dosage group
表2 复原胶囊对模型大鼠血清IL-6含量的影响(±s,n=4)Tab 2 Effect of Fuyuan capsule on the level of IL-6 in model rats(±s,n=4)
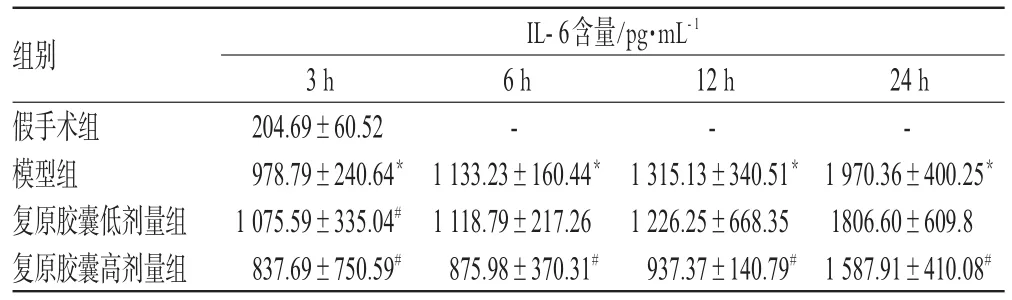
表2 复原胶囊对模型大鼠血清IL-6含量的影响(±s,n=4)Tab 2 Effect of Fuyuan capsule on the level of IL-6 in model rats(±s,n=4)
与假手术组比较:*P<0.05;与模型组比较:#P<0.05vs.sham group:*P<0.05;vs.model group:#P<0.05
组别假手术组模型组复原胶囊低剂量组复原胶囊高剂量组IL-6含量/pg·mL-1 24 h-1970.36±400.25*1806.60±609.81587.91±410.08#3 h 204.69±60.52978.79±240.64*1075.59±335.04#837.69±750.59#6 h-1133.23±160.44*1118.79±217.26875.98±370.31#12 h-1315.13±340.51*1226.25±668.35937.37±140.79#
3.3 复原胶囊对模型大鼠血清BUN含量的影响
与假手术组比较,模型组大鼠血清BUN含量在术后12、24 h时相点显著升高(P<0.01);与模型组比较,复原胶囊高剂量组大鼠血清BUN含量在12、24 h时相点显著降低(P<0.05)。复原胶囊对模型大鼠血清BUN含量的影响见表3
表3 复原胶囊对模型大鼠血清BUN含量的影响(±s,n=4)Tab 3 Effect of Fuyuan capsule on the level of BUN in model rats(±s,n=4)

表3 复原胶囊对模型大鼠血清BUN含量的影响(±s,n=4)Tab 3 Effect of Fuyuan capsule on the level of BUN in model rats(±s,n=4)
与假手术组比较:*P<0.01;与模型组比较:#P<0.05vs.sham group:*P<0.01;vs.model group:#P<0.05
组别假手术组模型组复原胶囊低剂量组复原胶囊高剂量组BUN含量/mmol·L-1 24 h-9.33±1.01*9.14±1.397.33±0.64#3 h 5.58±0.416.28±1.545.68±0.835.63±0.456 h-6.65±0.856.78±1.295.94±0.5112 h-8.66±1.07*8.97±0.937.04±0.65#
3.4 肾组织病理学变化
假手术组各时相点肾组织结构清晰;模型组3 h时相点可见肾小球毛细血管轻度淤血、红细胞渗出;6、12 h时相点可见出血、肾间质肿胀明显;24 h时相点肾小管区可见脱落坏死的上皮细胞。复原胶囊高剂量组上述病理学变化较轻。大鼠肾组织病理学切片见图2。
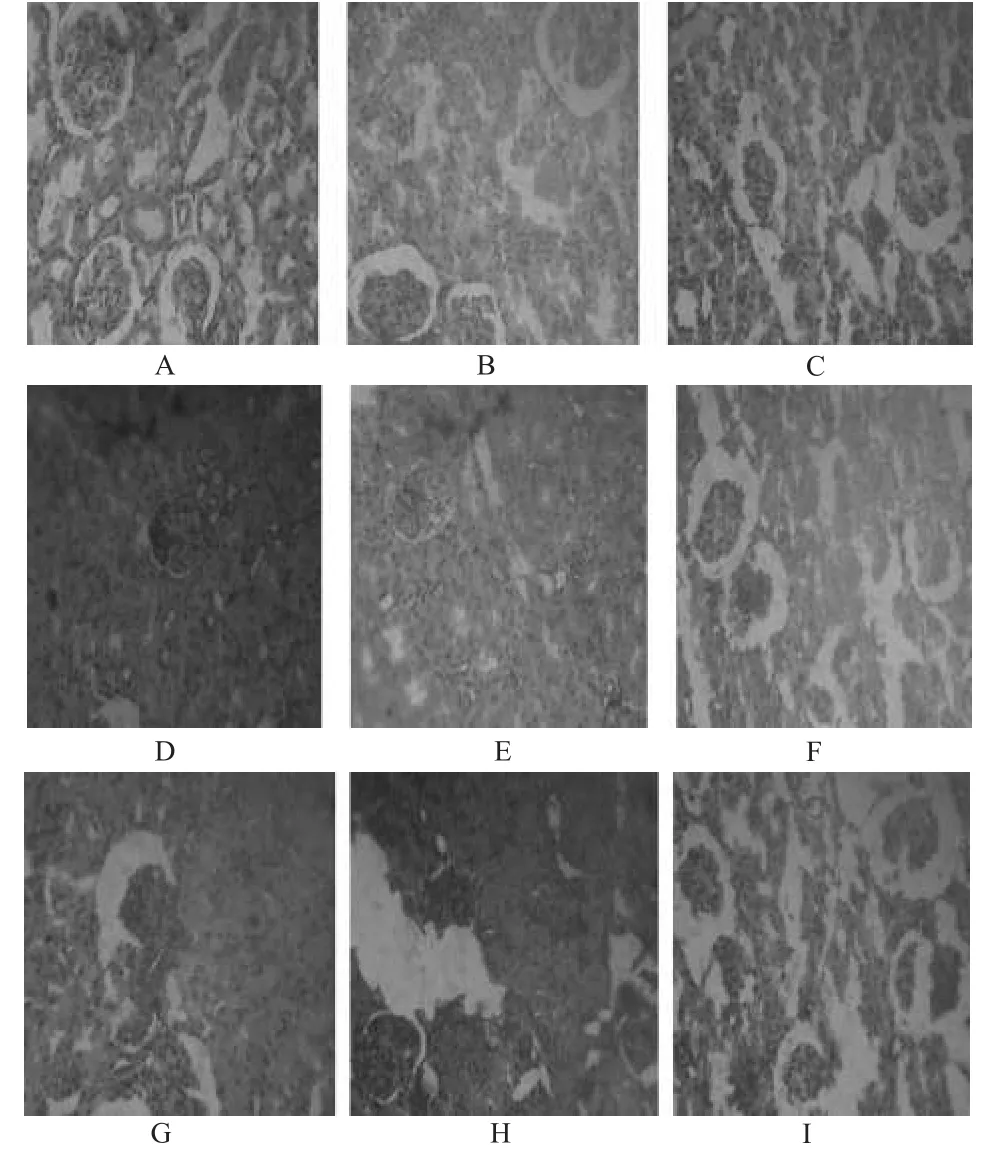
图2 大鼠肾组织病理学切片(HE,400×100)A.假手术组;B.术后3 h模型组;C.术后3 h复原胶囊高剂量组;D.术后6 h模型组;E.术后6 h复原胶囊高剂量组;F.术后12 h模型组;G.术后12 h复原胶囊高剂量组;H.术后24 h模型组;I.术后24 h复原胶囊高剂量组Fig 2 Histopathological section of kidney in rat(sHE,400×100)A.sham group;B.model group after 3 h of post-operation;C.fuyuan capsule high dose group after 3 h of post-operation;D.model group after 6 h of post-operation;E.fuyuan capsule high dose group after 6 h of post-operation;F.model group after 12 h of post-operation;G.fuyuan capsule high dose group after 12 h of post-operation;H.model group after 24 h of post-operation;I.fuyuan capsule high dose group after 24 h of post-operation
4 讨论
脓毒症是严重创伤、烧伤、休克、大手术后的常见并发症之一。临床上脓毒症缺乏有效的治疗措施,死亡率也居高不下,但有研究表明脓毒症早期给予体液复苏、增加组织氧气运输,可使临床预后明显改善[4]。而以活血化瘀为基础的中药制剂血必净是治疗脓毒症的有效药物。因此,本研究模拟脓毒症模型,并用中药复原胶囊进行治疗,观察其对机体的保护作用。
本研究表明,模型组大鼠可观察到精神萎靡、嗜睡、活动减少、呼吸急促、毛色晦暗、眼角存在分泌物等症状,腹腔内渗出液体增加并可闻及恶臭,这与文献[3]报道一致,说明脓毒症造模成功。模型组大鼠HIF-1α mRNA及炎症介质IL-6随时间延长逐渐增高,二者变化趋于一致,且肾组织病理学损伤逐渐加重,提示IL-6的大量激活是导致脏器损伤的重要因素;复原胶囊高剂量组HIF-1α及炎症介质IL-6均降低,同时观察到早期HIF-1α表达增高,但总体上肾组织学改变及肾功能损伤较轻。Cramer等[2]证实,HIF在调控髓细胞的能量代谢、聚集、迁移、侵袭及杀菌等方面起重要作用。因此,推测早期HIF-1 α mRNA的增高反映机体对病原体应答强度的增高,激活大量吞噬细胞以消灭病原体。而敖启林[5]通过HIF-1decoy抑制法发现HIF-1α促进炎症介质TNF-α的表达,并提示存在一个“炎症-炎症介质-HIF-炎症介质-炎症”的正反馈环。本实验中笔者也证实;HIF-1α mRNA总体水平表达的降低使炎症介质IL-6表达水平降低,对发生脓毒症时的肾组织起保护作用。
复原胶囊由黄芪、晒参、当归、川芎、丹参、三七等组成,具有益气活血的功效。临床及实验研究证实,活血化瘀法不仅可调节凝血/抗凝失衡,抑制有害血管活性介质的释放,还阻断病因及不同病机的凝血功能紊乱触发因素,在凝血功能紊乱不同阶段发挥有益作用。黄芪具有补气固表、脱毒排脓、敛疮生肌之功,研究表明黄芪提取物可有效抑制LPS引发的人类羊膜细胞产生IL-6、前列环素(PGE2)及白细胞三烯4(LTC4),具有较好的抗炎作用;此外还有清除自由基、抑制P-选择素表达的作用[6]。三七的有效成分除能够减少白细胞与血管内皮的黏附及过氧化物的产生外,还可以减少肥大细胞脱颗粒及降低促炎因子IL-6和TNF-α的水平。黄芪、川芎、丹参、三七等药能清除氧自由基,保护血管内皮细胞,降低毛细血管通透性,改善缺血/再灌注损伤,调节免疫,抑制血小板活化、聚集及血栓形成等[7]。
综上所述,复原胶囊通过对HIF-1α表达的调控减轻炎症反应,保护肾功能,可能与其多环节、多靶点调节免疫抑制全身炎症反应,并改善微循环有关。
[1]Warren HS.Strategies for the treatment of sepsis[J].N Engl J Med,1997,336:952.
[2]Cramer T,Yamanishi Y,Clausen BE,et al.HIF-1 alpha is essential for myeloid cell-mediated inflammation[J].Cell,2003,112(5):645.
[3]William J,Hubbard,Mashkoor Choudhry,et al.Cecal ligation and puncture[J].Shock,2005,24(1):52.
[4]Chong AY,Lip GY,Freestone B,et al.Increased circulating endothelial cells in acute heart failure:comparison with von Willeband factor and soluble E-selectin[J].Eur J Heart Fail,2006,8(2):167.
[5]敖启林.脂多糖活化的大鼠巨噬细胞TNF-α产生新机制[J].中国病理生理杂志,2006,22(1):148.
[6]Shon YH,Kim JH,Nam KS.Effect of Astragali Radix extract on lipopolysac charide induced inflammation in human amnion[J].Biol Pharm Bull,2002,25(1):77.
[7]Sun K,Wang CS,Guo J,et al.Effect of Panax notoginseng saponins on LPS induced adhesion of leukocytes in rat mensenteric venules[J].Clin Hemorheol Microcirc,2006,34(1~2):103.

