染色体的保护者—端粒与端粒酶
郑俊敏
染色体的保护者—端粒与端粒酶
郑俊敏
福建教育学院理科研修部
端粒是位于染色体末端、能保护染色体不被降解的特殊结构。端粒酶则是能合成端粒DNA的酶,使得端粒的长度和结构得以稳定。端粒和端粒酶的发现推动了科学家对人类衰老和肿瘤发生机制的研究,有助于相关疾病的预防和治疗。文章对端粒和端粒酶的发现过程、其主要结构和功能、以及与相关疾病的预防和治疗作了简要介绍。
端粒 端粒酶 结构 功能
2009年10月5日,瑞典皇家科学院将诺贝尔生理学或医学奖授予了3位美国科学家:伊丽莎白·布莱克本(Elizabeth H.Blackburn),卡萝尔·格雷德(Carol W. Greider)和杰克·绍斯塔克(Jack W. Szostak)。诺贝尔奖主页上介绍他们获奖的原因是揭示了“染色体是如何被端粒和端粒酶保护的”。
端粒是一种在染色体末端部分的一个帽子样的特殊结构(图1),其主要作用是使染色体不被降解。端粒酶则是帮助端粒合成的分子,它维持着端粒的长度和结构的稳定,从而保护染色体。绝大多数成体细胞缺乏端粒酶,导致端粒保护染色体的功能逐渐丧失,这被认为是决定细胞寿命的一个重要因素〔1〕。而在一些细胞中,如胚胎干细胞和癌细胞,端粒酶的活性高度表达,使得这些细胞不断分裂却不会遭受染色体损伤,延迟了衰老〔2〕。同时,一些遗传病也是由于端粒酶活性的缺失而导致的。正是由于这三位科学家开创性的工作,向人们揭开了端粒和端粒的神秘面纱,并了解了它们与人体衰老和许多疾病的关系。而整个端粒和端粒酶的研究进程就像相继解开一个个智力谜团一样有趣,充满了思想的光辉。重现这个思路对广大教师和学生都是有启发意义的。本文也提供了一个很好的科学问题推演的教学案例。
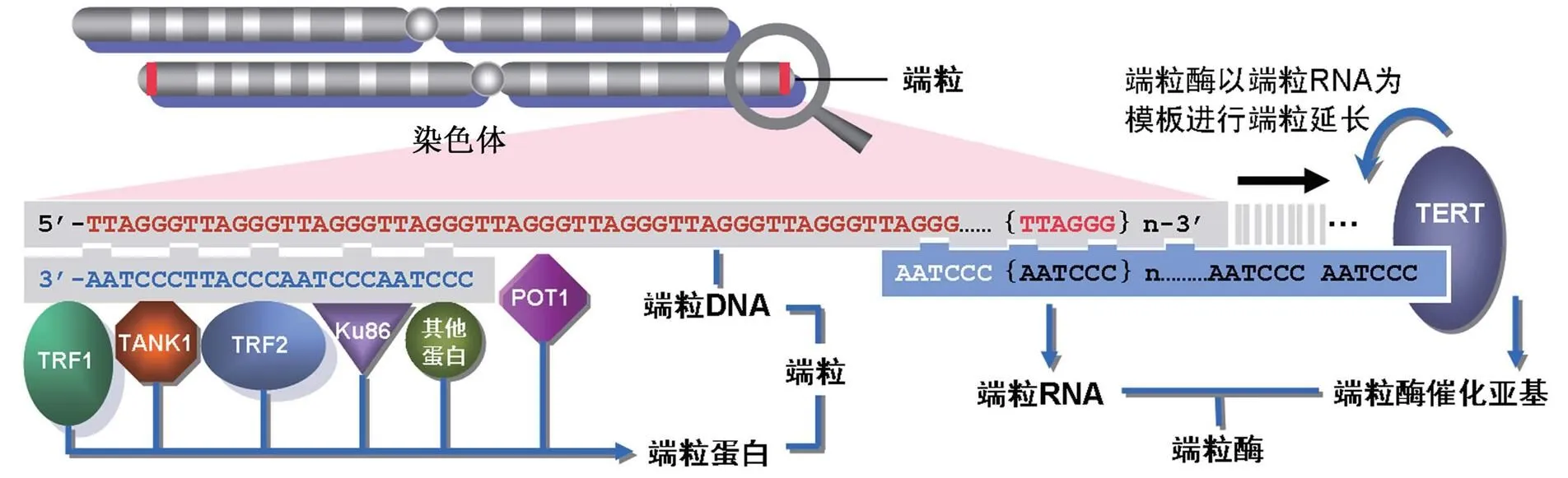
图1 端粒及其基本结构
1 端粒和端粒酶的发现
染色体末端对于染色体稳定性的重要作用,最早是在上世纪30年代,Barbara Mclintock(因为发现玉米的转座子获得诺奖)和Hermann Muller(因为发明用X射线突变基因而获得诺奖)在对玉米和果蝇的研究中提出来的〔3,4〕。Muller用希腊“末端”(telos)和“部分”(meros)这两个单词组成了端粒的新词(telomere)。Mclintock猜测这些末端特殊结构的缺少会使染色体在有丝分裂时易发生融合或断裂,伤害细胞。20世纪60年代早期,Leonard Hayflick发现人的成纤维细胞在体外培养时增殖次数是有限的。后来许多实验证明,正常的动物细胞无论是在体内生长还是在体外培养,其分裂次数总存在一个“极限值”。如人胚成纤维细胞在体外培养时只能增殖60~70代。而细胞增殖次数与端粒DNA长度有关。例如体细胞染色体的端粒DNA会随细胞分裂次数增加而不断缩短。细胞DNA每复制一次,端粒就缩短一段,当缩短到一定程度时,可能会相关基因表达,导致不可逆地退出细胞周期,从而走向衰亡。
那么端粒为什么与众不同呢?它的DNA序列有没有特殊性?1978年伊丽莎白通过体外DNA复制实验,推断出模式生物四膜虫()的端粒中含有许多重复的5'-CCCCAA-3’六碱基序列〔5〕。同时,杰克·绍斯塔克正试图在酵母中建构人工线性染色体,希望它能够像自然染色体一样在细胞中复制。但他构建的人工染色体转化入细胞后总是很快降解。1980年,当伊丽莎白报道她关于端粒DNA的发现时,引起了杰克的极大兴趣。于是二人合作将新发现的四膜虫端粒序列和人工染色体连接到一起,而后导入酵母细胞。奇迹出现了,人工染色体不再降解,可以在细胞内正常复制〔6〕。这一方面证实了端粒对染色体的保护作用,也使DNA的大片段克隆成为可能。后来,这一发明成为基因组大规模测序的基础之一,这也是杰克·绍斯塔克共同获得诺贝尔奖的重要原因。随后的一系列研究还表明,端粒DNA既有高度的保守性,如原生动物、植物和动物的序列都很相似,又有种属特异性。如人和哺乳动物为TTAGGG,草履虫为TTGGGG。
1984年,伊丽莎白发现了一个有趣的现象:带着四膜虫端粒DNA的人工染色体导入到酵母后,复制后被加上的是酵母端粒序列〔7〕。于是第二个问题产生了,为什么在四膜虫端粒上加的是酵母的端粒序列而不是四膜虫端粒本身的序列呢?是否酵母中存在专门的 “酶”来复制端粒DNA?正是这年,卡萝尔女士作为博士生加盟了伊丽莎白实验室。她们精心讨论设计实验,用四膜虫的核抽提液与体外的端粒DNA进行温育,证明了存在一种“酶”来延伸端粒DNA。这种酶后来被命名为“端粒酶”(telomerase)〔8〕。
2 端粒的结构与功能
在各种原生动物、菌类、动物和植物中,组成端粒的主要结构是富含重复G的DNA序列。脊椎动物中,组成端粒的DNA序列是一种串联重复序列(TTAGGG/CCCTAA)n〔9〕。染色体末端着丝粒DNA的典型末端是在一个单链上,有一个50~300nt长的富含G的突出部分。在3’末端,突出部分反向折回形成一个“环状”结构,构成染色体末端的着丝粒。重复片段的长度在染色体和物种之间有所不同。在人染色体末端,典型性戴着0.5~15kb碱基对的可检测性端粒重复序列。根据组织类型,个人的年龄和细胞的复制历史,重复序列的长度也有所不同。例如,染色体17p的端粒长度比其它染色体都短〔10,11〕。 在人有核血细胞,平均端粒长度随年龄增大而显著减小,特别是免疫系统的细胞。有研究表明,端粒存在开放(能被端粒酶延伸)和关闭(不能结合端粒酶)两种状态,而重复的长度与开放状态改变与否有关〔12〕。
除了DNA序列以外,还有大量的蛋白直接或是间接与端粒DNA相互作用。其中一些蛋白总是与端粒相结合,其另一些蛋白可能仅是瞬间结合。研究发现,许多与端粒DNA瞬间结合的蛋白在端粒外还有其它作用,调节这些蛋白结合的因子和转运的机制还不是十分清楚。但可以确定,这些蛋白之间的相互作用参与了端粒的功能和各种细胞信号途径,对于端粒的正常功能是必需的。
3 端粒酶的结构与功能
端粒酶是一个特殊的反转录酶,能通过添加TTAGGG重复片段,来延长染色体的3’末端〔13,14〕。人类端粒酶主要由RNA成分(hTR)、端粒酶相关蛋白1(hTEP1)和催化亚基(hTERT)三部分组成。其中核心酶是反转录酶蛋白hTERT,由hTERT基因编码的1132个氨基酸残基组成〔15〕。作为RNA依赖的DNA聚合酶,与一般的逆转录酶不同,hTERT可以识别单链富含G的寡核苷酸引物,以其RNA组分为模板与端粒重复序列进行碱基互补配对,在合成、延伸碱基序列中起催化作用。美国科学家近日利用X射线结晶学方法,揭示了赤拟谷盗()端粒酶的TERT蛋白具体晶体结构。它呈一个环状结构(图2),由3部分组成,分别是RNA结合区、逆转录区和羧基末端延伸区。在外形上,TERT与HIV病毒中的逆转录酶相似,研究者表示,这种相似并非巧合,它们表明了一种共同的进化起源,这将有助于改进抗HIV药物以在癌细胞中抑制端粒酶活性。hTR为一段451nt的RNA(包括CAAUCCCAAUC端粒模板),由端粒酶RNA基因hTERC编码,位于染色体3q21-q28。它的突变会导致端粒酶活性的改变,而hTEP1是一个在各种组织细胞中均存在活性的蛋白,其mRNA的表达也不局限于有端粒酶活性的组织和细胞,但它的存在也是端粒酶活性所必需的〔16〕。此外,位于X染色体的DKC1基因编码的核蛋白dyskerin也是人基础端粒酶酶促复合物的组分之一,是正确折叠和维持端粒酶RNA稳定性所必需的〔17〕。
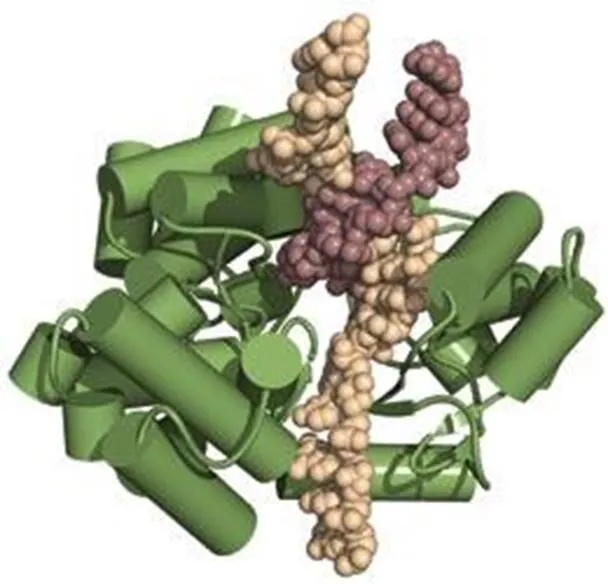
图2 端粒酶结构示意图
4 端粒与细胞衰老和健康
端粒酶通过调节细胞对亲代细胞分裂和DNA损伤所带来影响的反应,在细胞命运和衰老中承担重要任务。衰老可被定义为组织功能的衰微或下降,而最终导致死亡。这种功能的丧失可以是细胞分裂或复制过程中细胞功能的丧失或减少,或是细胞被功能丧失的细胞所取代。衰老并不是一种疾病,生物学上的衰老在个体之间多有不同,可以被认为是进化的一种内容。一种观点认为哺乳动物寿命的增长是由于生殖和生长速率的降低以及生物大分子准确复制的增强。但DNA的准确修复只是部分细胞、组织或生物种的一个可选项,而不是必选项。数百个端粒末端的重复序列必须“戴帽”于每个染色体末端,以避免DNA修复途径的启动。在大多数体细胞或是衰老和凋亡的细胞中,端粒酶对于缩短或是没有“戴帽”端粒的修复是很少启动的,但是当没有“戴帽”端粒积累过多时,这种修复机制会被触发。另一方面,端粒的平均长度与细胞的种类和端粒酶的相关活性有关。在体细胞中,端粒长度不一,但都随着年龄的增长而缩短。端粒的长度决定了细胞的寿命,故而被称为“生命的时钟”。通过端粒的缩短,能导致细胞衰老和死亡,清除异常或是恶性生长的细胞。官能不良的端粒还能促使染色体异常和非整倍性的发生。相对应的是,人的端粒长度如果异常,会引起一些临床症状,如再生障碍性贫血,免疫缺陷和肺纤维化,先天胰岛功能不良和肿瘤。
肿瘤是当今人类社会的多发病。正常情况下,人类体细胞端粒酶活性是很低的。但在多数肿瘤细胞中能检测出端粒酶的活性。肿瘤细胞中的端粒酶活性因某些因素被激活,使染色体末端的端粒不能正常缩短,而是继持在一定长度,因此肿瘤细胞能无限增殖,成为“永生细胞”。端粒酶是正常细胞转变为肿瘤细胞的关键性物质,是肿瘤治疗的重要药物靶点〔2〕。但是近来的一些研究表明,如果端粒功能丧失,会导致如下结果:染色体融合、破裂、易位、非整倍体产生和染色体的断裂-融合-桥循环。这种遗传的不稳定性会导致细胞非正常生长,也会促使遗传变异快速获得〔18〕。因此,尽管端粒功能的丧失可能是一种肿瘤抑制机制,但它也可促进肿瘤的生长。细胞中的染色体非整倍体和重排伴随着短端粒和DNA伤反应缺陷,与肿瘤生长起始和过程的许多分子机理相关。应该说,端粒异常和端粒的生物作用在人疾病中的作用还是被低估。
5 结语
科学发展史一再重复着一个现象,许多伟大的发现来自于对科学基本问题的探索,而这些重要问题的解决必然会有在当时不能估量的应用前景。四膜虫端粒序列的发现使人工染色体得以发明,而后者又为基因组测序做出重要贡献。正如伊丽莎白和卡萝尔·格雷德在回忆她们的发现时所说的:时间将告诉人们端粒酶和人类健康的何种联系才能持久下去,我们最初并不是着手于想要找到一个新的治疗癌症的方法或者研究某个疾病的机理,但是医学的历史充满了从不可能的地方获得重大进展的例子〔19〕。这三位科学家的发现使人们了解端粒与端粒酶的复杂机理,还涉及了细胞寿命、衰老、死亡以及疾病等等。但是端粒与端粒酶的发现仅是有关于人类衰老、疾病等研究谜题拼图中重要的一片,更多的迷团还有待于我们去解开。
[1] 魏伟,汤恢焕.端粒酶逆转录酶的研究进展[J].中国误诊学杂志,2008,(19):4548-4549.
[2] 祝利民,徐振晔.端粒端粒酶与肿瘤的研究进展[J].中医药学刊.2006,(2): 311-313.
[3] McClintock B. The behavior in successive nuclear divisions of a chromosome broken at meiosis [J]. Proc Natl Acad Sci USA, 1939, (25): 405-416.
[4] Muller HJ. The re-making of chromosomes [J]. Collecting Net, Woods Hole, 1938,(13):181-198.
[5] Blackburn EH and Gall JG. A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena[J]. J Mol Biol,1978,(120): 33-53.
[6] Szostak JW and Blackburn EH. Cloning yeast telomeres on linear plasmid vectors [J]. Cell, 1982, (29):245-255.
[7] Shampay J, Szostak JW and Blackburn EH. DNA sequences of telomeres maintained in yeast [J]. Nature, 1984, (310): 154-157.
[8] Greider CW and Blackburn EH. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts [J]. Cell, 1985, (43): 405-413.
[9] Moyzis RK, Buckingham JM, Cram LS, Dani M, Deaven LL, Jones MD, Meyne J, Ratliff RL, Wu JR. A highly conserved repetitive DNA sequence, (TTAGGG)n, present at the telomeres of human chromosomes [J]. Proc Natl Acad Sci USA, 1988,( 85): 6622–6626.
[10] Britt-Compton B, Rowson J, Locke M, Mackenzie I, Kipling D, Baird DM. Structural stability and chromosome-specific telomere length is governed by cis-acting determinants in humans [J]. Hum Mol Genet, 2006, (15): 725-733.
[11] Martens UM, Zijlmans JM, Poon SS, Dragowska W, Yui J, Chavez EA, Ward RK, Lansdorp PM. Short telomeres on human chromosome 17p [J]. Nat Genet, 1998, (18): 76-80.
[12] Blackburn EH. Switching and signaling at the telomere [J]. Cell, 2001, (106): 661-673.
[13] Autexier C, Lue NF. The structure and function of telomerase reverse transcriptase [J]. Annu Rev Biochem, 2006, (75): 493-517.
[14] Collins K. The biogenesis and regulation of telomerase holoen- zymes [J]. Nat Rev Mol Cell Biol, 2006, (7): 484-494.
[15] Harrington L, McPhail T, Mar V, Zhou W, Oulton R, Bass MB, Arruda I, Robinson MO. A mammalian telomerase-associated protein [J]. Science, 1997, (275): 973–977.
[16] Michishita E, McCord RA, Berber E , et al. SIRT6 is a histone H2 lysine 9 deacetylase that modulates telomeric chromatin [J]. Nature, 2008, (452): 492-496.
[17] Wong JM, Collins K. Telomerase RNA level limits telomere main- tenance in X-linked dyskeratosis congenita. Genes Dev, 2006, (20): 2848-2858.
[18] De Lange T. Telomere dynamics and genome instability in huma cancer [M]. In: Telomeres, edited by Blackburn EH, Greider CW. Pla inview, NY: Cold Spring Harbor Laboratory, 1995, p. 265-293.
[19] Greider CW and Blackburn EH. Tracking telomerase [J]., 2004,(116): 83-86.

