醋氯芬酸缓释片和普通片体内外释药行为的相关性研究
谢 魑
(四川省攀枝花市第二人民医院药剂科,四川 攀枝花 617001)
醋氯芬酸(aceclofenac)是一种新型口服强效非甾体抗炎药,化学名为2-[(2,6-二氯苯基)氨基]苯乙酰氧基乙酸,用于治疗骨关节炎、类风湿性关节炎、强直性脊椎炎、风湿性关节炎、慢性多发性关节炎、并行性骨关节炎等引起的疼痛和炎症[1]。醋氯芬酸为双氯芬酸钠的衍生物,通过抑制环氧酶和脂氧合酶而产生抗炎、镇痛作用,1992年首次在西班牙上市,1997年在美国、英国上市。醋氯芬酸口服吸收完全,生物利用度达99%,1.25~3 h达血药浓度峰值,生物半衰期为4~4.3 h,临床上常规给药剂量为每日200 mg,分2~3次服药。但普通口服制剂血药浓度波动大,患者依从性差,不利于临床治疗。一日一次的缓释制剂则符合临床发展的需要,可有效地避免体内血药浓度的峰谷现象,减少因峰浓度导致的药物副作用,从而提高患者的顺应性。我院陆续引进了醋氯芬酸的普通片和缓释片,笔者对其体外释放和Beagle犬体内药动学情况进行了对比研究,分析两种制剂的体内-体外相关性,旨在为临床用药提供参考。
1 仪器、试药及动物
ZRCD6-B型药物溶出度测定仪(均为上海黄海药检仪器厂);UV-9100型紫外可见分光光度计(北京瑞利分析仪器公司);离心机(上海安亭科学仪器厂);HPLC Pump L-7110,UV-VIS Detectorl L-7420(Hitachi)。醋氯芬酸(江西同和药业有限责任公司,批号为20080321),醋氯芬酸片(商品名为美诺芬,西安海欣制药有限公司);醋氯芬酸缓释片(浙江尖峰药业有限公司);其他试剂均为分析纯。健康Beagle犬6只,由本院实验动物中心提供,雌雄各半,体重 9.5~11 kg。
2 方法与结果
2.1 体外释放度试验
2.1.1 辅料干扰试验
按照配方量称取各辅料,溶于溶出介质中,在200~400 nm波长处进行紫外扫描。结果表明,在275 nm波长附近辅料无吸收,对测定无干扰。
2.1.2 标准曲线制备
精密称取醋氯芬酸100 mg,用磷酸盐缓冲液(pH=6.8)溶解,定容至 100 mL,分别精密量取 0.4,0.6,0.8,1.0,1.2,1.4,1.6 mL,置50 mL量瓶中,以磷酸盐缓冲液(pH=6.8)定容,摇匀,于275 nm波长处测定吸光度,用吸光度(A)与质量浓度(C)进行线性回归,得回归方程 C=40.611A-0.179 4,r=0.999 9(n=7)。
2.1.3 释放度测定
参照2005年版《中国药典(二部)》释放度测定法第一法。溶出介质选用磷酸盐缓冲液(pH=6.8),转速50 r/min,介质温度37℃。分别于 2,4,6,8,10,12,14,24 h 时取样 5 mL,过 0.8 μm 微孔滤膜,并及时补充同体积溶出介质。取续滤液稀释后,于275 nm处测定,计算醋氯芬酸累积释放百分率。醋氯芬酸普通片和缓释片体外溶出释放结果见图1。可见,普通片在服用后几乎立即溶解,而缓释片可以持续缓慢释药达15 h。
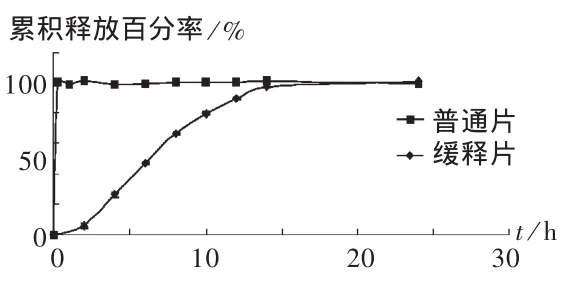
图1 醋氯芬酸普通片和缓释片体外溶出释放曲线(n=6)
2.2 Beagle犬体内药动学研究
2.2.1 色谱条件
色谱柱:Diamonsil C18柱(200 nm ×4.6 mm,5 μm);流动相:甲醇-水(0.3%三乙胺)=60∶40,磷酸调pH为7.0;检测波长:275nm;流速:1.0 mL/min;柱温:30 ℃ ;进样量:20 μL。
2.2.2 溶液配制
分别配制1.0 mg/mL的醋氯芬酸甲醇溶液和1.0 mg/mL的安定乙腈溶液(内标),作为贮备液,于4℃保存。临用前将贮备液精密稀释,作为工作液,用于制备标准曲线和质量控制样品;将内标贮备液精密稀释至75 μg/mL,作为内标液每份样品加入200 μL。
2.2.3 血浆样品预处理
取血浆样品0.5 mL,置2.0 mL Ep管中,加入75 μg/mL的内标液 200 μL,涡旋 1 min,加乙腈 800 μL 作为蛋白沉淀剂,涡旋 3 min,离心(10 000 r/min)10 min,取上清液进样。
2.2.4 方法学考察
专属性试验:在上述色谱条件下,将空白血浆、空白血浆加对照品和内标、Beagle犬服药后6 h血浆的色谱图进行比较。醋氯芬酸和内标的峰形良好,保留时间分别为14.2 min和20.7 min。空白血浆中的内源性物质、其他杂质和代谢产物不干扰测定(图2)。
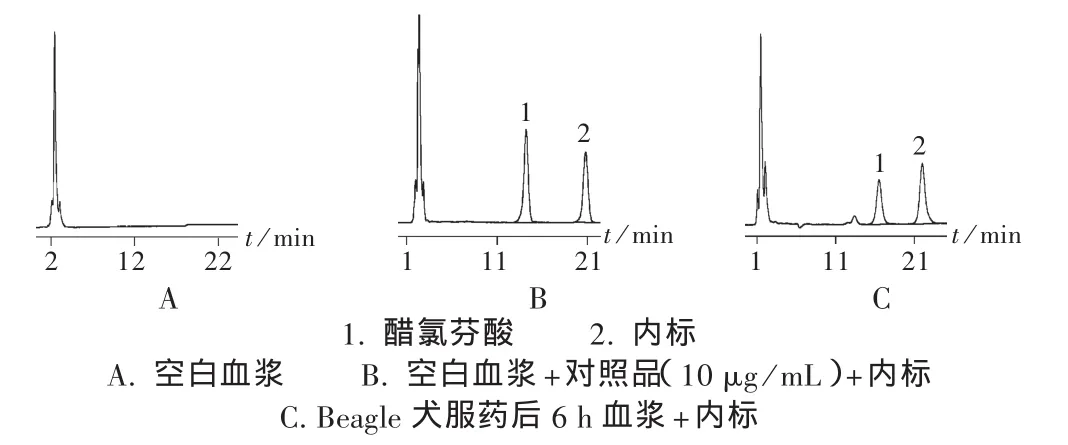
图2 醋氯芬酸高效液相色谱图
线性关系考察:取空白 Beagle犬血浆 500 μL,加入不同质量浓度的醋氯芬酸工作液50 μL,配制成质量浓度范围为0.5~100 μg/mL的血浆样品,涡旋1 min后加入内标,按2.2.3项下方法操作,进样测定。以醋氯芬酸和内标的峰面积比值(Y)与药物质量浓度(X,μg/mL)作线性回归,得回归方程 Y=0.119 2 X+0.007,r=0.991 0。结果表明,醋氯芬酸质量浓度线性范围是0.5~100 μg/mL。将醋氯芬酸在血浆中的最低定量限定为0.5 μg/mL。
精密度试验:取低、中、高3个质量浓度醋氯芬酸工作液制备的血浆样品,各6份,按2.2.3项下方法操作,于日内测定3次和连续3 d测定,计算日内和日间精密度,结果见表1。
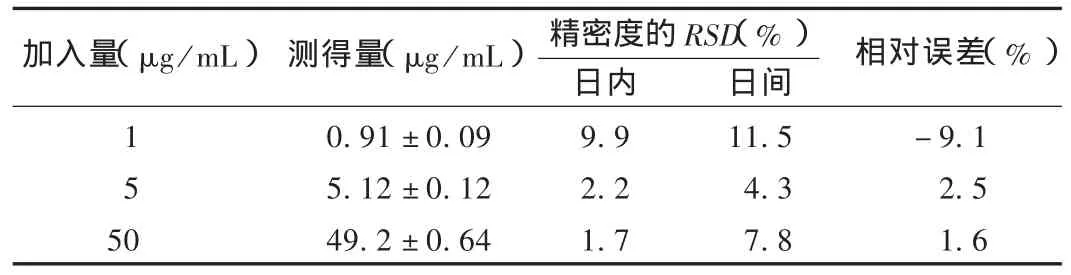
表1 日内和日间精密度测定结果
回收率试验:取空白血浆500 μL,加入低、中、高3个质量浓度醋氯芬酸工作液,配制成质量浓度为1,5,50 μg/mL的血浆样品,每一浓度平行操作6份,按2.2.3项下方法操作,依法进行测定。同时测定低、中、高3种质量浓度未经制备的质量控制样品,并与相同质量浓度的标准样品制备成血浆样品后测定的结果进行比较,计算绝对回收率。结果回收率分别为88.7%,91.1%,97.3%,RSD 分别为 8.7%,3.0%,0.7%(n=6)。
稳定性试验:分别配制质量浓度为1,5,50 μg/mL的模拟血浆样品各3份,按2.2.3项下方法操作,室温放置12 h后分析。结果表明,处理后的醋氯芬酸血浆样品室温放置12 h稳定(相对误差为8.7%,7.4%,1.3%),经过3次冷冻解冻循环后亦稳定(相对误差为3.3%,-5.3%,-12.3%)。
2.2.5 试验设计与结果
将6只Beagle犬随机分成两组,并随机确定服药顺序,分别服用醋氯芬酸普通片(参比制剂)和醋氯芬酸缓释片(受试制剂),给药剂量均为200 mg。试验前禁食12 h,分别于给药前和给药后0.5,1,2,3,4,6,8,10,12,14,24 h 时取静脉血 3 mL,离心取血浆,于-20℃保存。间隔1周后进行交叉试验。药时曲线见图3。可见,醋氯芬酸缓释片的达峰时间(tmax)延长,峰浓度(Cmax)降低,体内平均驻留时间显著延长,体现了缓释制剂药物浓度变化平稳、且维持时间长的特点。
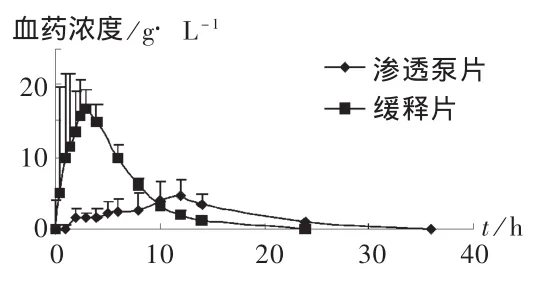
图3 Beagle犬口服受试制剂和参比制剂后平均血药浓度-时间曲线(n=6)
2.3 药动学参数
将血药浓度数据用DAS 2.0统计软件进行有关药动学参数求算,结果见表2。

表2 Beagle犬口服醋氯芬酸普通片和缓释片的平均药动学参数(X ± s,n=6)
2.4 体外释放和体内吸收相关性分析
经拟合,醋氯芬酸缓释片Beagle犬体内药动学为二室模型,体内吸收百分数(Fa)采用Loo-Riegelman方法(L-R法)计算:
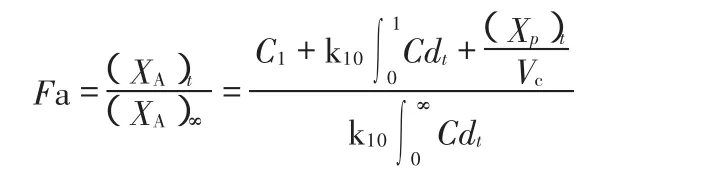
式中(XA)t是 t时间吸收到人体内的药物量,(XA)∞是体内吸收的药物总量,Ct是 t时间的血药浓度,k10为药物从中央室消除的一级速率常数,Xp为周边室内药物量,Vc为中央室表观分布容积。
将 t时间体内吸收百分数与相应时间体外累积释放百分率进行线性回归,根据回归系数来判断体内外相关性是否显著。结果见表 3。以 2~8 h体外累积释放百分率为自变量,体内吸收百分数为因变量,线性回归方程Y=0.601 4X+0.293 5,r=0.967 0( n=6)。结果表明,醋氯芬酸缓释片体内外相关性较好。
3 讨论
在预试验中使用了蒸馏水、pH=1.2的盐酸溶液、4‰聚氧乙烯烷基硫酸钠(SLS)以及pH=4.5的醋酸-醋酸铵缓冲液作为溶出介质。由于醋氯芬酸溶解度太小,不能满足漏槽条件,因此释放速率极其缓慢,24 h不能完全释放。在pH=4.5醋酸-醋酸铵缓冲液中,因不能形成良好的凝胶1层,药物只能通过被动扩散方式释放到溶出介质中,在24 h内同样不能将药物完全释放出来。在pH=6.8的磷酸盐缓冲液中,药物骨架能较快形成凝胶层,药物通过扩散及凝胶溶蚀而释放到介质中,24 h的残留量很少;醋氯芬酸的溶解度(13.53 g/L)远大于0.22 g/L,符合漏槽条件;且pH=6.8的磷酸盐缓冲液又较其他介质更接近生理条件。因此,采用pH=6.8磷酸盐缓冲液作为溶出介质。
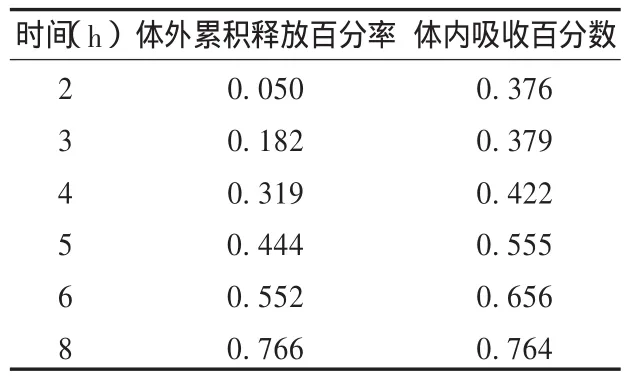
表3 体外累积释放百分率和体内吸收百分数(%)
对图2中醋氯芬酸缓释片释放度曲线分别进行零级、一级、Hixon Crowell方程以及Higuchi方程模型拟合,结果零级为 Q=4.16t+5.29(r=0.984 7),一 级 为 ln(100-Q)=-0.124t+4.814(r=0.977 0),Higuchi方程为 Q=20.61 t1/2-9.62(r=0.977 6),Hixon Crowell方程为(100-Q)1/3=-0.125t+4.741(r=0.997 7),其中 Q为药物释放百分率(% ),t为药物释放时间(h)。可见,用Hixon Crowell方程较好,可以用其描述药物在体外的释放过程。而药物的具体释放机制则用方程 Q=Ktn(K为常数)来评价,通过拟合得到 n值为0.788(r=0.996 2),符合非Fickian扩散机制,药物释放是亲水凝胶溶蚀与药物扩散共同作用的结果。由于 n值在0.45与0.89间但更接近0.89,可以推测,这两种机制中凝胶溶蚀作用为主[2]。动物试验显示,醋氯芬酸缓释片具有缓释特征,与普通片吸收程度生物等效[3]。本院引进的醋氯芬酸缓释片为亲水凝胶缓释骨架片,制剂遇水后骨架材料吸水形成凝胶,可通过凝胶层的黏度和厚度控制药物的释放速度。本试验结果显示,醋氯芬酸缓释片的血药浓度平稳,与普通片相比可较长时间保持有效血药浓度,由于每天仅需服药1次,增加了患者的顺应性,值得向临床推荐。
[1]El-Saharty YS,Refaat M,El-Khateeb SZ.Stability-indicating spectrophotometric and densitometric methods fordetermination ofaceclofenac[J].Drug Development and Industrial Pharmacy,2002,28(5):571-582.
[2]Xu G,Sunada H.Influence of formulation change on drug release kineticsfrom hydroxypropylmethylcellulosematrixtablets[J].Chem Pharm Bull,1995,43(3):483-487.
[3]刘承统,黄开合,谢 林,等.醋氯芬酸缓释片在犬体内药代动力学及其相对生物利用度研究[J].中国药科大学学报,2004,35(5):443-445.

