噻环乙胺及小型猪复合麻醉剂对大鼠不同脑区乙酰胆碱含量的影响
张 燕,王洪斌,范宏刚,卢德章
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
乙酰胆碱(ACh)是中枢神经系统中重要的兴奋性神经递质,与自主神经系统的调节、肌肉运动、大脑意识与思维、学习与记忆等都有广泛联系,对激活并维持脑电和行为的觉醒有重要作用。大量的动物研究表明,抑制ACh在中枢的释放和传递是全麻药产生中枢麻醉作用的机制之一[1-4]。
噻环乙胺(盐酸乙胺噻酚环己酮,tiletamine hydrochloride),又名替来他明,为苯环己哌啶类静脉全麻药。近年来噻环乙胺逐渐被引入到国内动物临床麻醉中,但是由于其中枢作用机制不是很清楚,影响了其在国内动物医学领域的深度开发和广泛应用。
小型猪复合麻醉剂(XFM)是东北农业大学外科教研室于2007年根据平衡麻醉的原理和小型猪的生理特点,用噻环乙胺复合噻拉嗪和强痛灵等几种麻醉剂,研制出的一种小型猪专用复合麻醉制剂XFM[5]。
本试验目的在于通过研究噻环乙胺及XFM麻醉下,大鼠不同脑区ACh的变化情况,探讨噻环乙胺及小型猪复合麻醉剂(XFM)麻醉中枢作用的可能机制。
1 材料与方法
1.1 试验材料及动物 盐酸噻环乙胺购自法国维克公司(纯度99.83%),小型猪复合麻醉剂(XFM)由东北农业大学兽医外科教研室研制(批号:090425);大鼠专用乙酰胆碱检测试剂盒购自美国Sigma公司;TGL-16G高速冷冻离心机(上海安亭科学仪器厂),318MC型酶标仪(上海三科仪器有限公司)。Wistar大鼠56只,购自黑龙江中医药大学,雌雄各半,体重 200±20 g。
1.2 试验动物分组 Wistar大鼠56只,先随机抽取8只为对照组。其余随机均分为噻环乙胺组和XFM 组,每组又随机均分为麻醉组、恢复Ⅰ组和恢复Ⅱ组3个亚组,每组8只。对照组大鼠:腹腔注射(ip)生理盐水2 mL/kg,噻环乙胺组:ip噻环乙胺2 mL/kg,XFM组:ip XFM 2 mL/kg。对照组在注射后5 min断头取材,麻醉组、恢复Ⅰ组和恢复Ⅱ组分别在大鼠翻正反射消失即刻、翻正反射恢复即刻和翻正反射恢复后可直线爬行时断头取材,投入液氮快速冷冻,在生理盐水冰面上迅速分离双侧大脑皮层、海马、丘脑、小脑和脑干,分别称重后立即-80℃冷冻保存。
1.3 ACh含量的测定 将不同脑区的脑组织投入装有9倍容积(1/9,W/V)新鲜冷10%三氯乙酸的玻璃匀浆器中,冰浴下匀浆;匀浆液于,10 000 r/min(4℃)离心15 min,取上清液待测。本试验采用ELISA检测。
1.4 统计分析 采用SAS 6.12数据统计软件进行统计学处理,试验数据以均数±标准差()表示,各组均数的比较采用方差分析。
2 结果与分析
2.1 大鼠麻醉情况 大鼠ip噻环乙胺2 mL/kg后,逐渐表现为行动迟缓、共济失调、后肢无力、最后倒卧不动、翻正反射消失,进入麻醉期;翻正反射恢复时,大鼠呼吸增快、头与四肢摆动,努力翻身;恢复反正反射的大鼠,先转圈或斜线缓慢爬行,最后可直线爬行,但行为依然缓慢。
大鼠ip XFM 2 mL/kg后,麻醉情况与噻环乙胺组基本一致,但麻醉期明显短于噻环乙胺组,且苏醒迅速,翻正反射恢复后,很快可以直线爬行。
从噻环乙胺与XFM麻醉全过程可见,噻环乙胺麻醉诱导期短且平稳(无兴奋现象),麻醉时间长,苏醒缓慢;与噻环乙胺比较,XFM麻醉诱导期短且平稳(无兴奋现象)(P>0.05)、麻醉时间适宜(P<0.05)、苏醒迅速(P<0.01)等特点,结果见表1。
2.2 噻环乙胺及XFM对大鼠不同脑区ACh含量的影响 大鼠ip噻环乙胺2 mL/kg后,在麻醉组中,大脑皮层、海马和丘脑内ACh含量均显著降低,与对照组比较,分别降低了34.02%(P<0.01)、31.24%(P<0.01)和49.5%(P<0.01);在恢复Ⅰ组中,除了大脑皮层中ACh含量仍未恢复(P<0.05)外,海马和丘脑中ACh含量均显著恢复(P>0.05);在恢复Ⅱ组中,上述各脑区内ACh含量均显著恢复(P>0.05);同时与麻醉组比较,差异显著或极显著(P<0.05或P<0.01)。而各组中小脑和脑干内ACh含量均无显著变化(P>0.05)。
表1 大鼠麻醉情况,n=48) (min)

表1 大鼠麻醉情况,n=48) (min)
**:P<0.01,差异极显著;*:P<0.05,差异显著
?
大鼠ip XFM 2 mL/kg后,在麻醉组中,大脑皮层和丘脑内ACh含量均显著降低,与对照组比较,分别降低了38.47%(P<0.01)和56.42%(P<0.01);在恢复Ⅰ组和恢复Ⅱ组中,上述脑区内ACh含量均显著恢复(P>0.05),同时与麻醉组比较,差异显著或极显著(P<0.05或P<0.01)。而各组中海马、小脑和脑干内ACh含量均无显著变化(P>0.05)。结果见表2。
表2 噻环乙胺及XFM对大鼠不同脑区 ACh含量的影响,n=8) (pmol/mg湿组织)
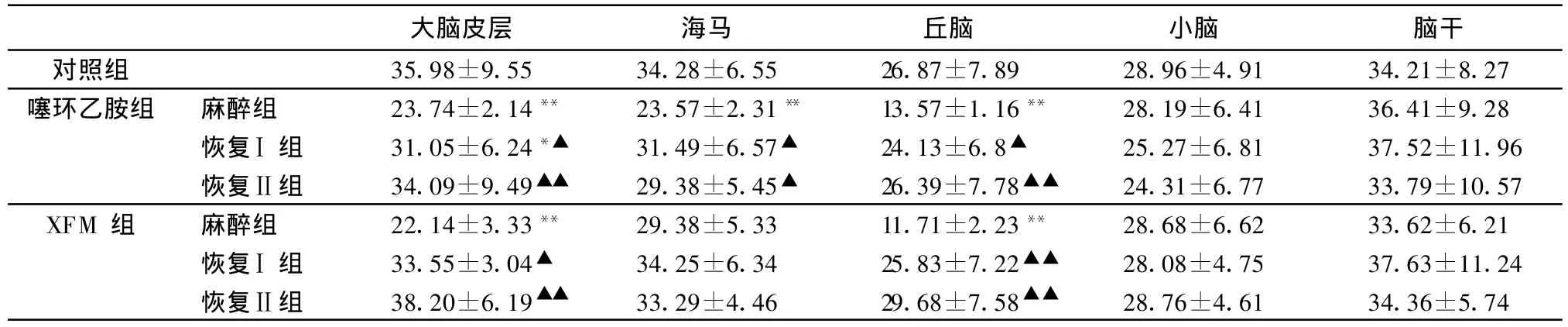
表2 噻环乙胺及XFM对大鼠不同脑区 ACh含量的影响,n=8) (pmol/mg湿组织)
与对照组比较,**:P<0.01,差异极显著;*:P<0.05,差异显著。与麻醉组比较,▲▲:P<0.01,差异极显著;▲:P<0.05,差异显著
?
从表2中可以看出,在噻环乙胺组中,大脑皮层、海马和丘脑中ACh含量的变化趋势与大鼠行为学变化情况基本一致;而小脑和脑干中ACh含量变化趋势不明显,与大鼠行为学变化情况无规律可循。在XFM组中,大脑皮层和丘脑中ACh含量的变化趋势与大鼠行为学变化情况基本一致;而海马、小脑和脑干中ACh含量变化趋势不明显,与大鼠行为学变化情况无规律可循。
3 讨论
3.1 由于 ACh本身很不稳定,释放后极易被AChE水解,而且ACh和胆碱的分子中都没有生色团、荧光团和电活性基团,因而对ACh的测定很困难[6]。有人应用 ACh合成酶-胆碱乙酰化酶(ChAT)或AChE的活力间接地表示的ACh含量,但AChE主要分布在突触后膜,并不能准确的代表ACh的分布状况,而Houser经试验证实ACh和ChAT的分布在基底前脑、海马等部位是一致的,但在大脑皮质和丘脑上部等部位则不一致[7]。目前已有不少方法来直接测定ACh,如放射免疫法,灵敏度、特异性高,但需要制备抗ACh,且操作过程繁琐,重现性不太好;荧光分光测定法,操作简便,但灵敏度不高;高效液相法,组织样本处理简单,灵敏度、特异性强,但测定时需制备成衍生物,且对色谱柱、检测器电极等的要求高,设备昂贵[9]。本试验采用ELISA检测脑组织中ACh的含量,本法操作简便,灵敏度高(可达pmol水平),特异性强,且对操作人员健康无危害。
3.2 目前还未见有关噻环乙胺及其复合制剂对中枢ACh含量影响的报道,仅有少量关于其同类药氯胺酮的研究,结果显示氯胺酮麻醉下丘脑内ACh含量显著下降[1];孙绪德、袁红、葛晓群等的研究显示,安氟醚、水合氯醛、吗啡均能降低中枢 ACh的含量[3-4,11]。这与本试验结果基本一致。本实验结果显示,大鼠ip临床相关剂量的噻环乙胺后,大脑皮层、海马和丘脑内ACh含量显著降低,而小脑和脑干内ACh含量未见明显变化;ip XFM 后,大脑皮层和丘脑内ACh含量显著降低,而海马、小脑和脑干内ACh含量未见明显变化。噻环乙胺和XFM麻醉全过程中,ACh含量变化趋势与大鼠麻醉情况基本一致。这说明噻环乙胺和XFM对中枢神经系统各脑区的作用具有选择性,大脑皮层、海马和丘脑可能是噻环乙胺中枢麻醉作用的靶位脑区;大脑皮层和丘脑可能是XFM中枢麻醉作用的靶位脑区。抑制ACh在中枢的释放和传递可能是噻环乙胺和XFM全麻作用的重要机制。XFM对海马内ACh产生抑制,但并不显著,分析原因,可能是单独使用噻环乙胺是可以引起ACh显著下降,但比较大脑皮层和丘脑,下降程度要小;而噻环乙胺作为XFM 的一种成分与其他几种麻醉剂复合使用时,其含量没有单独使用时多,这样不足以引起海马内ACh的显著下降。
4 结语
试验结果表明,ACh参与了噻环乙胺和XFM的全麻中枢作用机制。噻环乙胺对大脑皮层、海马和丘脑内ACh的抑制、XFM对大脑皮层和丘脑内ACh的抑制可能是其产生全身麻醉作用的重要机制之一。
[1]SUN Xu-De,GAO Chang-Jun,ZHANG Hui,et al.Effects of ketamine anesthesia on neurotransmitter metabolism of cerebral gang lion in dogs[J].J Fourth Mil M ed Univ,2008,29(22):2038-2040.
[2]JIA Jing,XU Man-ying.Influence of acetylcholine,atropine,and pilocarpine on the morphologies of neuronsin locus ceruleus of rats in the algesic modulation[J].Journal of Harbin Medical University,2007,41(2):109-111.
[3]葛晓群.吗啡抑制呼吸与脑中乙酰胆碱含量间的关系[J].徐州医学院报,1989,2:83.
[4]孙绪德,张惠,徐礼鲜,等.安氟醚麻醉下犬丘脑内神经递质的变化[J].临床麻醉学杂志,2006,22(5):365-366.
[5]范宏刚.小型猪复合麻醉剂的研制及其全麻机理的研究[D].哈尔滨:东北农业大学博士学位论文,2008:1-11.
[6]王俏.脑乙酰胆碱分析技术的研究进展[J].浙江省医学科学院学报,2006,9:32-36.
[7]XU Shao-fen.Neurobiology[M].2nd ed.Shanghai:Fu Dan U-niversity Publishing House,1999:116.
[8]Fujii T,Harada H,Koyama T,et al.Effects of physostigmine and calcium on acetylcholine efflux from the hippocampus of freely moving rats as determined by in vivo microdialysis and a radioimmunoassay[J].Neurosci Lett,2000,289:181-184.
[9]Hanin I.Methods for the analysis and measurement of ACh[J].M odern Methods in Pharmacology,1982,2:9.
[10]YUAN Hong,ZHENG Chun-xiu,XU Jian-lan,et al.Investigation of the changes between the power of neurotransmitter and entropyunder different dose of anesthetization[J].Chinese Journal of physical fitness medicine,2008,10(4):271.

