大环三胺类化合物合成方法的研究进展
大环三胺类化合物具有非常重要的生物活性,广泛应用于无机药物化合物、离子捕获剂、分子传感器以及氧化还原过程中的模拟酶等方面[1~4],一直是化学家研究的热点[5~7]。但大环三胺类化合物的合成比较困难,存在合成步骤多、产率低等问题。大环三胺类化合物根据环的大小可分为九元三氮大环、十元三氮大环、十一元三氮大环、十二元三氮大环等等。常用的三氮大环化合物母体有九元环的1,4,7-三氮杂环壬烷(TACN,Ⅰ)、十元环的1,4,7-三氮杂环癸烷(TACD,Ⅱ)、十二元环的 1,5,9-三氮杂环十二烷(TACH,Ⅲ),见图1。其中十元环大环三胺1,4,7-三氮杂环癸烷(TACD)的研究相对较少,鉴于此,作者所在课题组合成了十元环的大环三胺TACD[8]及侧壁带有羧酸基[9]、醇羟基、苯丙咪唑基的衍生物,并研究了部分配合物的晶体结构[10~12]。在此,对大环三胺单体及其衍生物的合成方法进行了探讨。
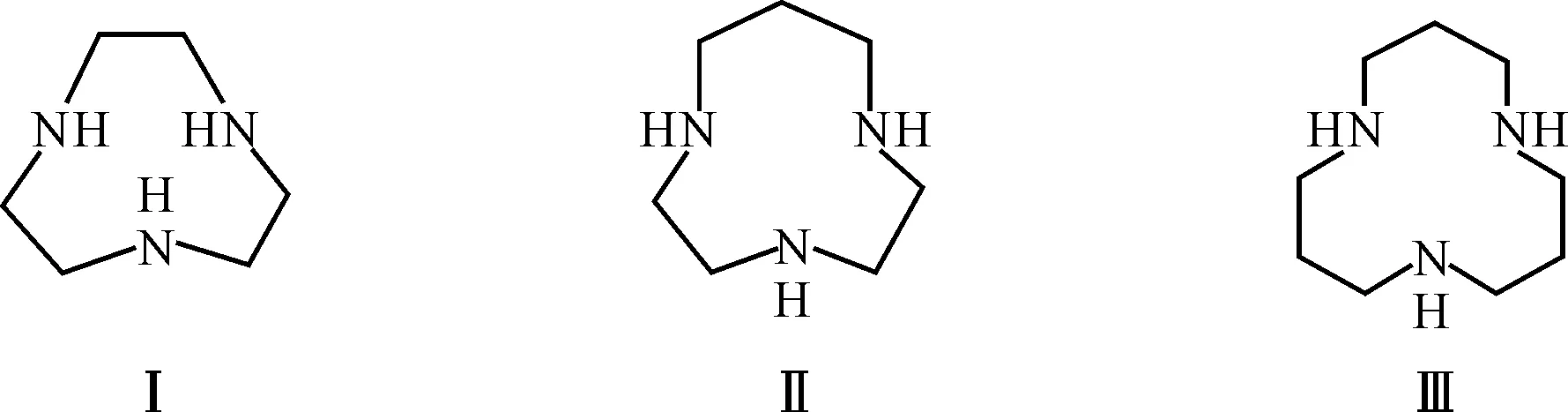
图1 大环三胺类化合物结构式
1 大环三胺单体的合成
大环三胺单体的合成方法主要有以下两种:
(1)Koyama-Yoshino三步法[13,14]
该合成方法于1972年首次报道,产率20%左右,合成路线见图2。

图2 Koyama-Yoshino三步法合成大环三胺单体路线
该法反应分为三步:即二乙撑三胺(m=1)或二丙撑三胺(m=2)经过磺酰化保护,然后与二氯代烃,如1,2-二溴乙烷(n=1)或1,3-二溴丙烷(n=2)等在碱性条件下直接发生成环反应;最后脱保护基、碱化萃取。溶剂N,N-二甲基甲酰胺(DMF)作为一种偶极非质子溶剂,是环化反应的首选试剂。碳酸钾作为中和试剂,在环化反应中的作用非常重要。一方面,它能部分夺取Ts3N3链端仲氮上的氢,使Ts3N3活化,相当于碱性试剂;另一方面,钾离子大小与九到十五元环的空腔大小相匹配,可起到模板离子的作用,促进成环反应。该法的反应步骤较少,操作简单,但产率低,在相当一段时间里很少受到关注。1989年,Chavez等[15]改进了反应条件,使该法的产率达到80%,其中要求二溴乙烷过量、反应时间较长,但具体反应条件没有说明,需要进行探索。
作者参照这一方法合成了十元环的1,4,7-三氮杂环癸烷(TACD)[8],并优化了实验条件,提高了产率。合成路线见图3。
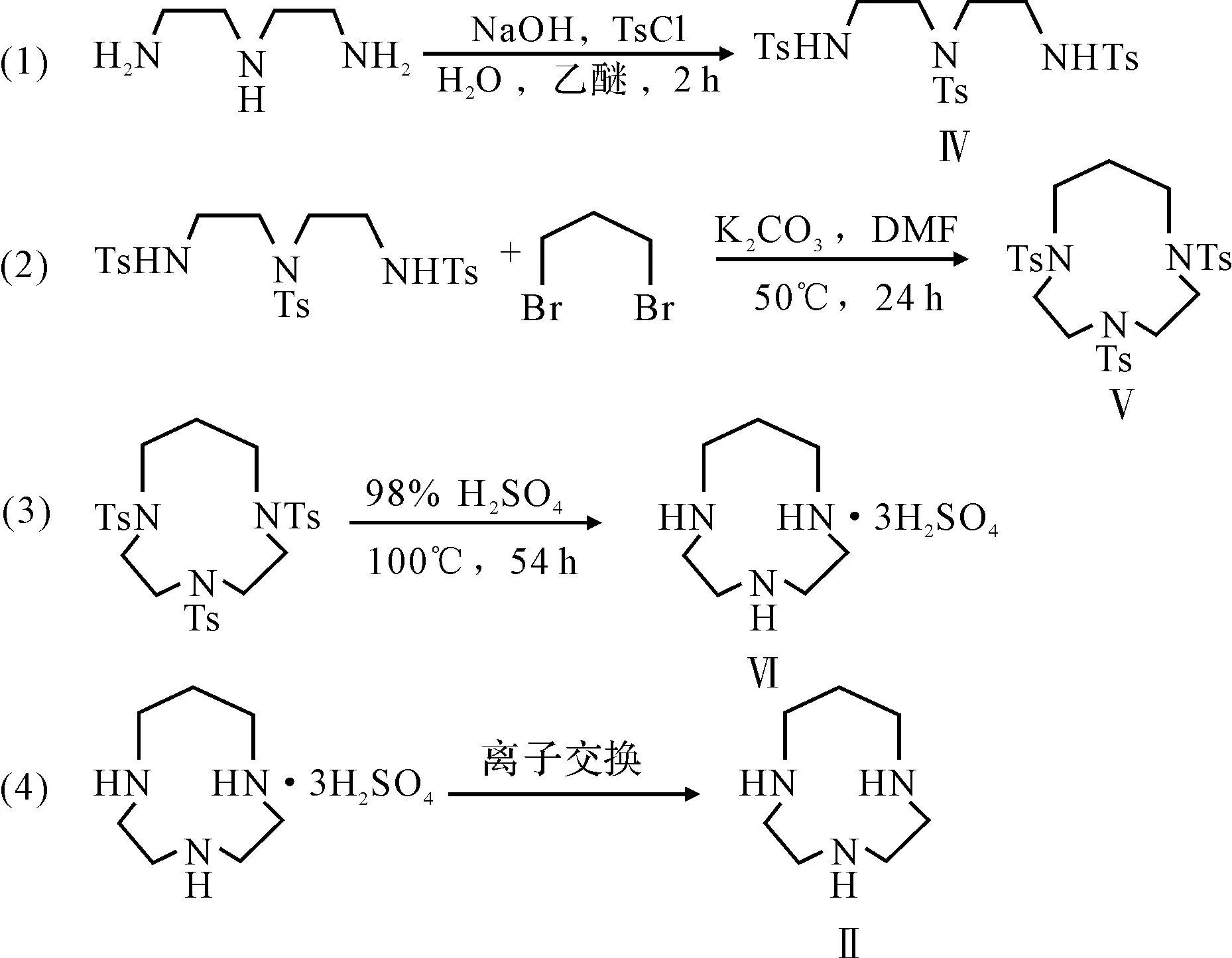
图3 TACD的合成路线
在此反应中,首先对二乙撑三胺进行磺酰化,然后以DMF作溶剂,和1,3-二溴丙烷在碱金属碳酸盐存在下进行环化得到环化产物Ⅴ,省去了1,3-丙二醇的磺酰化以及对甲苯磺酰胺的钠盐化步骤,简化了操作,节省了溶剂。作者探索了反应时间、反应温度以及反应物的配比对产率的影响,发现反应时间和反应温度对产率影响不大,但反应物的配比对产率的影响较大,当1,3-二溴丙烷与反应物Ⅳ的配比为2.5∶1时,产率达到80%,这一结果与文献[16]吻合。另外,在得到配体的盐酸盐及中性配体时,并没有采用碱化萃取,而是将化合物Ⅵ溶于少量蒸馏水中,然后过717#强碱性阴离子交换树脂进行离子交换实现分离提纯。这一改进比较环保,符合绿色化学的原则。

表1 化合物Ⅳ、Ⅴ、Ⅱ的熔点及元素分析结果
(2) Richman-Atkins五步法[17,18]
这一方法是合成大环多胺类配体的最为经典的方法,合成路线见图4。
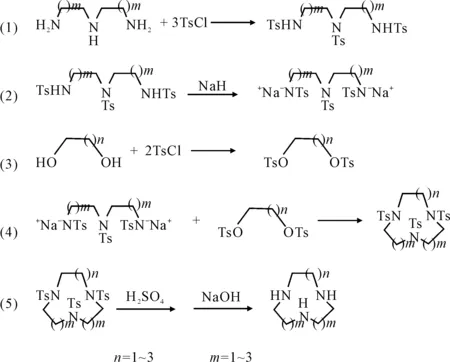
图4 Richman-Atkins五步法合成大环三胺单体路线
该法反应分为五步:第一步与Koyama-Yoshino法相同,即二乙撑三胺(m=1)或二丙撑三胺(m=2)经过磺酰化保护;第二步反应的实质是将第一步反应的反应物活化,这是此法的关键之处;第三步将1,2-二溴乙烷(n=1)或1,3-二溴丙烷(n=2)经过磺酰化保护;第四步关环;最后一步与Koyama-Yoshino法相同,即脱保护基、碱化萃取。此法于1974年由Richman等[17]首先提出,研究对象为九至二十一元环合物,包括3~7个氮或氧原子,产率在40%~90%之间。由于该法通常能够获得令人满意的产率,因此立即成为合成环合物的常用方法。由于第二步反应物被大大活化,使关环反应不仅非常容易进行且比较彻底。这样不仅大幅缩短了反应时间,而且反应体系也不需要高度稀释。产率一般可达70%~80%。但该方法步骤较多,保护和去保护耗费试剂量较大,操作不便,条件要求高;第二步反应需要在绝对无水条件下进行;为使Ts3N3能全部转化为二钠盐形式,需要较长的反应时间;制得的Ts3N3二钠盐不能放置,必须立即与对甲苯磺酸乙二酯反应。
2 大环三胺衍生物的合成
通过对大环三胺上三个自由仲氮原子的修饰,可以得到各种以大环三胺为骨架的不同配体,大环三胺衍生物的合成方法大体有以下三种:
2.1 大环三胺单体与亲电试剂直接取代法[19,20]
该方法以大环三胺单体为起始原料,与氯代烃等亲电试剂直接反应,是合成部分取代或全取代的大环三胺衍生物的最为简便常用的方法。张闻[16]用一步法合成得到了侧壁带有苯并咪唑基的单取代、双取代和三取代的大环三胺(TACN)衍生物配体,并根据溶解度的不同将它们分开。对于全取代的大环三胺衍生物,合成的关键在于控制反应物的物质的量之比,用大环三胺与稍多于3倍量的亲电试剂反应便可得到。而对于部分取代的大环三胺衍生物,则还需要控制诸如加料次序和速度、反应时间、溶剂等反应条件。该方法的缺点是副产物较多、提纯繁琐,且产率不高。
作者用这一方法合成了十元环TACD的侧壁带有羧酸基[9]的二取代衍生物L1、三取代衍生物L2、三取代醇羟基的衍生物L3等。合成路线见图5。

图5 化合物 L1、L2、L3的合成路线
化合物L1的合成:称取0.954 g (3.85 mmol) TACD·3HCl和过量的氯乙酸1.323 g (14 mmol)溶于20 mL水中,在45℃、搅拌条件下,将1.4 g (58 mmol)LiOH分批加入,使混合液的pH值维持在10~11之间,反应48 h,放置至室温,用6 mol·L-1的HCl调pH值为2,在旋转蒸发器中蒸干(含有L1和L2),加入无水乙醇,L1的盐酸盐以白色沉淀形式析出,过滤,收集滤液,残渣用热乙醇洗涤2次,得L1·HCl 0.474 g,产率38.9%,m.p. 278.4~286℃。C13H24N3O6Cl元素分析实测值(理论值),%:C 44.94(44.13),H 6.37(6.19),N 12.41(12.74)。 IR(KBr,cm-1):2858 m,1726 s,1600 m,1399 s,1325 m,1213 s。1HNMR (400 MHz,D2O),δ:3.76 (6H,CH2CO),3.48 (12H,CH2NCH2),2.24 (2H,CCH2C)。MS,m/z:317.6 (M+)。
化合物L2的合成:将上述滤液以及洗涤液合并,加入少量乙醚,有白色沉淀析出,过滤除去滤渣,收集滤液,蒸干溶剂,再溶于少量的无水乙醇中,加入乙醚。重复3次,得到纯的液态配体L2。1HNMR (400 MHz,D2O),δ: 3.89 (4H,NCH2CO2),3.45 (12 H,CH2NCH2),2.17 (2H,CH2C)。MS,m/z:259.4 (M+)。
化合物L3的合成:准确称取1.26 g (5 mmol) TACD·3HCl,将其溶解在2 mL水中,另加入0.6 g(15 mmol) NaOH,因NaOH与TACD·3HCl中的HCl剧烈反应,有刺激性的白色烟雾出现。稍后固体物质全部溶解,再在上述水溶液中加入5 mL乙醇,搅拌约2 min后放入冰箱中过夜。将溶液过滤,除去结晶的NaCl,然后将滤液放置在0℃以下(冰水浴)。称取1 g(0.017 mmol)环氧丙烷,缓慢滴入到上述滤液中(因环氧丙烷的沸点很低,极易挥发,因此滴加过程一定要缓慢。环氧丙烷与TACD的反应为放热反应,所以放出的热量有可能使环氧丙烷挥发掉)。将滴加完毕的溶液密闭在具塞锥形瓶中(一定要密闭,以确保反应体系中的环氧丙烷能彻底反应完全),静置24 h。然后将溶液进行旋蒸,以除去溶液中的乙醇和少量水。最后得到略带黄色的油状物,该油状物中含有痕量的NaCl。将油状物溶解在最少量的异丙醇中,过滤,将滤液旋蒸,得到纯的配体三-(2-羟基丙基)-1,4,7-三氮杂环癸烷(L3)0.89 g,产率52%。1HNMR (400 MHz,D2O),δ:3.9~4.3 (3H,CCHO),2.6~3.4(18H,CH2NCH2),1.8~2.2 (2H,CCH2C),1.1(9H,CCCH3O)。
2.2 经Ts保护-去保护步骤取代法[21~23]
该法适用于合成部分取代的大环三胺衍生物,反应路线见图6。
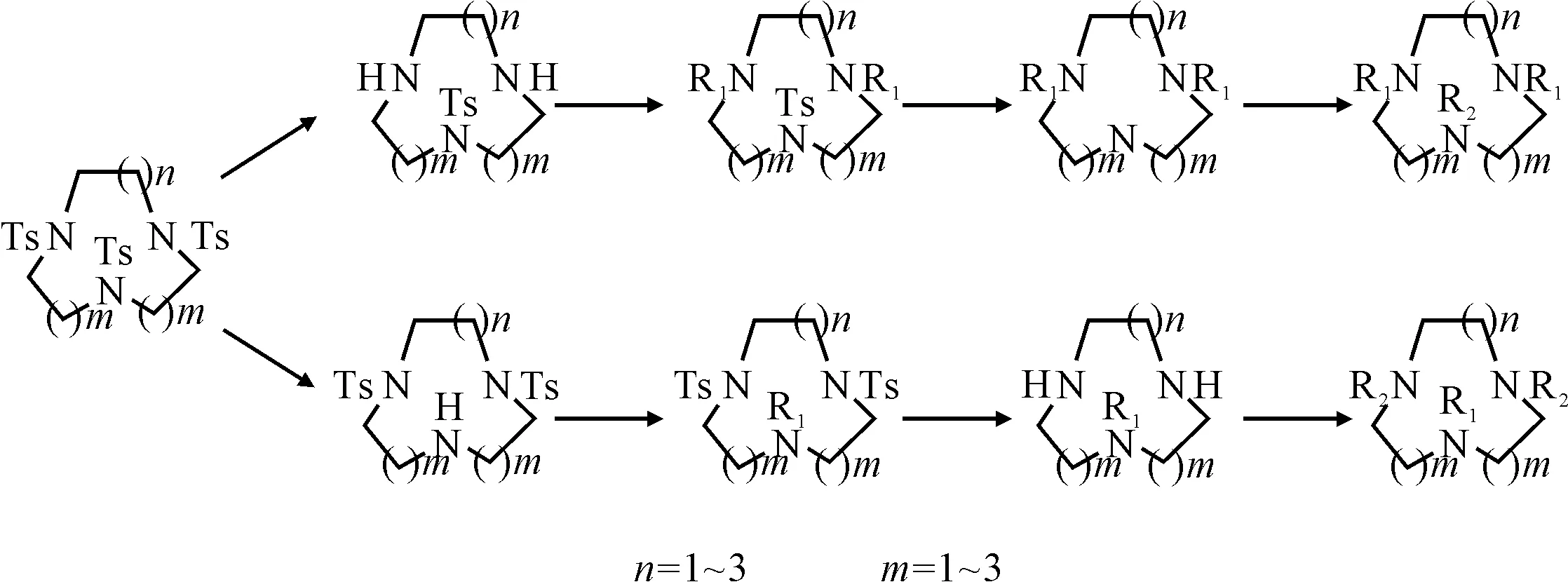
图6 Ts基部分保护的大环三胺衍生物的合成路线
该方法的优点是,根据需要可在不同部位进行Ts基保护,然后再脱保护,得到二取代和单取代的大环三胺衍生物以及不对称取代的衍生物。缺点是反应步骤较多,在Ts基去保护的过程中,某些活性侧链会发生变化。
2.3 经原胺合成法[24~28]
原胺又称三环三氨基甲烷(Ⅶ),是由大环三胺与原甲酸乙酯[HC(OEt)3]或二甲基甲酰胺二甲基缩醛[(CH3O)2CHN(CH3)2]反应[29~31]制得的。由于原胺只能在一个氮上发生反应,所以该方法可由原胺与二氯代烃等亲电试剂以2∶1的量进行反应而生成双环化合物,也可首先由原胺与亲电试剂以1∶1的量进行反应生成单取代的衍生物,然后再和另一种亲电试剂进行反应而生成带有各种不同基因的混合侧链的大环三胺衍生物,见图7。因此,该方法适合于合成双环化合物及侧壁带有不同基团的混合侧链的大环三胺衍生物。该方法的缺点是原胺的合成比较困难、产率不高,其应用并不广泛。

图7 大环三胺衍生物的原胺合成法合成路线
3 结语
由于大环三胺是一类很有用的小环配体,以其为基本骨架可以设计合成各种不同的配体,在分子设计、生物酶模拟以及工业生产方面具有广阔的研究和应用前景。对大环三胺单体及其衍生物的合成方法进行了探讨,可为大环三胺类化合物的相关研究提供参考。
参考文献:
[1] Bao S S,Chen G S,Wang Y,et al.Immobilization of triazacyclononane into the metal phosphonate Backbones[J].Inorg Chem,2006,45(3):1124-1129.
[2] Wang C F,Zuo J L,Bartlett B M,et al.Symmetry-based magnetic anisotropy in the trigonal bipyramidal cluster [Tp2(Me3tacn)3Cu3Fe2(CN)6]4+[J].J Am Chem Soc,2006,128(22): 7162-7163.
[3] Romakh V B,Therrien B,Fink G S,et al.Dinuclear manganese complexes containing chiral 1,4,7-triazacyclononane-derived ligands and their catalytic potential for the oxidation of olefins,alkanes,and alcohols[J].Inorg Chem,2007,46(4):1315-1331.
[4] Alexander V.Design and synthesis of macrocyclic ligands and their complexes of lanthanides and actinides[J].Chem Rev,1995,95(2):273-342.
[5] Tei L,Bencini A,Blake A J,et al.Co-ordination chemistry of amino pendant arm derivatives of 1,4,7-triazacyclononane[J].Dalton Trans,2004,(13): 1934-1944.
[6] 刘羿,向清祥,游劲松,等.双核配合物作为人工酶的新进展[J].化学研究与应用,2001,13(6): 605-610.
[7] Muller A,Peters F,Pope M T,et al.Polyoxometalates: Very large clusters-nanoscale magnets[J].Chem Rev,1998,98(1): 239-272.
[8] 郭惠,王晓莉,李珺,等.大环三胺铜(Ⅱ)配合物催化羧酸酯水解动力学研究[J].无机化学学报,2008,24(1): 37-42.
[9] Guo H,Shao X J,Li J,et al.Synthesis,structures and properties of cobalt(Ⅲ) and iron(Ⅲ) complexes with a new triazamacrocycle,1,4-diacetate-l,4,7-triazacyclodecane[J].J Chem Coord,2008,61(22):3610-3619.
[10] Guo H,Li J,Ren Y W,et al.Two novel two-dimensional frameworks with channels built from hydrogen bonds: Structures and properties study on copper(Ⅱ) and nickle (Ⅱ) complexes of the macrocyclic ligand 1,4,7-triazacyclodecane (TACD)[J].Journal of Chemical Crystallography,2007,37(4):255-263.
[11] Guo H,Ren Y W,Li J,et al.Acetonitriledichloro(1,4,7-triazacyclodecane) cobalt(Ⅲ) perchlorate[J].Acta Crystal Section E,2005,E61(Part 6):m1080-m1081.
[12] Guo H,Zhu H Y,He X L,et al.Crystal structures and theoretical calculation of Zn(Ⅱ) and Cu(Ⅱ) supramolecular complexes based on macrocyclic triamine ligand 1,4,7-triazacyclodecane (TACD)[J].Chinese Journal of Chemistry,2007,25(6): 784-790.
[13] Koyama H,Yoshino T.Syntheses of some medium sized cyclic triamines and their cobalt(Ⅲ) complexes[J].Bull Chem Soc Jpn,1972,45(2):481-484.
[14] Yang R,Zompa L J.Metal complexes of cyclic triamines.1.Complexes of 1,4,7-triazacyclononane ([9]aneN3) with nickel(Ⅱ),copper(Ⅱ),and zinc(Ⅱ)[J].Inorg Chem,1976,15(7):1499-1502.
[15] Chavez F,Sherry A D.A simplified synthetic route to polyaza macrocycles[J].J Org Chem,1989,54(12):2990-2992.
[16] 张闻.三氮小环及其苯并咪唑衍生物的合成与配合物的研究[D].南京:南京大学,2000.
[17] Richman J E,Atkins T J.Nitrogen analogs of crown ethers[J].J Am Chem Soc,1974,96(7): 2268-2270.
[18] Graeme H S,Rodney J G.Improved Richman-Atkins syntheses of cyclic polyamines particularly 1,4,7-triazacyclononane (TACN) and 1,4,7-triazacyclononane (TACD),with the aid of cation-exchange in purification and isolation[J].Aust J Chem,1984,37(5):959-970.
[19] Vaira M D,Mani F,Stoppioni P.A general and very straightforward route to the selectiveN-functionalization of 1,4,7-triazacyclononane with imidazole groups.Crystal structure determinations of nickel(Ⅱ),copper(Ⅱ) and zinc(Ⅱ) complexes[J].Inorg Chim Acta,2000,303(1):61-69.
[20] Li Q X,Luo Q H,Li Y Z,et al.A study on mono-,bis- and tris-N-functionalized 1,4,7-triazacyclononane with benzimidazolyl groups and their nickel(Ⅱ) complexes[J].Inorg Chim Acta,2005,358(3):504-512.
[21] Wieghardt K,Tolksdorf I,Herrmann W.Coordination chemistry of the bimacrocyclic,potentially binucleating ligand 1,2-bis(1,4,7-triaza-1-cyclononyl)ethane (dtne).Electrochemistry of its first transition series metal(Ⅱ,Ⅲ) complexes.Characterization of the new hemerythrin model complex [Fe2(dtne)(μ-O)(μ-CH3CO2)2]Br2·H2O[J].Inorg Chem,1985,24(8):1230-1235.
[22] 王红军,吴成泰.桥连双-(三氮杂环壬烷)化合物的合成[J].有机化学,1999,19(2):171-175.
[23] Sessler J L,Sibert J W.On the synthesis of unsymmetrical bis(macrocyclic) ligands[J].Tetrahydron,1993,49(39):8727-8738.
[24] Young M J,Chin J.Dinuclear copper(Ⅱ) complex that hydrolyzes RNA[J].J Am Chem Soc,1995,117(42):10577-10578.
[25] Zhang X P,Hsieh W Y,Margulis T N,et al.Binuclear copper(Ⅱ) complexes of bis(1,4,7-triazacyclononane) ligands containing tri- and tetramethylene bridging groups.An equilibrium and structural study[J].Inorg Chem,1995,34(11):2883-2888.
[26] Haidar R,Ipek M,Gupta B D,et al.Copper(Ⅱ) complexes of bis(1,4,7-triazacyclononane) ligands with polymethylene bridging groups: An equilibrium and structural study[J].Inorg Chem,1997,36(14): 3125-3132.
[27] DasGupta B,Haidar R,Hsieh W Y,et al.Zinc(Ⅱ) complexation with bis(1,4,7-triazacyclononane) ligands containing polymethylene linker groups.An equilibrium and structural study[J].Inorg Chim Acta,2000,306(1): 78-86.
[28] Graham B,Grannas M J,Hearn M T W,et al.Coordination chemistry of a novel tetramacrocyclic ligand derived from 1,4,7-triazacyclononane: Synthesis,structure,and properties of nickel(Ⅱ) and copper(Ⅱ) complexes[J].Inorg Chem,2000,39(6): 1092-1099.
[29] Weisman G R,Vachon D J,Johnson V B,et al.Selective N-protection of medium-ring triamines[J].J Chem Soc Chem Commun,1987,(12):886-887.
[30] Weisman G R,Johnson V,Fiala R E.Tricyclic orthoamides: Effects of lone-pair orientation upon NMR spectra[J].Tetrahedron Letters,1980,21(38): 3635-3638.
[31] Atkins T J.Tricyclic trisaminomethanes[J].J Am Chem Soc,1980,102(20): 6364-6365.

