新月弯孢霉KA-91转化异羟基洋地黄毒苷元的研究
强心苷是一类对心脏具有显著生物活性的甾体皂苷类化合物,具有增强心肌收缩力等作用,是临床上用于治疗心力衰竭等疾病的一线辅助药物[1]。但由于其排泄缓慢、容易在体内蓄积、治疗剂量与中毒剂量非常接近等缺点,限制了其应用[2]。地高辛是一种临床常用的强心苷类药物,由异羟基洋地黄毒苷元在C3位连接三个洋地黄毒糖构成。
采用微生物转化法对强心苷类药物进行结构修饰已成为强心苷类药物研究的热点领域之一[3~6]。有文献报道蓝色犁头霉(Absidiacoerulea)、雅致放射毛霉(Actinomucorelegans)ATCC 6476、米曲霉(Aspergilliusoryzae)、匍枝根霉(Rhizopusstolonifer)ATCC 6227在洋地黄毒苷元的1β、5β、7β位点上具有羟基化能力。球毛壳霉菌(Chaetomiumglobosum)MN-211转化洋地黄毒苷得到7β-羟基化产物;蝇卷霉(Circinellamuscae)MN-120转化洋地黄毒苷得到12β-羟基化产物[6]。
新月弯孢霉(Curvularialunata)细胞内含有P450酶系,被广泛用于甾体化合物的羟基化过程[7,8]。异羟基洋地黄毒苷元在分子结构上与洋地黄毒苷元的结构相似。作者在此以地高辛和异羟基洋地黄毒苷元为底物,利用新月弯孢霉KA-91对其进行转化,并对转化工艺进行了初步优化研究。
1 实验
1.1 材料
1.1.1 菌种
新月弯孢霉KA-91 ,天津科技大学微生物制药研究室保存。
1.1.2 培养基
斜面培养基:PDA培养基。
发酵培养基(g·L-1): 葡萄糖22,酵母膏4,牛肉膏5,pH值6.5。
1.1.3 药品、试剂和仪器
地高辛(纯度98%),西安山川生物技术有限公司;异羟基洋地黄毒苷元(纯度98%),自制;氯仿、乙酸乙酯、无水乙醇等均为市售分析纯;甲醇为色谱纯;薄层硅胶板GF254,德国默克公司。
HYG-Ⅱ型回旋式恒温调速摇瓶柜;YJ-875S型医用净化台;WS2-134-75型电热恒温培养箱;GB204型电子分析天平;Gilson型微量取样器;三用紫外分析仪;Agilent1100型高效液相色谱分析仪;Bruker AV-600型核磁共振仪;傅立叶变换离子回旋共振质谱FT-ICR-MS。
1.2 方法
1.2.1 异羟基洋地黄毒苷元的制备
采用稀盐酸水解地高辛制备异羟基洋地黄毒苷元。用含0.02 mol·L-1HCl的80%乙醇溶液水解20 mg·mL-1地高辛,水浴80℃回流酸解2~3 h[9],用氯仿萃取,硅胶柱分离纯化,得白色粉末,经1HNMR、13CNMR和高分辨质谱检测,鉴定其为异羟基洋地黄毒苷元。
1.2.2 菌体的培养
新月弯孢霉KA-91接种于斜面培养基,置于28℃恒温培养箱培养7 d,于4℃冰箱保存备用。用无菌水洗下保藏斜面霉菌的孢子,制备浓度为3.0×106个·mL-1的孢子悬液。取1 mL孢子悬液接种到含有30 mL发酵培养基的250 mL三角瓶中, 于28℃、180 r·min-1摇床培养24 h。
1.2.3 异羟基洋地黄毒苷元的生物转化
菌体培养24 h后,分别加入用无水乙醇溶解配制的135 mmol·L-1地高辛溶液和135 mmol·L-1异羟基洋地黄毒苷元溶液,于28℃、180 r·min-1继续培养48 h,终止发酵。
1.2.4 产物的分离提取与纯化
转化结束后,抽滤,分离菌丝体和发酵液,分别用50 mL乙酸乙酯萃取菌丝体和发酵液3次,合并萃取液,无水Na2SO4干燥,减压浓缩。采用硅胶色谱柱分离产物,洗脱剂为氯仿-甲醇(25∶1)。
1.3 分析与检测
采用TLC薄层色谱法分析。展开剂为氯仿-甲醇-苯(10∶2∶5),10%硫酸乙醇溶液喷雾显色,其中异羟基洋地黄毒苷元的Rf值为0.325,产物的Rf值为0.388。
HPLC法检测转化率。在室温下,流动相为甲醇-水( 55∶45),流量为0.7 mL·min-1,检测波长为220 nm。
产物纯品的1HNMR和13CNMR采用Brucker AV-600 型核磁共振仪测定,以TMS为内标,样品溶解在C5D5N中。产物纯品溶于甲醇中,用于FT-ICR-MS检测。
2 结果与讨论
2.1 结构鉴定
新月弯孢霉KA-91对地高辛和异羟基洋地黄毒苷元的转化结果表明,新月弯孢霉KA-91对地高辛不具有转化能力,对异羟基洋地黄毒苷元具有转化能力,经结构鉴定转化产物为3-羰基-异羟基洋地黄毒苷元。
异羟基洋地黄毒苷元:白色粉末,不溶于氯仿,易溶于吡啶,分子式C23H34O5。FT-ICR-MS,m/z:413.2298 [M+ Na]+1。1HNMR(C5D5N),δ:0.98(3H,S,Me-18),1.23(3H,S,Me-19),3.73( 1H,m,H-17),4.3(1H,S,H-3),5.25(1H, d,H-21a,J=18),5.10(1H,d ,H-21b,J=18),6.22(1H,S,H-22)。13CNMR(C5D5N),δ:30.06(C-1),28.20 (C-2), 65.60 (C-3),33.87 (C-4),36.33 (C-5),26.88 (C-6),21.96 (C-7),41.35 (C-8),32.45 (C-9),35.31 (C-10),30.45 (C-11),74.28 (C-12),56.37 (C-13),85.04 (C-14),33.13 (C-15),27.46 (C-16),46.22 (C-17),9.68 (C-18),23.64 (C-19),174.18 (C-20),73.55 (C-21),116.98 (C-22),176.02 (C-23)。波谱数据与文献[6]一致。
3-羰基-异羟基洋地黄毒苷元:白色粉末,不溶于氯仿,易溶于吡啶,分子式C23H32O5,FT-ICR-MS,m/z:411.2142 [M+ Na]+1。1HNMR(C5D5N),δ:0.88(3H,S,Me-18),1.24(3H,S,Me-19),3.74( 1H,m,H-17),5.25(1H, d,H-21a,J=18),5.11(1H,d ,H-21b,J=18),6.23(1H,S,H-22)。13CNMR(C5D5N),δ:36.97 (C-1),37.27 (C-2),211.19 (C-3),42.41 (C-4),43.97 (C-5),27.06 (C-6),21.91 (C-7),41.58 (C-8),33.57 (C-9),35.37 (C-10),30.80(C-11),74.43 (C-12),56.85 (C-13),85.29 (C-14),30.87 (C-15),27.91 (C-16),46.66(C-17),10.15(C-18),22.57(C-19),174.63 (C-20),74.02 (C-21),117.58 (C-22),176.32 (C-23)。波谱数据与文献[6]一致。
2.2 新月弯孢霉KA-91转化异羟基洋地黄毒苷元反应
新月弯孢霉KA-91对异羟基洋地黄毒苷元的转化反应如图1所示。
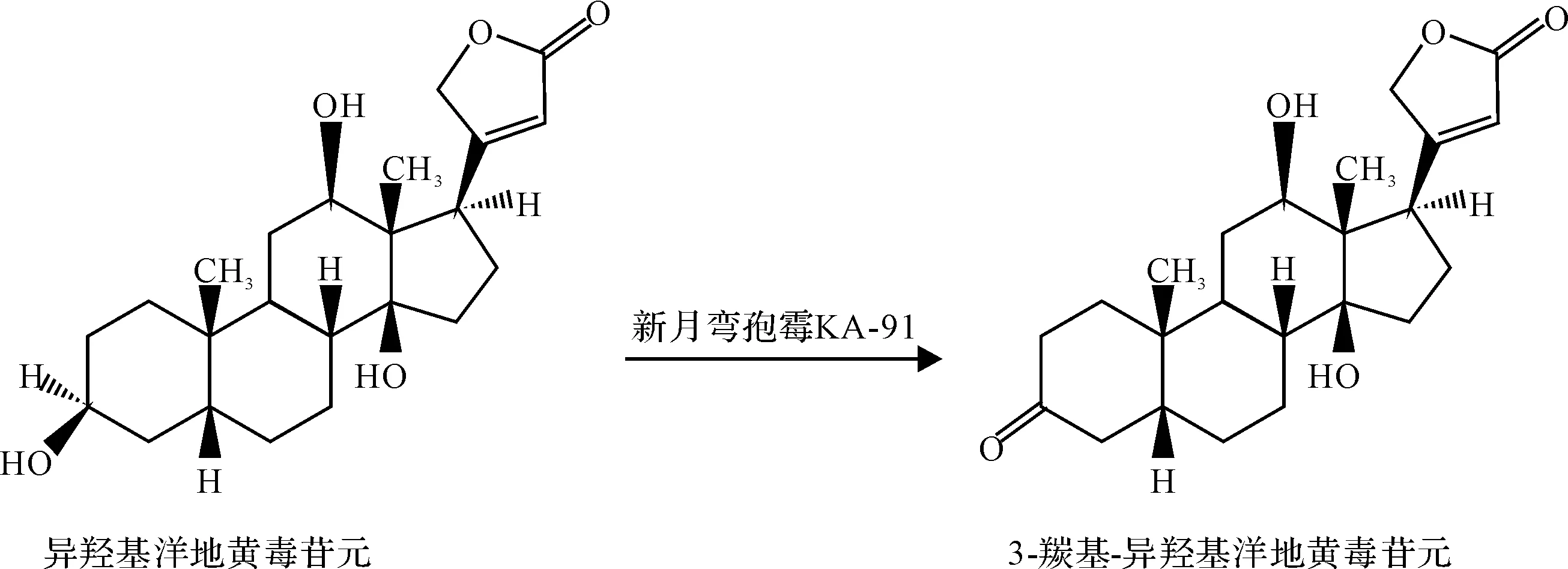
图1 新月弯孢霉KA-91对异羟基洋地黄毒苷元的转化
由图1可知,新月弯孢霉KA-91可以特定位点地氧化异羟基洋地黄毒苷元C3-OH转为羰基,但不氧化C12-OH。
2.3 转化条件的优化
2.3.1 底物浓度对转化的影响
新月弯孢霉KA-91转化异羟基洋地黄毒苷元时,底物浓度对转化率的影响见图2。
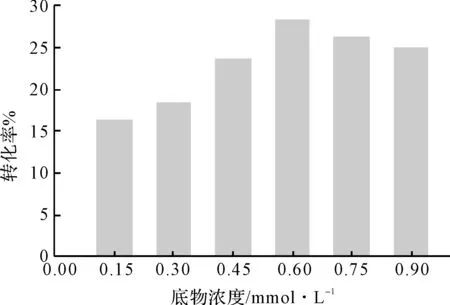
图2 底物浓度对转化率的影响
由图2可知,底物浓度在0.15~0.90 mmol·L-1范围内,随着其浓度的增加,转化率先上升再下降;在底物浓度为0.60 mmol·L-1时,转化率达到最大值27.3%。因此,选择新月弯孢霉KA-91转化异羟基洋地黄毒苷元的最适底物浓度为0.60 mmol·L-1。
2.3.2 培养基初始pH值对转化的影响(图3)
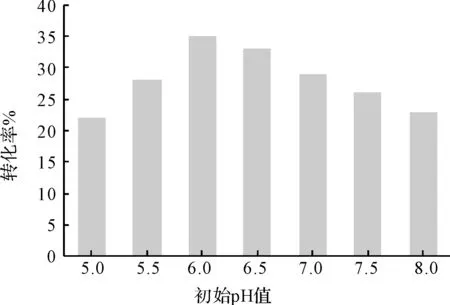
图3 培养基初始pH值对转化率的影响
由图3可知,培养基初始pH值在5.0~8.0之间时,转化率先上升再下降;在培养基的初始pH值为6.0时,转化率达到最大值38%。因此,选择新月弯孢霉KA-91转化异羟基洋地黄毒苷元的最适pH值为6.0。
2.3.3 转化温度对转化的影响(图4)
由图4可知,转化温度在28℃时转化率最高。这是因为新月弯孢霉KA-91的适宜生长温度为26~30℃,在28℃时酶的表达量最大,转化率最高;温度超过28℃后虽然生物量有所增加但酶的表达量反而下降。因此,选择新月弯孢霉KA-91转化异羟基洋地黄毒苷元的最适转化温度为28℃。
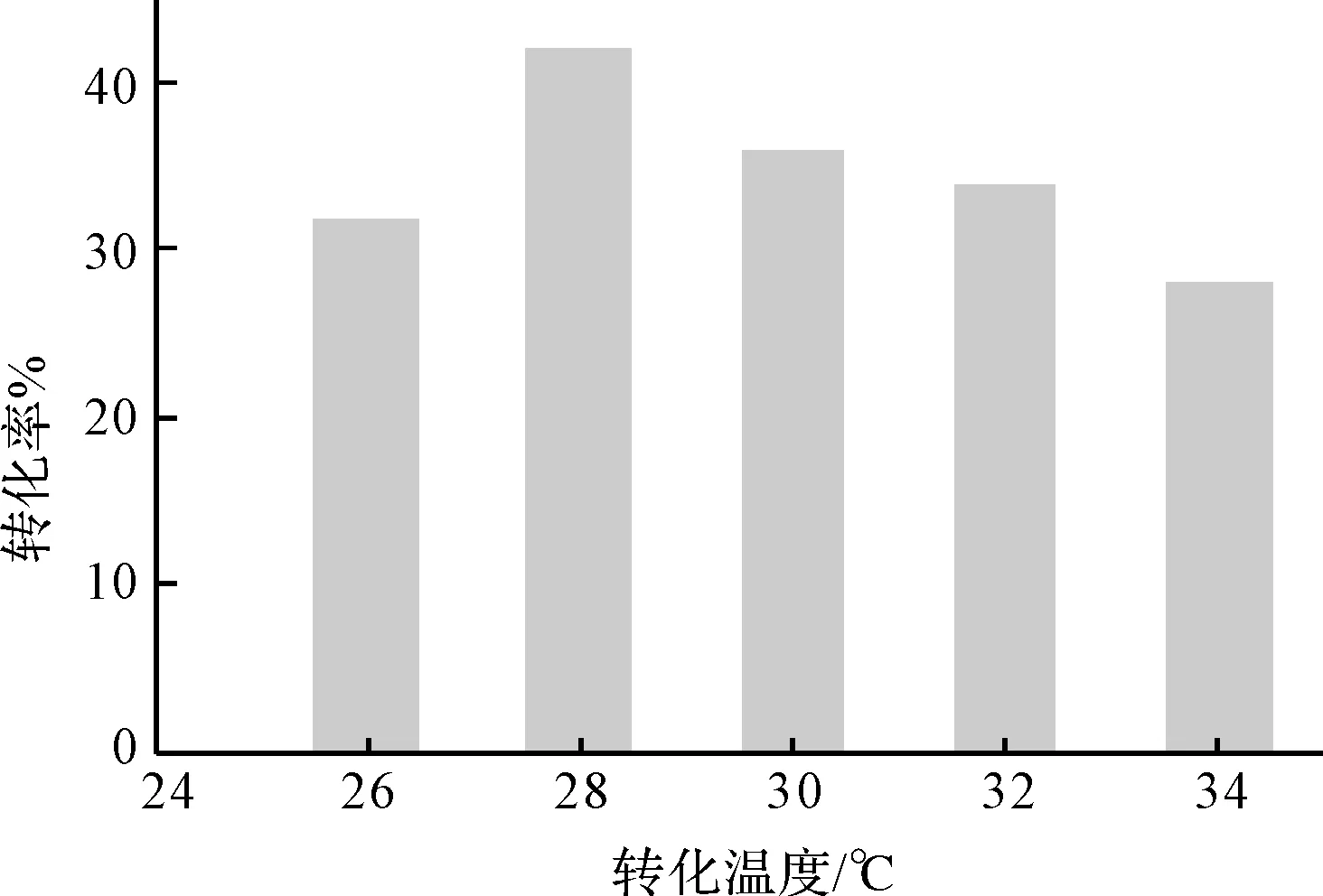
图4 转化温度对转化率的影响
2.3.4 转化过程曲线
新月弯孢霉在培养24 h后进入对数生长期[7],此时,加入底物,考察新月弯孢霉KA-91对异羟基洋地黄毒苷元的转化过程,结果见图5。

图5 新月弯孢霉KA-91转化生成3-羰基-异羟基洋地黄毒苷元的过程曲线
由图5可知,在转化24~54 h过程中,随着转化时间的延长,转化率相应上升;当转化54 h时,转化率最高达到40%;随着转化时间的继续延长,菌体衰老,转化率不再上升。因此,选择新月弯孢霉KA-91对异羟基洋地黄毒苷元的最适转化时间为54 h。
3 结论
(1)新月弯孢霉KA-91对地高辛没有转化能力,对异羟基洋地黄毒苷元具有转化能力,转化产物通过1HNMR、13CNMR和傅立叶变换高分辨质谱分析,确定其为3-羰基-异羟基洋地黄毒苷元。
(2)确定新月弯孢霉KA-91转化异羟基洋地黄毒苷元的最优工艺为:新月弯孢霉KA-91在28℃、180 r·min-1摇床培养24 h,培养基初始pH值为6.0,装液量为50 mL·(250 mL)-1,加入底物的无水乙醇溶液(135 mmol·L-1),使转化液中异羟基洋地黄毒苷元初始浓度达到0.60 mmol·L-1,转化54 h。此时,转化率可达到40%。
参考文献:
[1] 宋晓凯.天然药物化学[M].北京:化学工业出版社,2004:206-207.
[2] 尤中良.家庭慎用强心药[J].医药与保健,2004,(9):56-57.
[3] Döller P C, Alfermann A W, Reinhard E. Biotransformation of cardenolides by cell suspension cultures ofDigitalislanataandThevetianeriifolia[J].Planta Med,1977,31(1):1-6.
[4] Alfermann A W, Schuller I, Reinhard E.Biotransformation of ca-rdiac glycosides by immobilized cells ofDigitalislanata[J].Planta Med,1980,40(2):218-223.
[5] Kreis W, Reinhard E.12β-Hydroxylation of digitoxin by suspension-culturedDigitalislanatacells: Production of digoxin in 20-litre and 300-litre air-lift bioreactors[J].J Biotechnol,1992,26(2-6):257-273.
[6] Pádua Rodrigo M, Oliveira Alaíde B, Souza Filho José D, et al. Biotransformation of digitoxigenin byFusariumciliatum[J]. J Braz Chem Soc, 2005,16(3B):614-619.
[7] 王敏,郭亚文,卢文玉,等.氢化可的松高转化菌株的选育及其发酵条件[J].应用与环境生物学报,2004,10(5):663-666.
[8] 冯冰,马百平,康利平,等.新月弯孢霉对重楼皂苷的生物转化[J].中草药,2005,36(7):978-983.
[9] 姚新生.天然药物化学[M].北京:人民卫生出版社,2004:321-327.

