氨基酸在铜离子浊点萃取中的应用
环境样品组成复杂,在测定金属离子时干扰较多,且环境样品中金属离子的含量一般较低,在进行分析前,需要进行萃取、浓缩、富集。在用浊点萃取富集铜离子进行紫外分光光度法检测过程中,络合剂一般选择传统的显色剂,如PAN、TAN、5-Br-PADN等[1,2],这些络合剂都是有机试剂,误差较大。鉴于生物试剂专一性和高效性的特点,若用氨基酸代替传统络合剂对铜离子进行配合,可以排除其它常见金属离子的干扰,更有利于环境样品中铜离子的测定。氨基酸配合物是氨基酸和金属离子相结合而形成的较稳定的化合物[3],在pH值为8~10时,配位比为1∶2的络合物较配位比为1∶1的络合物更稳定,并且容易生成和分离纯化[4,5]。
作者在此以氨基酸为络合剂,用Triton X-100非离子表面活性剂萃取痕量铜离子,将浊点萃取与紫外分光光度法联用,测定了环境水样中痕量铜离子。
1 实验
1.1 试剂与仪器
Cu2+标准溶液:1.0 mol·L-1,使用时稀释至工作浓度0.001 mol·L-1;表面活性剂:Triton X-100,50.0 mg· mL-1;络合剂:甘氨酸、谷氨酸、苏氨酸、丙氨酸、脯氨酸、缬氨酸、天冬氨酸,0.001 mol·L-1;硼酸盐缓冲溶液;NaOH溶液;饱和NaCl溶液。
TU-1800型紫外分光光度计。
1.2 方法
1.2.1 甘氨酸铜配合物最大吸收波长的确定
取1支试管加入0.001 mol·L-1的甘氨酸溶液1.0 mL,然后依次加入0.5 mL 0.001 mol·L-1Cu2+标准溶液、1.0 mL 50.0 mg· mL-1Triton X-100溶液、4.0 mL饱和NaCl溶液,用二次蒸馏水稀释并用硼酸盐缓冲溶液(或NaOH溶液)调节pH值为9.0,定容至25.0 mL,摇匀,于65℃恒温10 min后,以4000 r· min-1离心15 min分相,分离后,加入少许蒸馏水于富胶束相中,振荡,定容至5.0 mL,静置。用紫外分光光度计在200~300 nm处测定吸光度,确定最大吸收波长。以等量甘氨酸溶液为空白对照。
1.2.2 最佳络合剂的选择
取7支试管各加入0.001 mol·L-1的氨基酸溶液0 mL、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL,处理方法同1.2.1。用紫外分光光度计在最大吸收波长230 nm处测定吸光度,绘制氨基酸铜配合物的光吸收曲线,选择最佳络合剂。以等量氨基酸溶液为空白对照。
1.2.3 标准曲线的绘制
选用甘氨酸作为络合剂,配制一系列浓度的铜离子试剂,经浊点萃取之后,进行紫外吸光度的测定,绘制标准曲线。
1.2.4 环境水样中铜离子分析
国标GB 7474-87规定地表水中铜离子的检测方法为二乙基二硫代氨基甲酸钠分光光度法。本实验用氨基酸代替二乙基二硫代氨基甲酸钠作络合剂,参照国标方法取水,用蒸馏、消解等前处理去除有机物,以避免萃取剂对有机物尤其是苯酚的萃取,并将实验数据与国标方法进行比较。
2 结果与讨论
2.1 最大吸收波长
在种类繁多的氨基酸中,只有色氨酸、酪氨酸、苯丙氨酸在近紫外区(200~400 nm)有吸收光的能力。但与铜离子络合后,大多数氨基酸铜配合物在近紫外区都有一定的吸收,且氨基酸铜配合物的吸收峰比单一氨基酸的吸收峰要明显得多,基本上可以忽略氨基酸的吸收峰[5~14]。本实验以甘氨酸为例,测定不同波长下甘氨酸铜配合物的吸光度,如图1所示。
由图1可知,甘氨酸铜配合物的最大吸收波长为230 nm。
2.2 最佳络合剂
7种氨基酸(甘氨酸、谷氨酸、苏氨酸、丙氨酸、缬氨酸、脯氨酸、天冬氨酸)铜配合物的光吸收曲线如图2所示。

图1 不同波长下甘氨酸铜配合物的吸光度

图2 氨基酸铜配合物的光吸收曲线
当氨基酸与铜离子的浓度比为2∶1时,溶液达到了较高的吸光度值,再增加氨基酸溶液的量,吸光度的增加并不明显,表明此时氨基酸与铜离子的配合反应达到平衡,反应基本完成。此外当配位比大于2∶1时,氨基酸的存在会影响光的吸收。
由图2可知,7种氨基酸都能够与铜离子发生2∶1的配位反应,并且因为氨基酸种类不同,氨基酸铜配合物吸光度的强弱也不同。
某些氨基酸(如脯氨酸),与铜离子的配合物的吸光度并不大,但是达到反应平衡后曲线的线性较好;而另外一些氨基酸(如丙氨酸)与铜离子的配合物尽管吸光度较大,但是达到反应平衡后曲线的线性并不太好,平台并不明显。综合考虑,既要能够达到比较明显的吸光度又要曲线线性相对较好,最终选择甘氨酸作为用于铜离子浊点萃取的络合剂。
2.3 标准曲线(图3)
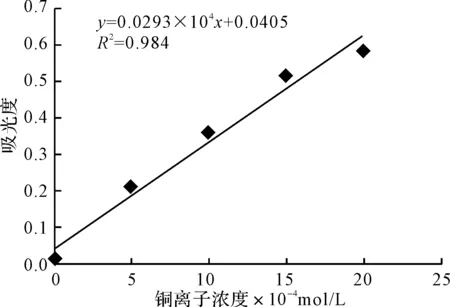
图3 铜离子的标准曲线
由图3可知,铜离子浓度与吸光度基本成正比,拟合线性回归程为:y=0.0293×104x+0.0405,相关系数R2=0.984。
根据IUPCA的定义,经过浊点萃取分离富集后,用20次空白计算,得出检出限为0.147 μg· mL-1。
2.4 环境水样铜离子分析结果
对某环境水样中铜离子分别用国标方法和浊点萃取法进行测定,结果见表1。
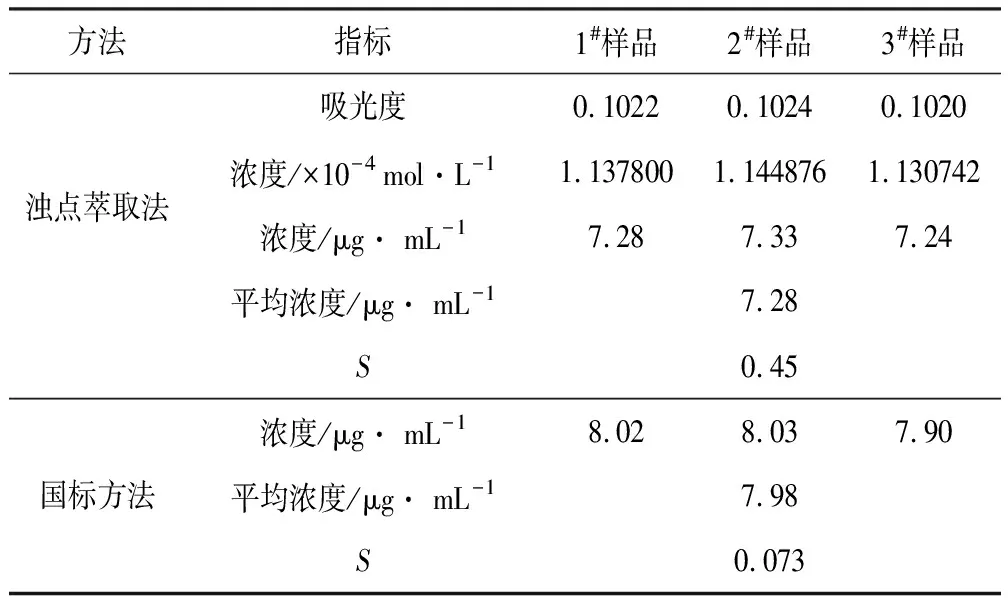
表1 国标方法和浊点萃取法的比较
由表1可知,浊点萃取法测定的环境水样中铜离子浓度为7.28 μg· mL-1,国标方法测定为7.98 μg·L-1,超过国家地表水的五类标准1.0 μg· mL-1。
3 结论
(1)7种氨基酸中,甘氨酸应用于铜离子痕量分析的性能最佳。
(2)甘氨酸作为络合剂,浊点萃取法和紫外分光光度法联合用于环境水样中痕量铜离子的测定,效果较好。
参考文献:
[1] 梁沛, 李静. 浊点萃取技术在金属离子分离和富集以及形态分析中应用的进展[J].理化检验:化学分册, 2006, 42(7): 582-587.
[2] 李静,梁沛,施踏青. 浊点萃取预富集火焰原子吸收光谱法测定水样中痕量钴[J].分析科学学报,2005,21(2):164-166.
[3] 张进霞,袁洪水,王世英,等. 紫外分光光度法在复合氨基酸铜配合物测定中的应用[J].棉花学报,2006,18(6):394-395.
[4] 林秀丽,主沉浮,邹时复. 铜-氨基酸络合物的紫外光谱性质及其应用——络合物组成及稳定常数的测定[J].分析化学,1996,24(2):175-179.
[5] 邱林友.镀铜液中铜的测定[J].电镀与涂饰,1998,17(3):41-42.
[6] 马岳,阎哲,黄骏雄. 浊点萃取在环境化学方面的应用[J].上海环境科学,2000,19(7): 319-324.
[7] 肖珊美,陈建荣,刘文涵. 浊点萃取在痕量金属元素分析中的应用[J].理化检验:化学分册,2004,40(11):682-688.
[8] 唐安娜,江冬青. 毛细管电泳分析中的样品预富集新技术[J].现代仪器,2003,10(2):9-13.
[9] 申进朝,邵学广. 浊点萃取技术及其在有机化合物分离分析中的应用[J].化学进展,2006,18(4):482-487.
[10] 马岳,阎哲, 黄骏雄. 浊点萃取在生物大分子分离及分析中的应用[J].化学进展, 2001, 13(1): 25-32.
[11] 李伟,朱自强. 环氧乙烷-环氧丙烷无规共聚物的水溶液浊点测定[J].化学工程,2001,29(5):35-38.
[12] 蒋萍初,田亮.非离子表面活性剂浊点的测点及其影响因素的研究[J].上海师范大学学报(自然科学版),1995,24(1):43-49.
[13] 房秀敏.聚醚型非离子表面活性剂的浊点及其影响因素[J].精细石油化工,1997,(2):1-5.
[14] 张纪梅. 聚醚类表面活性剂的物化性质[J].天津大学学报,2000, 32(3):331-335.

