大蕉冷诱导差减文库的构建与分析*
冯冬茹, 王宏斌, 刘 兵, 何炎明, 戚康标,王金发
(中山大学有害生物控制与资源利用国家重点实验室∥基因工程教育部重点实验室∥生命科学学院,广东 广州 510275)
低温是影响植物生长、发育及其地理分布的重要环境因素之一,是农业生产中的一种严重的自然灾害[1]。许多植物经过一段时间的非致死低温作用后,抵抗低温的能力得以增强,这种现象称为冷驯化(cold acclimation,CA)[2]。植物对低温胁迫的驯化涉及特定冷诱导基因的表达,从而抵御低温伤害。不同的植物对低温诱导的响应各有不同,不同基因型决定了植物不同的抗寒性[3]。
香蕉Musaspp.作为最大宗的高效益热带作物,在我国农业生产中占举足轻重的地位,但是,由于春冬季的寒潮入侵而出现不同程度的寒害,产量大大下降。其中风味佳、种植量大的香牙蕉(MusananaLour., AAA 群,常简称香蕉)受害最重,而大蕉(MusaparadisiacaL.,ABB 群)则受害较轻,具有明显的抗寒性。1999年12月湛江遭受了几十年一遇的冷害,有的地区温度低达2 ℃左右,香蕉(AAA群)叶片全部被冻死,大蕉虽有一定程度受害,但寒流过后,很快恢复;在4 ℃以上的地区,大蕉受影响不大,而香蕉(AAA群)大部分叶片则受冻变黄,甚至枯萎。吕庆芳等[4]发现大蕉的叶片组织细胞结构紧密度比香蕉的高,耐寒性也比香蕉强。通过SDS-PAGE图谱分析表明抗冷性较强的大蕉(ABB群)能在相对较高的低温(如10 ℃)下开始接受低温的诱导,从而更能忍耐低温的胁迫[5]。通过分析大蕉低温下基因表达的变化来分离抗寒相关基因并对其进行分子生物学研究,既探索植物抗寒性的遗传机理,又为开发基因资源和香蕉(AAA群)等经济作物的遗传改良提供有用的基因,这不仅在基础理论上具有重要意义,还具有潜在的应用价值。
1 材料与方法
1.1 材料
1.1.1 植物材料 实验用的大蕉(MusaparadisiacaL.,ABB 群)采自广东省广州市番禺区。
1.1.2 菌株E.coliDH5α[supE44ΔlacU169 (φ80lacZΔM15)hsdR17recA1endA1gyrA96thi-1relA1]菌株由本实验室保存。
1.1.3 主要试剂和仪器 植物RNA提取试剂购自Invitrogen公司;纯化mRNA试剂盒购自QIAGEN公司;PCR-SelectTMcDNA Subtraction Kit购自Clontech公司;[α-32P] dCTP购自北京亚辉生物医学工程公司;随机引物标记试剂盒购自Gibco公司;LATaqDNA聚合酶、SuperScript II反转录酶和pMD 18-T 载体购自大连宝生物公司。PCR扩增仪为2400型PCR仪(Pekin Elmer公司),凝胶成像系统为Fluor-STMMultilmager(BIO-RAD公司),激光扫描成像系统为Typhoon系列多功能激光扫描成像系统(GE公司)。
1.2 实验方法
1.2.1 材料处理 取健壮的株高40~50 cm的广东大蕉幼苗,分两组,第1组为对照组,在26~32 ℃下培养,自然光照,相对湿度60%;第2组为低温处理组,夜晚在培养箱中10 ℃处理12 h。处理完毕后剪取各组幼苗新展开的第2片真叶,用液氮迅速冷冻后,于-70 ℃冰箱中保存。
1.2.2 总RNA的提取和mRNA的纯化 采用Invitrogen的ConcertTMPlant RNA Reagent按说明书的方法提取总RNA,用琼脂糖凝胶电泳检测总RNA完整性,用核酸蛋白检测仪检测总RNA的浓度及纯度;用QIAGEN公司的Oligotex mRNA Mini Kits从总RNA中分离mRNA,用3 mol/L NaAc和无水乙醇浓缩纯化的mRNA。
1.2.3 抑制差减杂交 参照CLONTECH PCR-SelectTMcDNA Subtraction Kit使用手册,设定以经低温处理大蕉的mRNA为模板合成的cDNA作为检测子,以未经处理大蕉的mRNA为模板合成的cDNA作为驱赶子,进行正向差减杂交;反之为反向差减杂交;差减杂交的对照实验并列进行。
1.2.4 差减文库的构建 将第二次PCR 扩增得到的cDNA 产物用DNA快速纯化试剂盒纯化后,取8 μL(20 μL的体系)连接到TaKaRa的pMD 18-T 载体上,16 ℃过夜。第2天,取5 μL连接产物转化DH5α感受态受体菌,涂板后37 ℃培养过夜。基于蓝白斑筛选法,从LB平板挑取白色阳性克隆菌落接种到300 μL含Amp(50 μg·mL-1)的LB液体培养基中,37 ℃摇床培养过夜,建立抑制差减cDNA文库。采用菌液PCR对文库进行初步鉴定。
1.2.5 差异筛选差减文库 取构建抑制差减cDNA文库的重组子1 μL菌液进行PCR扩增(25 μL的体系),w=2.0%琼脂糖凝胶电泳检测。分别取2 μL PCR产物点2套重复的cDNA拷贝膜,并分别以正向和反向差减产物作为阳性对照,以水作为阴性对照。依据Invitrogen公司RadPrimer DNA Labeling System Kit 的说明利用 [α-32P] dCTP进行标记,共标记2个探针:正向差减产物探针;反向差减产物探针。
将制备好的膜与探针进行杂交[6],然后置于磷屏内压膜1 h再用激光扫描成像系统成像。
1.2.6 DNA测序和BLAST分析 选取仅与正向差减探针有信号及与正向差减探针杂交信号明显强于反向差减探针的克隆(信号强度在2~3倍以上),送上海博亚公司用T7或M13r引物单向测序。所获序列去除载体和接头序列,获得EST。采用NCBI (http://www.ncbi.nih.gov) 的BLASTn 在线序列比对工具进行同源性检索分析和功能注释分析。
1.2.7MpRci基因的表达分析 参照测序得到的MpRci的EST序列设计引物:RCI-124S,5′-ATC CTC CCT CCG CTG GGC GTC TT-3′;RCI-333A,5′-CAG AGC AGG TAG GAA TCG TCC ATA G-3′。以蕉类Actin基因作为内参:ACT-S,5′-TGT AGG TGA TGA GGC CCA AT -3′;ACT-A,5′-ATA CCT GTG GTA CGT CCG CT-3′。先按前面所述方法分别提取各样品的总RNA,然后使用SuperScript II 反转录酶按说明书的方法进行反转录。合成的cDNA用于进行基因表达的PCR分析。进一步用Band Leader软件进行灰度分析,然后通过比较不同样品目的基因的灰度值与内参的灰度值的比值来分析基因表达量的变化。
2 结果与分析
2.1 RNA的检测及二次PCR产物分析
总RNA和mRNA经琼脂糖凝胶电泳法检测显示完整性良好,完全符合进行下游工程的要求。运用SSH技术,进行正向和反向差减杂交,差减得到的cDNA群体,经过2次PCR选择性扩增后,进行凝胶电泳分析(图1),结果表明,主要的PCR差减产物的核苷酸长度在0.2~2 kb之间,且有数条条带,表明差减杂交后一些共有cDNA片段已被扣除掉。差减杂交的对照结果也说明差减效率较高。
2.2 差减cDNA文库的构建及阳性克隆的筛选
应用T/A克隆法,将正向差减PCR产物连入T-载体,转化大肠杆菌,构建了大蕉冷诱导差减cDNA文库。随机挑选构建差减文库的重组子进行PCR扩增(图2),扩增条带即为插入的cDNA片段。每泳道只有1条扩增条带,且集中于0.2~0.5 kb,说明酶切、连接、转化效果较好。
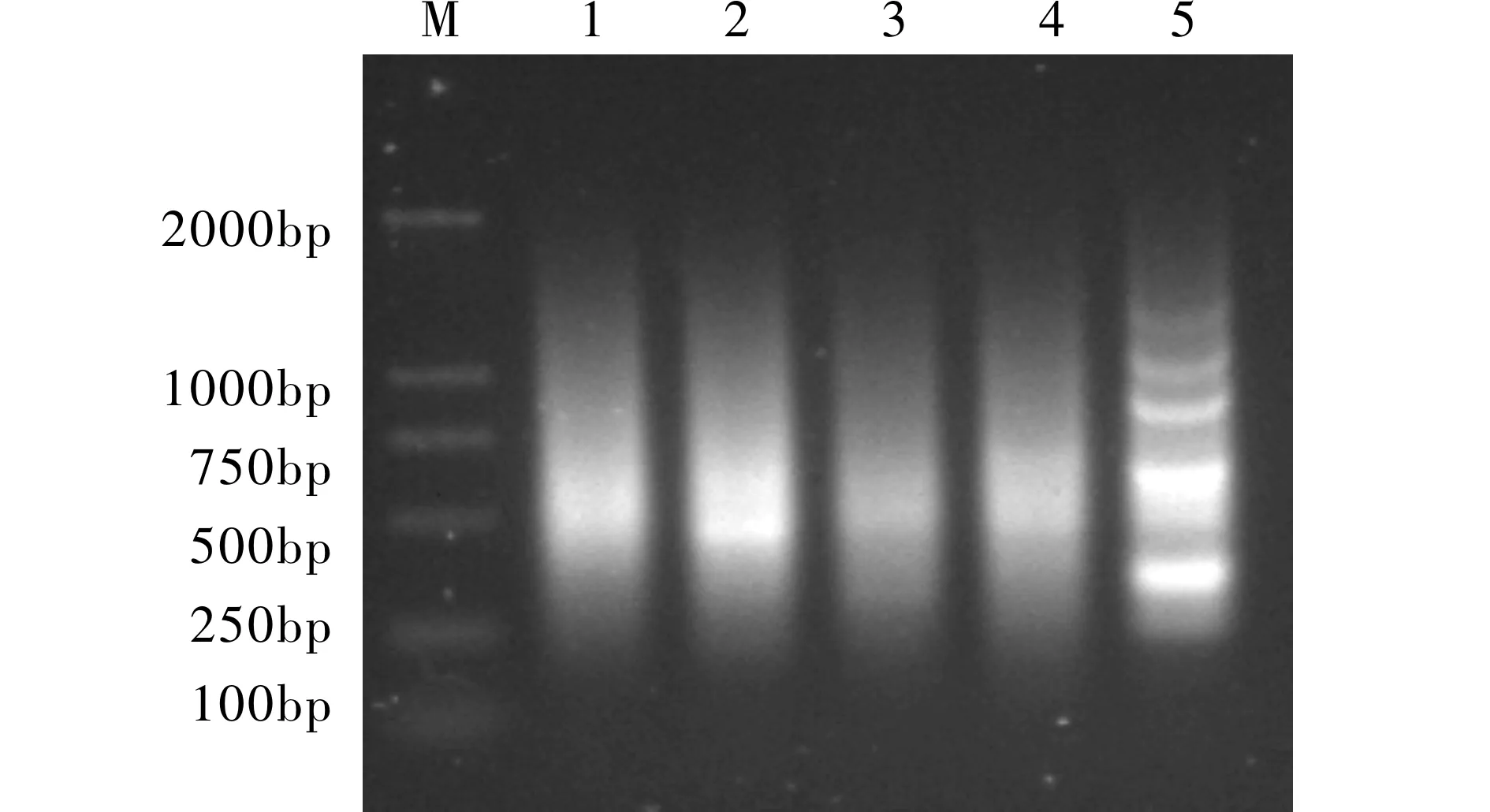
图1 差减杂交后两轮PCR扩增产物分析
M: DNA markers DL2000; 1: 正向杂交后第一次PCR产物; 2: 反向杂交后第一次PCR产物; 3: 正向杂交后第二次PCR产物; 4: 反向杂交后第二次PCR产物; 5: 对照,为试剂盒提供的材料经差减杂交后二次PCR的产物
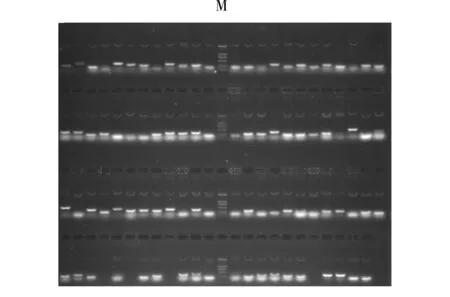
图2 SSH文库部分cDNA克隆外源插入片段的PCR检测
M: DNA markers DL2 000(2 000,1 000,750,500,250,100 bp)
采用随机引物法标记正向差减探针和反向差减探针,再分别与cDNA拷贝膜杂交。对比与不同探针杂交的两张重复拷贝膜的杂交信号(图3),发现有些克隆与正向差减的探针杂交信号强但与反向差减探针的杂交信号弱,这些克隆可能是冷诱导后上调表达的基因;还有一些克隆与正向、反向的差减探针杂交强度没有明显区别,这些克隆是非差异表达的基因。用斑点杂交的方法,对大蕉冷诱导差减文库中的约300个克隆进行筛选,挑选约50个可能为冷诱导上调表达的克隆进行测序。

图3 差减文库的差异筛选
A: 与正向差减cDNA探针杂交; B: 与反向差减cDNA探针杂交。其中PC1为正向差减产物与正向差减cDNA探针杂交的阳性对照,PC2为反向差减产物与反向差减cDNA探针杂交的阳性对照,NC以水作为阴性对照。
2.3 序列分析
将DNA测序得到的序列去除载体、建库时加上的连接序列和3′端的poly(A),应用BLAST软件在GenBank中进行核酸和蛋白质同源性的比较和功能分析。结果发现,大多克隆与其它物种已知基因部分区域有较高的一致性,还有一些克隆与GenBank中查到对应的同源序列同源区很短或一致性较低,可能是新基因或者由于序列位于变异丰富的3′末端而无法查到与其它物种基因的同源性。部分序列同源性分析结果见表1。同源性比较预测结果显示,大多数序列与冷诱导有关,涉及到细胞结构基因、蛋白质合成基因、表达调控基因和信号转导基因等多种基因。

表1 部分阳性克隆的序列比较结果
2.4 MpRci的表达分析
为验证克隆到的基因在大蕉中是否为低温诱导差异表达,以MpRci的EST序列(克隆序号为S3)为已知序列设计引物进行半定量RT-PCR分析。结果(图4)显示大蕉叶片低温处理后比处理前MpRci的表达量呈现上调趋势,确实为低温诱导差异表达。另外,预测克隆序号为S12的基因属于Asr基因家族。在我们的相关研究中,克隆了大蕉MpAsr基因及其上游序列,并将含MpAsr基因上游序列和β-葡萄糖苷酶报告基因的植物表达载体转化烟草,其组织化学染色结果显示MpAsr基因可受低温诱导表达[7]。这些都进一步证实了SSH和反式Northern杂交的结果。
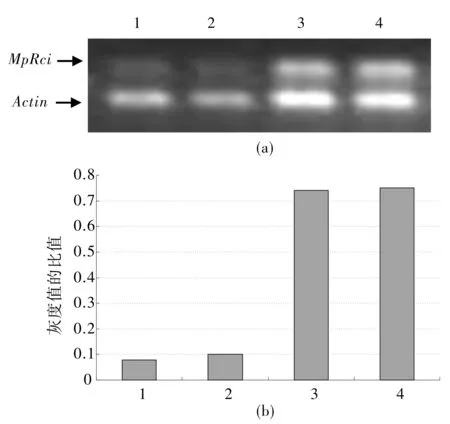
图4 MpRci的低温诱导表达
A: 采用RT-PCR方法检测MpRci在低温诱导下的表达情况;
B:MpRci的灰度值与Actin的灰度值的比值分析;其中1-4分别来自10 ℃处理0、2、6、12 h的大蕉叶片
3 讨 论
目前,分离差异表达基因的方法有多种,主要有mRNA差异显示PCR(mRNA DDRT-PCR)、抑制性差减杂交(SSH)、基因表达连续性分析(SAGE)和DNA微阵列(DNA microarray)等。在这些方法中,SSH法具有假阳性率低、检测效率较高和敏感性高等优点[8]。
为比较低温与非低温条件下大蕉基因表达的改变状况,本研究用抑制性差减杂交的方法构建了大蕉冷诱导差减文库,并通过斑点杂交对文库中约300个克隆进行筛选,最终挑选出可能含冷诱导后上调表达基因片段的约50个克隆进行测序,得到一批与冷诱导相关的ESTs。经同源性比较预测,这些ESTs主要涉及以下几方面:①与信号转导和表达调控相关。如ChaC基因涉及Ca2+离子的跨膜运输及其调控,还有丝氨酸/苏氨酸激酶也参与信号转导。而高速泳动族蛋白通常作为影响转录因子与染色质结合的辅助因子在转录调控中发挥作用[9]。Asr蛋白是一类受ABA、环境胁迫和成熟诱导的蛋白质,涉及调节基因的表达以抵御逆境[7]。我们对过表达大蕉MpAsr的T3代转基因拟南芥抗逆性进行初步检测,结果显示该基因能一定程度上增强转基因拟南芥的逆境耐受能力[7]。②非生物胁迫与防御相关,如脱水素基因、细胞壁富含脯氨酸的蛋白基因Prp和疏水蛋白基因Rci等。脱水素在植物胚胎发育后期以及逆境下大量表达,在植物体内具有多种保护作用[10]。而Prp的大量表达可能加固细胞壁[11]。低温诱导基因Rci与PMP3、Lti6是一类同源基因,受多种胁迫诱导表达,在逆境下有利于维持质膜的稳定性,可增强植物的抗寒和耐盐性[12],更有研究直接证明大蕉低温诱导基因MpRci受低温诱导,且过表达MpRci的转基因烟草抵御低温的能力有所提高[13]。③与蛋白质加工和能量代谢相关,如半乳糖基转移酶基因、葡萄糖-6-磷酸脱氢酶基因和GDP甘露糖苷焦磷酸化酶基因。糖基转移酶是蛋白质糖基化过程的关键酶[14]。葡萄糖-6-磷酸脱氢酶是戊糖磷酸途径的关键酶[15]。GDP甘露糖苷焦磷酸化酶则涉及半乳甘露聚糖代谢途径[16]。④功能未确定基因,但有些基因虽不知确切功能,却也受低温或其它胁迫诱导。由此可见,筛选到的ESTs片段涉及到低温响应的各个方面,提示了大蕉抗寒性的获得受一个复杂的调控网络控制,涉及信号传导、表达调控、非生物胁迫防御、蛋白质加工和能量代谢等的变化,特别是低温下诱导许多具调控或保护性功能的基因表达。进一步,其中的MpRci和MpAsr基因经过验证表明可受低温诱导[7,13],且转基因实验表明MpRci的过表达有助于提高植物抵抗低温的能力[13],直接证实了构建的大蕉冷诱导差减文库确实包含有抗寒相关基因,也说明采用SSH结合点杂交差异筛选大蕉抗寒相关基因是有效的。而且,大蕉作为新的基因资源,得到的大蕉低温诱导ESTs丰富了大蕉基因信息,也为克隆大蕉抗寒相关基因进行遗传转化以提高植物的抗寒性奠定了基础。
参考文献:
[1] THOMASHOW M F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms[J]. Annu Rev Plant Physiol Plant Mol Biol , 1999, 50: 571-599.
[2] GUY C L. Cold acclimation and freezing stress tolerance: role of protein metabolism[J]. Annu Rev Plant Physiol Plant Mol Biol, 1990, 41: 187-223.
[3] GUY C, KAPLAN F, KOPKA J, et al. Metabolomics of temperature stress[J]. Physiol Plant, 2008, 132(2): 220-235.
[4] 吕庆芳,丰锋,张秀枝. 香蕉叶片组织细胞结构特性与耐寒性的关系[J]. 湛江海洋大学学报,2000, 20: 48-51.
[5] 陈杰忠,徐春香,梁立峰. 低温对香蕉叶片中蛋白质及脯氨酸的影响[J]. 华南农业大学学报,1999, 20(3): 54-58.
[6] SAMBROOK J, RUSSELL D W. Molecular Cloning: A Laboratory Manual[M]. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001.
[7] LIU H Y, DAI J R, FENG D R, et al. Characterization of a novel plantainASRgene,MpASR, that is regulated in response to infection ofFusariumoxysporumf. sp.cubenseand abiotic stresses[J]. Journal of Integrative Plant Biology, 2010, 52: 315-323.
[8] 顾克余,翟虎渠. 抑制性扣除杂交技术(SSH)及其在基因克隆上的研究进展[J]. 生物技术通报,1999, 2: 13-16.
[9] CLEYNEN I, VAN DE VEN W J. The HMGA proteins: a myriad of functions[J]. Int J Oncol, 2008, 32(2): 289-305.
[10] 孙歆,雷韬,袁澍,等. 脱水素研究进展[J]. 武汉植物学研究, 2005, 23(3): 299-304.
[11] SHOWALTER A. Structure and function of plant cell wall proteins[J]. Plant Cell, 1993, 5: 9-23.
[12] KIM S H, KIM J Y, KIM S J, et al. Isolation of cold stress-responsive genes in the reproductive organs, and characterization of theOsLti6bgene from rice (OryzasativaL.) [J]. Plant Cell Rep, 2007, 26: 1097-1110.
[13] FENG D R, LIU B, LI W Y, et al. Over-expression of a cold-induced plasma membrane protein gene (MpRCI) from plantain enhances low temperature-resistance in transgenic tobacco[J]. Environmental and Experimental Botany, 2009, 65: 395-402.
[14] KEEGSTRA K, RAIKHEL N. Plant glycosyltransferases[J]. Curr Opin Plant Biol, 2001, 4(3): 219-224.
[15] 侯夫云,黄骥,陆驹飞,等. 水稻质体葡萄糖-6-磷酸脱氢酶基因的克隆与表达研究[J]. 遗传学报, 2006, 5: 66-71.
[16] 魏小春,郑群,刘俊杰. 豆科植物半乳甘露聚糖生物合成及调控研究进展[J]. 亚热带植物科学, 2008, 37(1): 76-81.

