番茄早疫病菌对嘧菌酯的抗药性诱导及突变体特性研究
周杰敏,任璐,刘慧平,韩巨才,王美琴
(山西农业大学农学院,山西太谷 030801)
番茄早疫病菌对嘧菌酯的抗药性诱导及突变体特性研究
周杰敏,任璐,刘慧平,韩巨才,王美琴
(山西农业大学农学院,山西太谷 030801)
为了评价番茄早疫病菌Alternaria solina对嘧菌酯的抗性风险,试验以敏感菌株为材料,通过室内紫外诱导和药剂驯化的方法获得了3株番茄早疫病菌抗嘧菌酯突变体,并比较了抗、感菌株之间的生物学特性。结果表明,突变体EC50值均大于200 μ g◦mL-1,达到高水平抗性,且突变体抗药性稳定,经无性繁殖10次,抗性不丧失。在无药情况下,敏感菌株致病力较强,叶片发病面积达到95%以上,而抗性菌株的发病面积仅为70%;在药剂存在的情况下,敏感菌株生长被抑制,而抗性菌株致病面积达80%以上。突变体在生长速率较敏感菌株有所下降,产孢量及分生孢子萌发率与敏感菌株没有显著差异。突变体粗毒素对番茄种子萌发抑制率高于敏感菌株。孢子的竞争能力明显弱于敏感菌株。
番茄早疫病菌;嘧菌酯;抗性诱导;生物学特性
番茄早疫病是由茄链格孢Alternariasolani引起的番茄重要病害之一,在我国黑龙江、河北、山西、山东、湖北、湖南、上海、江苏、广东和广西等省都有发生。发病严重时可引起落叶、落果和断枝,对番茄产量影响很大[1]。由于番茄早疫病具有潜育期短、再侵染频繁、流行速率高的特点[2],长期使用单一药剂防治,在药剂的选择压力下病原菌容易形成抗药性群体[3,4]。开发新型高效的杀菌剂来控制番茄早疫病的流行与危害已经成为广大农业科技工作者面临的重大课题。嘧菌酯azoxystrobin既能抑制菌丝生长又能抑制孢子萌发,并且对真菌分生孢子产生也有显著的抑制作用,具有铲除、保护、内吸及横向输导等特性,因其杀菌活性高、杀菌谱广、内吸性强、对非耙标作物和从未使用过嘧菌酯等甲氧基丙烯酸酯类杀菌剂的作物安全且与环境有良好的相容性而被广泛用于防治多种经济作物病害[5~7]。为对番茄早疫病菌嘧菌酯抗性风险评估及抗性治理提供理论依据,及了解抗性菌株的生物学特性,本文对番茄早疫病菌进行了室内抗性诱导,并进行了抗性菌株遗传稳定性,生长速率、产孢量、致病力、产毒量及竞争力等的测定。
1 材料与方法
1.1 材料
1.1.1 供试菌种及材料供试菌种由山西农业大学农药学实验室提供。番茄叶片采自山西省太谷县杨家庄未喷施农药的大棚。
番茄品种:大红908。
1.1.2 供试药剂
供试杀菌剂。
25%嘧菌酯(azoxystrobin)悬浮剂(先正达作物保护有限公司),以无菌水为溶剂,配制成质量浓度为1.0×104mg◦L-1的母液,于4℃冰箱中保存备用。
1.1.3 培养基
PDA培养基,PD培养基,WA培养基。
1.2 方法
1.2.1 敏感基线的建立
根据范永玲得出的敏感基线结果[8]。为嘧菌酯的 EC50值在 0.0004~ 0.0678 μ g◦mL-1,平均EC50值为 0.0331 μ g◦mL-1,最低抑制浓度为 1.0 μ g◦mL-1,以此作为番茄早疫病病菌对嘧菌酯杀菌剂的相对敏感基线。
1.2.2 抗药性诱导
紫外线诱导。将生长5 d的敏感菌株S38和S42制成孢子悬浮液,涂布于含嘧菌酯100 μ g◦mL-1的PDA平板中,紫外灯下(40W,15 cm)分别照射30 s、60 s、90 s、2 min 、5 min 、8 min,将照射后的平板迅速用牛皮纸包好放于25℃的恒温培养箱中黑暗培养7~10 d。
药剂驯化。在敏感菌株S38的菌落边缘打取直径为4 mm 的菌块,接种于含嘧菌酯 500 μ g◦mL-1的PDA平板上,25℃恒温培养并观察菌落形状。
1.2.3 抗性水平测定
采用孢子悬滴法,设置嘧菌酯浓度为0.625、2、10 、20、50、100、200 μ g◦mL-17 个梯度浓度 ,以不加药者为对照,每个处理重复3次。将抗性突变
体R42-8,R42-2和R38-5培养5 d后,用0.5%的吐温水制成孢子悬浮液。分别取10 μ L的孢子悬浮液和等体积的各浓度药液分别混合均匀,滴在凹玻片上,25℃倒置保湿培养12 h后,显微镜下观察孢子萌发情况,计算孢子萌发抑制率。
1.2.4 无药继代培养
将紫外诱导获得的抗性突变体R42-2,R42-8在无药PDA平板上25℃连续培养10次,每次培养3 d,分别测其第 1 、3、5、7、10 次的抗性水平。
1.2.5 致病力测定
采用离体叶片测定法,将新鲜的番茄叶片用直径1.5 cm的打孔器打成大小均匀的叶碟,用无菌水冲洗表面后,在75%乙醇中浸泡1 min进行表面消毒,然后再用无菌水漂洗,捞出沥干置于灭菌培养皿中,每皿5片。配制4 μ g◦mL-1嘧菌酯药液,将沥干叶片浸入药液5 s拿出晾干,以浸入无菌水5 s晾干的叶碟为对照。分别将PDA平板上培养5 d的敏感菌株S38、S42和抗性菌株R42-2、R42-8的孢子悬浮液均匀喷洒在叶片表面,每处理重复三次,将灭菌培养皿在25℃恒温箱中保湿培养5 d后,对叶片进行发病面积调查。用坐标纸计算叶片发病面积,取平均值。
1.2.6 抗感菌株生长速率及产孢量比较
从各供试菌株距菌落边缘相同位置取直径为4 mm的菌块接种于PDA平板上,25℃下黑暗培养,分别测量生长 1、2、3、4、5 和 6 d 后的菌落直径,另外用4 mm的打孔器取一菌块,用20 mL加吐温80的无菌水洗下孢子[9],充分振荡后采用血球计数法测定生长6 d后的产孢量[10]。
1.2.7 突变体与敏感菌株孢子萌发力测定
将相同浓度的敏感菌株和突变体的孢子悬浮液(1×105孢子◦mL-1)100 μ L均匀涂布于2%水琼脂平板上[11],置于 25℃培养箱中,黑暗培养24 h后,检测平板中孢子的菌落数。用下列公式计算孢子萌发率:

1.2.8 产毒量测定
粗毒素制备参照郑晓莲等方法[12],并略做改进。将供试菌接到PDA培养基上,25℃培养7 d后,从平板上取5块直径为4 mm的菌块接种到250 mLPD培养基中,置于25℃摇床中振荡培养30 d后,四层纱布过滤,在 3000 g◦min-1下离心15 min,121℃下高温灭菌30 min。即为粗毒素。将滤液用无菌水稀释成1%、2%、5%、10%、20%、50%、100%7个浓度,将在各浓度药液里浸泡24 h的番茄种子在光照培养箱中无菌保湿培养,3 d后计算萌发率抑制中浓度以比较其产毒量。
1.2.9 突变体和敏感菌株孢子竞争能力测定
参照纪兆林[11]及Schepers[13]竞争能力的测定方法进行。竞争能力试验用孢子悬浮液接种,将抗药突变体和敏感菌株的孢子悬浮液配成相同浓度(1×105孢子◦mL-1)后等量混合成不同组合;组合1:S42+R42-2;组合 2:S38+R38-5;组合 3:S42+R42-8;组合4:S42+R42-3。组合1-4均为抗性突变体与其亲本敏感菌株的组合。用毛笔将孢子混合液涂抹于番茄叶片上,发病后挑选单个病斑,用打孔器将病斑取下,并分离病菌。再用含100 μ g◦mL-1的嘧菌酯平板鉴定其抗药性,计算抗感菌比例。
2 结果与分析
2.1 番茄早疫病菌的抗性诱导
敏感菌株S42经紫外照射2 min和8 min后,获得了突变体R42-2和 R42- 8;S38经紫外照射5 min后获得抗性突变体R38-5。药剂驯化没有出现扇形突变体菌落,药剂诱导未成功。
2.2 抗性水平测定
S38、S42菌株在室内经紫外线诱导,共获得了3株高抗性突变体,采用孢子悬滴法测定了抗药性突变体的EC50值。测试结果见表1,紫外线诱导获得突变体的 EC50为 8.8443~ 21.7154 μ g ◦mL-1,其亲本菌株的 EC50为0.0237~0.0335 μ g◦mL-1,两者进行对比,抗性指数在267.22~656.05倍之间,达到了高抗水平。

表1 番茄早疫病抗药菌株对嘧菌酯的敏感性Table 1 The sensitivity of Alternaria solani mutants to azoxystrobin
2.3 突变体遗传稳定性测定
由表2可看出,经紫外光照射诱导产生的番茄早疫病菌抗嘧菌酯菌株R42-2和R42-8为高等抗性,抗性菌株连续在无药PDA平板上转接10代后,病菌仍能生长,菌丝茂密,说明其抗药性稳定,经多代无性繁殖后其抗性不丧失。

表2 R42-2、R42-8菌株的抗性水平测定结果Table 2 R42-2、R42-8resistance level measurements
由表2还可看出,所测两个抗性菌株的EC50值不同,R42-2的抗性水平较高。说明在诱导出番茄早疫病菌抗嘧菌酯菌株的过程中,由于紫外光照射时间不同,即可获得不同抗性水平的抗性菌株。无药继代培养10代后,两个抗性菌株的抗性水平明显提高,抗性菌株的耐药性不断增强,抗药性较稳定,不易丧失。
2.4 抗性菌株的致病性测定
由表3可看出,敏感菌株在无药情况下发病严重,接种4 d后,番茄叶子几乎全部发病,发病面积接近100%,致病力极强;抗性突变体,在无药条件下较敏感菌株发病轻,病斑面积较小。由此可看出抗性突变体在无药情况下其致病力要比敏感菌株弱。用嘧菌酯4 μ g◦mL-1浸后的番茄叶片上,敏感菌株被抑制不发病;而抗性突变体表现出较高的耐药性和致病性,病斑面积较大。

表3 抗性菌株及敏感菌株在番茄叶片上病斑面积Table 3 Lesion area of resistant and sensitive isolates in the tomato leaf
2.5 生长速率及产孢量测定(表4)

表4 抗药突变体与亲本菌株菌落生长直径(cm)和产孢量的比较Table 4 Comparison of the inter-colony diameter growth(cm)between resistant strains with sensitive isolates and conidiation compared volume
由表4可看出,生长初期亲本敏感菌株生长速率最大,抗性菌株(R42-8)与亲本菌株的生长速率相近,抗性菌株(R42-2)生长的最慢。随着时间的延长,R42-2的生长速率明显加快,R42-8生长速度下降。突变体菌株的产孢量与其亲本敏感菌株(S42)相比差异极不明显,表明番茄早疫病菌对嘧菌酯产生抗药性变异后,其繁殖生长能力没有明显变化。
2.6 孢子萌发率测定
由表5可以看出突变体的萌发率较亲本菌株有下降趋势,但经邓肯新复极差法计算实验结果在5%显著水平及1%极显著水平上三个菌株之间差异不显著。

表5 抗药突变体与亲本菌间孢子萌发率比较Table 7 Comparison of the spore germination rate between resistant and sensitive isolates
2.7 番茄早疫病菌抗嘧菌酯突变体与亲本菌株产毒量测定(表6)
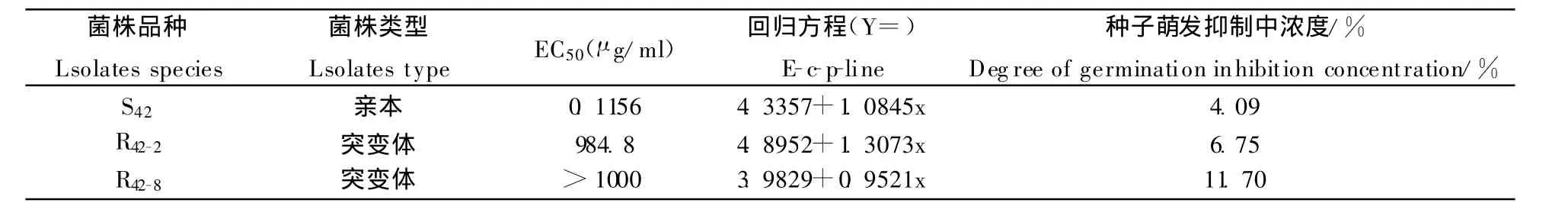
表6 番茄早疫病菌抗嘧菌酯突变体与亲本产毒量比较Table 6 Comparison of capacity of the toxin-producing between the Alternaria solani resistant and sensitive isolates to azoxystrobin
从表6可看出,亲本菌株和两种突变体菌株的 粗毒素对番茄种子萌发抑制中浓度分别为4.09%、6.75%和11.7%,突变体菌株的粗毒素对番茄种子萌发抑制明显加大。说明抗性菌株产毒量明显增加,这会导致抗性菌株致病力上升。
2.8 抗药突变体竞争力测定
用紫外诱导获得的嘧菌酯高抗菌株及其原始敏感菌株之间的竞争力测定结果见图1,1~4组合接种的病斑中,敏感菌株的频率均高于抗性突变体。其中,抗性频率最高的组合3也只达到42.2%,而最低的组合4仅为23.1%。说明敏感菌株孢子的竞争能力要强于抗性突变体。

图1 番茄早疫病菌抗感菌株孢子竞争能力Fig.1 The spores competitiveness of Alternariasolani resistant and sensitive isolate
3 结果与讨论
本研究采用紫外照射成功诱导出番茄早疫病菌抗嘧菌酯的突变菌株,说明在大田条件下番茄早疫病菌群体出现抗嘧菌酯突变体的可能性存在。但对亲本敏感菌S38、S42进行抗性诱导其成功率较小,且药剂驯化未成功,这可能与药剂剂量、次数等因素有关。
抗性突变体与亲本相比较,生长速率、繁殖能力并无差异,说明在大田条件下能形成抗性突变体群体并能与亲本菌株群体共存。经测定番茄早疫病菌粗毒素能明显抑制番茄种子的萌发,突变体与敏感菌株的产毒量比较结果表明,突变体产毒量明显增大,但突变体的致病性强弱有何改变有待进一步研究。
抗嘧菌酯的番茄早疫突变体连续培养多代抗性未衰退,说明其抗性很稳定,不易丧失。因此,在生产实践中一旦发现抗嘧菌酯的菌群形成,就应立即采取措施,如换用作用机理不同的新杀菌剂品种,防止抗性群体继续扩大。
尽管目前在大田中尚未检测到抗嘧菌酯的番茄早疫病菌,但已有关于番茄早疫病抗性菌株的报道[14],因此即使是嘧菌酯这类敏感性较高的药剂在生产实践中也应该慎重使用。本文仅对番茄早疫病菌抗嘧菌酯突变体和敏感菌进行了一些初步的生物活性测定,在以后的研究工作中应进一步比较抗性突变体和敏感菌株在分子生物学上的差异,其毒素的致病机理也有待于进一步的研究,从而对番茄早疫病菌对嘧菌酯的抗性治理提供解决方案。
[1]陈利锋,徐敬.农业植物病理学(南方本)[M].北京:中国农业出版社,2001:314-317.
[2]赵善欢.植物化学保护[M].第三版.北京:中国农业出版社,2003:253.
[3]周明国.植物病原物抗药性[M].北京:中国农业出版社,1998:50-61.
[4]胡伟群.苯基酰胺、DMI和 Strobilurin类杀菌剂抗药性研究进展[J].世界农药,2002,24(6):11-14.
[5]张舒亚,周明国.甲氧基丙烯酸酯类杀菌剂的生物学及应用技术研究[M].中国植物病害化学防治研究(Ⅲ).北京:中国农业科技出版社,2002:1-10.
[6]Dales.Efficacy of'Amistar'against Fruit and Vegetable Diseases in Asia[M].中国植物病害化学防治研究(Ⅲ).北京:中国农业科技出版社,2002:42-49.
[7]Gullno,M.L.Leroux,P.Smith,C,M.U ses and Challenges of N ovel Compounds for Plant Disease Control[J].Crop Prote,2000,19(2):1-11.
[8]范永玲,任璐,刘秀英,等.番茄早疫病菌对3种杀菌剂的抗药性监测[J].安徽农业科学,2008,36(26):11431-11433,11448.
[9]陈新建,叶钟音.芦笋茎枯病菌对甲基托布津的抗药性初步研究[J].南京农业大学学报,1999,22(1):25-31.
[10]张仙红,李文英,贺运春.影响虫生真菌玫烟色拟青霉孢子萌发的因素探析[J].中国农学通报,2007,23(7):478-481.
[11]纪兆林,张建军,徐敬友,等.抗腐霉利的灰葡萄孢菌株特性及其竞争能力[J].扬州大学学报,2007,28(2):65-68.
[12]郑晓莲,董金皋,齐秋锁.灰葡萄孢毒素的组分分析和生物测定[J].植物病理学报,1998,28(3):269-271.
[13]Schepers HT AM.Fitness of isolates of Sphaerotheca fuliginea resistant or sensitive to fungicides which inhibit ergosterol biosynthesis[J].Netherlands Journal of Plant Pathology,1985,91(2):65-76.
[14]张洪,刘慧平,韩巨才,等.番茄早疫病对杀菌剂的敏感性研究[J].山西农业大学学报,2005,26(1):36-37,40.
Resistant Inducing ofAlternaria solanito Azoxystrobin and Determination of Mutant Characteristics
ZHOUJie-min,REN Lu,LIU Hui-ping,HAN Ju-cai,WANG Mei-qin
(College of Agriculture,Shanxi Agricultural University,Taigu Shanxi 030801,China)
The study aimed to evaluate the resistance risk ofAlternaria solanito azoxystrobin.It adopted UV-induced and taming of azoxystrobin to induce resistant mutations ofAlternariasolaniin laboratory,and chosed three EC50levels over 200μ g◦mL-1ones.Comparing the resistant with sensitive isolates showed that the resistance obtained by two ways was stable after 10 subcultures on fungicide-free PDA.Sensitive isolates had highly pathogenic to the leaves containing no fungicides,infecting higher than 95%and the resistant isolates infected 70%more or less.But the sensitive isolates was non-pathogenic to the leaves with fungicides,and resistant isolates reached 80%.The hyphae growth rate of resistant isolates was slow,but the sporulation and spore germination rate of resistant isolates were not significantly different from those of their sensitive ones.The extract toxin of mutant isolate inhibited the tomato seed germination markedly.The spore germination of sensitive isolates was higher than the resistance mutant.
Alternariasolani;Azoxystrobin;UV-induced;Biological characteristics
S481+.4
A
1671-8151(2010)01-0019-05
2009-09-11
2009-12-15
周杰敏(1985-),女(汉),山东蓬莱人,硕士研究生,主要从事农药毒理学方面的研究。
韩巨才,博士生导师。T el:0354- 6288351;E-mail:Jchan@sxau.edu.cn
山西省科技攻关项目(2007031039);山西省留学归国基金(2007061、2009043);山西省自然基金(2008011066)
(编辑:杨忠义)

