胃肠间质瘤的多层CT诊断
任勇军 翟昭华 杨 林 缪南东 赵彩霞 邓 进
胃肠间质瘤 (gastrointestinal stromal tumors,GIST)是一种少见的消化道肿瘤,起源于胃肠道间质干细胞(cajal cell),在20世纪80年代以前,这类肿瘤往往被划分为平滑肌瘤、平滑肌肉瘤、神经纤维瘤或神经纤维肉瘤等。随着免疫组化及分子生物技术的发展,认为该病原发于胃肠道、网膜及肠系膜,是一种过度表达CD117和CD34的梭形细胞、上皮样细胞或混合性肿瘤,是最常见的间叶源性肿瘤[1,2]。Fletcher等[1]认为GIST具有潜在恶性,不应单纯用“良性”和“恶性”来划分。本文回顾性分析经手术和病理(免疫组化)证实的GIST的多层CT(multi-slice computed tomography,MSCT)表现,探讨MSCT在GIST定位定性诊断中的价值。
方 法
1.研究对象
搜集我院从 2004年 6月至 2008年 5月共 56例经手术、病理(免疫组化)证实的GIST,年龄17~80岁,平均年龄(56.8±13.2)岁,中位年龄60岁,男 33例,女23例。临床表现为腹痛10例,消化道出血 33例,腹胀5例,无症状8例。
2.检查方法
56例均进行了MSCT平扫及增强检查,检查前12h禁食、禁水,采用东芝Aquilion16层CT机,扫描前半小时口服清水或泛影葡胺稀释液500~1000ml。采用1mm×16数据采集方式,层厚5~7mm,无间隔,螺距1.0,120kV,220mA,0.5s/rot。56例患者同时进行了增强后 3期扫描,对比剂为碘海醇 100ml(350mgI/m1),经肘前静脉采用高压注射器以3ml/s的速率团注,延迟时间分别为注射后25s、60s、300s。扫描完成后重建为层厚1.0mm、间隔0.5mm的图像,并以病变为中心作多平面重组(multiplanarreformation,MPR)。由三位副高职称以上医生共同评价,观察内容主要包括:病变的位置、大小、密度、边缘、与周围组织的关系及有无转移,作出定位定性诊断。
全部病例手术切除并完成病理学、免疫组化检查,依据NIH标准[1]的4级(极低危、低危、中危和高危)病理分级,本组分为3级:低度恶性(即上述的极低危和低危),中度恶性(中危)和高度恶性(高危)。
结 果
1.MSCT表现
1.1 定位诊断:56例GIST中,48例影像定位诊断与外科手术相符 (图1),定位准确率为85.7%(48/56),包括胃28例、小肠 6例、结肠 8例、肠系膜 6例。2例分别诊断为小肠和肠系膜的病例与手术不符,其余6例未能明确定位。
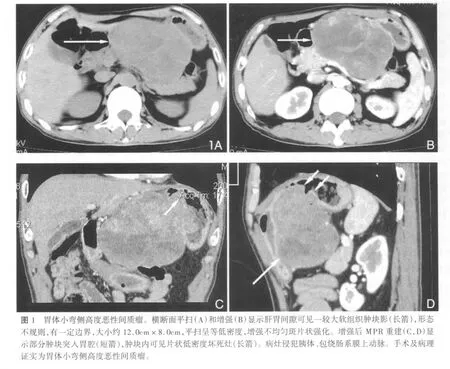
1.2 MSCT表现:肿瘤最大径2.0~21.0cm,平均(7.3±4.6)cm,难定位6例的平均直径(14.9±4.8)cm。肿块呈球形 32例,分叶状 22例,小节结状2例。边界清晰40例,与周围组织分界不清16例。腔外生长为主者49例,其中41例直径>5cm;腔内生长为主者7例,其中5例直径≤5cm。直径≤5cm的 13例,其密度均匀,增强后均匀强化。直径>5cm的43例,其密度不均伴低密度坏死区,不均匀强化。
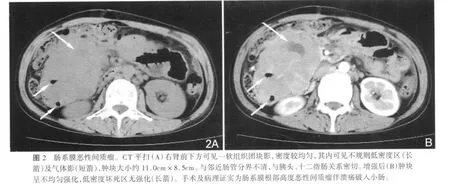
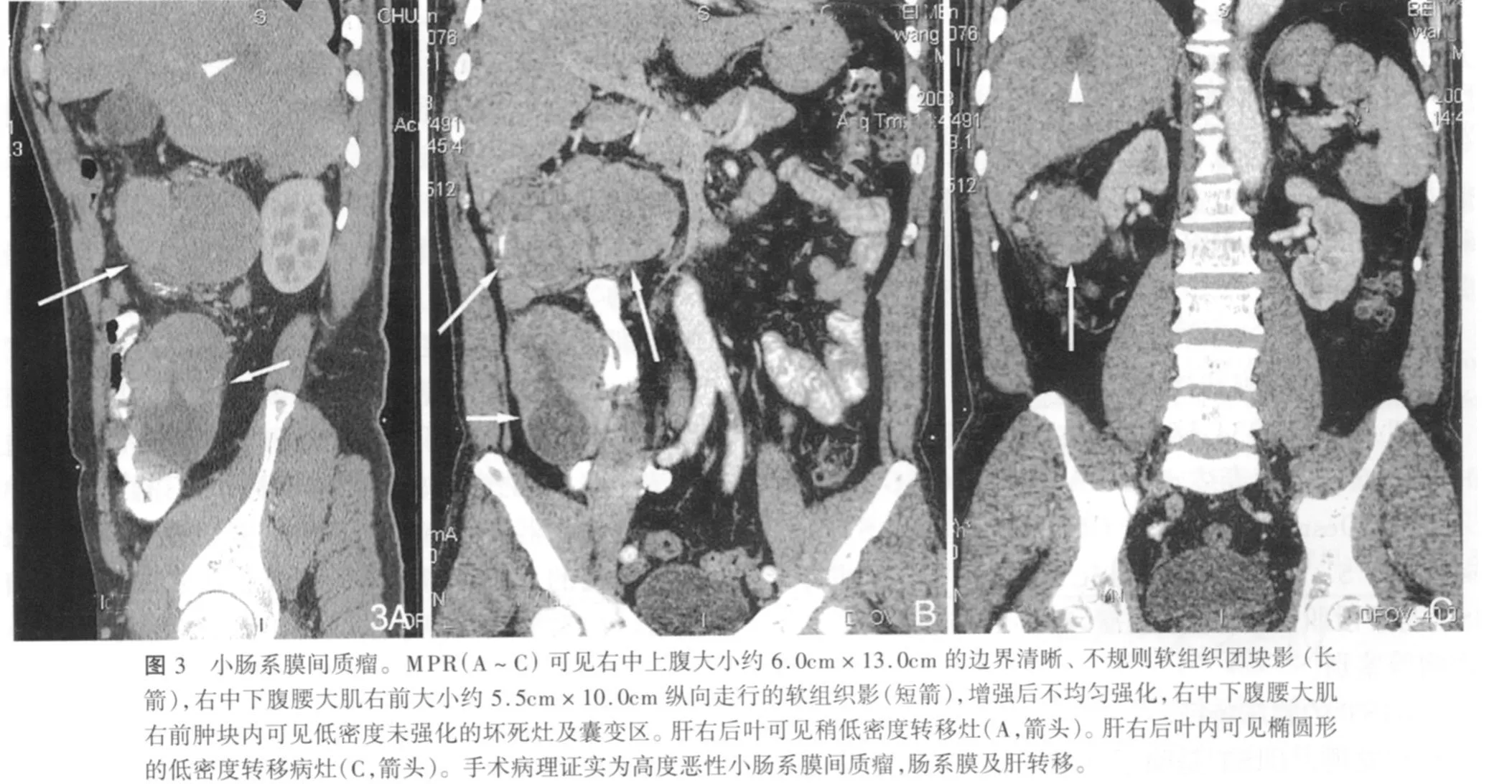
3例检出瘤体内含气体影,手术证实坏死腔与消化道沟通(图2)。23例瘤内可见成簇状或线状排列细小血管。15例发现远处脏器转移,其中8例肝脏转移(伴淋巴结转移3例),肝内表现为多个或一个边界清晰低密度灶,增强后边缘轻、中度强化(图3),单纯淋巴结转移4例,单纯肠系膜转移3例,淋巴结转移表现为腹腔淋巴结肿大及部分融合,肠系膜转移表现为肠系膜不均匀或均匀的软组织肿块,增强后均匀或不均匀强化。还观察到5例肠管扩张等肠梗阻征象。
1.3 定性诊断:以肿瘤出现密度不均、伴坏死,与邻近结构分界不清、模糊,直径>5cm,伴邻近及远处转移为依据,作为高度恶性征象[3],据此CT诊断高度恶性41例,中低度恶性15例,诊断高度恶性的敏感性91.1%(41/45),特异性100%,准确性91.1%。
2.病理表现
56例GIST手术后:18例可见包膜,46例切面呈灰白色,21例与周围组织结构粘连。肿瘤多数位于黏膜下,向腔外生长。光镜下:梭形肿瘤细胞,多呈编织状、旋涡状或栅栏状排列;上皮样肿瘤细胞多呈弥漫片状、巢索状排列。HE染色,部分深染,胞质呈伊红色;肿瘤细胞有一定异型性,可见核分裂。免疫组化:47例同时CD117阳性和CD34阳性;9例有其中之一阳性。56例原发肿瘤中,病理学诊断为高度恶性45例,中度恶性8例,低度恶性 3例。
讨 论
1.GIST的病理学特征及免疫组化特点
GIST通常是胃肠壁肌层内的肿块,可向腔内或浆膜面生长。部分病例则完全表现为肠系膜或大网膜肿块。肿块多呈圆形或椭圆形,有的包膜完整,有的无明显包膜。切面部分灰白、实性、质韧;部分细腻,呈鱼肉状。从组织形态学上分为3种类型:梭形细胞型、上皮细胞型和混合型。光镜下,梭形细胞多呈编织状、栅栏状或旋涡状排列,上皮样细胞则多呈弥漫片状、巢索状排列。肿瘤间质常出现黏液样基质及玻璃样变性,甚至可出现钙化,部分肿瘤组织可伴有或多或少的炎症细胞浸润。在高度危险性GIST中出血及坏死常见,部分可囊变。Fletcher等[1]认为把GIST单纯划分为“良性”和“恶性”是不明智的,曾经认为是良性的病变,多年后出现恶性转化,认为GIST具有潜在恶性,依据肿瘤大小和核分裂数,将GIST分为极低危、低危、中危和高危4级,因为本组极低危和低危病例数少,本文将其合为1级。
在GIST中,CD117呈阳性、高表达,而平滑肌细胞、血管平滑肌细胞和神经纤维不表达CD117,大部分GIST具有CD34较高表达,但特异性不如CD117。部分GIST表达 α-SMA和 S-100,GIST几乎不表达Desmin。通过对 CD117、CD34、SMA、Desmin及 S-100等免疫组化分析,可以有助于GIST与平滑肌瘤、平滑肌肉瘤、神经纤维瘤或神经纤维肉瘤等鉴别。
2.GIST的临床特征
研究发现,GIST是除了食管之外的胃肠道最常见的间叶性肿瘤,发病率约为0.68/10万,好发于50岁以上的中老年人,中位年龄63岁,40岁以前罕见,GIST的发病不存在性别差异[4]。最常发生于胃,其次为小肠、直肠及食管。本组病例发生于胃的GIST发生率为50%(28/56),中位年龄60岁。GIST还可发生于网膜、肠系膜及腹膜后等位置。GIST的临床表现与肿瘤大小、发生部位、肿块与肠壁的关系以及肿瘤的恶性程度有关。肿瘤较小时多无症状,最常见的症状为腹部不适、隐痛或者可扪及的腹部肿块。浸润到消化道的表现为溃疡或出血,其他的症状可有食欲不振、体重下降或肠梗阻等。部分患者是在开腹手术、内镜检查或进行体检时无意中发现。本组病例主要临床表现为腹痛17.9%(10/56),消化道出血58.9%(33/56),腹胀8.9%(5/56),体检查出14.3%(8/56)。手术切除是GIST患者的主要治疗手段,Neuhaus等[5]统计,术后超过50%的患者发生复发、转移。本组患者确诊时已有26.8%(15/56)发现远处转移。过去常认为GIST对常规放疗和化疗均不敏感,Hou等[6]认为应用甲磺酸伊马替尼的新辅助化疗显著提高恶性GIST的预后。
3.GIST的MSCT表现
GIST肿块常常较大,本组中肿块最大径2.0~21.0cm,平均(7.3±4.6)cm。生长方式上以消化道腔外生长为主,大多数腔外生长的肿块直径>5cm,形态不规则,多呈球形或分叶状,密度不均,中心可见小片状或大片状低密度坏死、出血及囊变区,增强后呈不均匀强化或无强化,提示恶性程度较高;肿瘤较少向腔内生长,向腔内生长为主的肿瘤,直径多≤5cm,形态规则,多呈圆形、椭圆形,密度均匀,中心坏死少见,增强显示瘤体密度均匀,边界清晰,提示恶性程度较低。本组病例腔外生长占87.5%(49/56),腔内生长占12.5%(7/56);平均直径>5cm的43例及平均直径≤5cm的13例有以上征象。GIST肿块大多边缘较清晰,即使是恶性程度较高的GIST对周边浸润程度也较轻,因此不能单纯以边界清晰程度作为区分恶性程度高低的唯一标准。本组71.4%(40/56)的肿块边界较清晰,小部分肿块与周界组织分界不清。较大肿块对邻近组织器官均有推挤,部分侵及相邻器官。恶性程度较高的GIST瘤体内可见成簇状或线状排列细小血管,以动脉期明显;肿块易出现溃疡致表面凹凸不平,若溃疡大而深则出现气液平改变;如果穿透胃肠道壁,肿块内可见气体影[7,8]。本组病例中23例可见成簇状或线状排列细小血管,有3例可见气体影,未发现钙化性改变。GIST转移以肝脏最常见[2],具有典型的肝转移瘤特征,主要表现为单发或多发、圆形或椭圆形低密度占位性病灶,边缘轻中度强化。淋巴结转移表现为淋巴结肿大,可融合,均匀或不均匀强化。肠系膜转移表现为肠系膜单个或多个软组织样结节或肿块,可均匀或不均匀强化。本组14.3%(8/56)肝转移,12.5%(7/56)淋巴结转移,5.4%(3/56)肠系膜转移。
MSCT灌注成像可以反映病灶内的血供情况和血流动力学变化,对于肿瘤的鉴别诊断和恶性程度的判断有重要意义,对手术前评价和确定病灶的解剖学范围起到重要作用[9]。MPR对肿块大小以及对邻近组织的侵犯均可清楚显示,同时还可以观察其他部位的转移灶,有利于对肿瘤的诊断和分期;根据肿瘤大小,不规则的外生性肿块,多发性含气小腔隙及增强后明显不均匀强化等特点对定性诊断价值很大[8,10]。MPR能够清晰显示瘤体本身、与周边的关系以及转移灶。Boonsirikamchai等[11]认为CT扫描,特别是MSCT定位准确、定性率高。钱民等[12]认为体积较大的GIST,确定肿瘤组织来源较困难。在本组患者中,CT定位准确度为85.7%(48/56)。位于腹腔及盆腔的较大肿瘤占10.7%(6/56),平均直径(14.9±4.8)cm,较难确定起源,但是MPR可以明确肿瘤与相邻组织器官的关系。肿瘤内出现密度不均,伴坏死,与邻近结构分界不清、模糊,直径>5cm伴邻近及远处占位被认为是恶性程度较高的征象[3],以此作为判断依据,本组病例CT诊断为高度恶性者41例,诊断高度恶性的敏感性91.1%(41/45),特异性100%,准确性 91.1%。
GIST的MSCT主要表现为腹部或盆腔圆形或椭圆形软组织肿块,多数边缘较清晰,消化道腔外生长,瘤体较大时坏死明显,可压迫或侵犯邻近器官。肿瘤直径>5cm、形态不规则、内部密度不均(伴坏死、出血及囊变)、与邻近结构分界不清、增强后不均匀强化、瘤内见成簇状或线状排列细小血管以及远处转移等,提示高度恶性的诊断。MSCT检查观察视野广阔,特别是MPR对周围组织器官的侵犯情况显示清晰,定位准确,并有很高的高度恶性提示准确性,可为临床诊治提供详细的依据。
1.Fletcher CD,Berman JJ,Corless C,et a1.Diagnosis of gastrointestinal stromal tumors:a consensus approach.Hum Pathol,2002,33:459-465
2.Cichoz-Lach H,Kasztelan-Szczerbińska B,Slomka M.Gastrointestinal stromal tumors:epidemiology,clinicalpicture,diagnosis,prognosis and treatment.Pol Arch Med Wewn,2008,118:216-221 Ulusan S,Koc Z,KayaselcukF.Gastrointestinal stromal tumours:CT
3.findings.Br J Radiol,2008,81:618-623 Miettinen M,Sobin LH,Lasota J.Gastrointestinal stromal tumors of
4.the stomach:a clinicopathologic,immunohistochemical,and molecular genetic study of 1765 cases with long-term follow-up.Am J Surg Pathol,2005,29:52-68 Neuhaus SJ,Clark MA,Hayes AJ,et a1.Surgeryforgastrointestinal
5.stromal tumour in thepost-imatinib era.Anz J Surg,2005,75:165-172 Hou YY,Zhou Y,Lu SH,et al.Imatinib mesylate neoadjuvant treat-
6.ment for rectal malignantgastrointestinal stromal tumor.World J Gastroenterol,2009,15:1910-1913 Sandrasegaran K,Rajesh A,Rushing DA,et al.Gastrointestinal
7.stromal tumors:CT and MRI findings.Eur Radiol,2005,15:1407-1414 Song T,Shen J,Guo HC,et al.Imaging and pathological features of
8.gastrointestinal stromal tumors.Zhonghua ZhongLiu Za Zhi,2007,29:386-390 Da Ronch T,Modesto A,Bazzocchi M.Gastrointestinal stromal tu-
9.mour:spiral computed tomographyfeatures andpathologic correlation.Radiol Med,2006,111:661-673 Chen BB,Liang PC,Liu KL,et al.Preoperative diagnosis of gastric
10.tumors by three-dimensional multidetector row CT and double contrast barium meal study:correlation with surgical and histologic results.J Formos Med Assoc,2007,106:943-952 Boonsirikamchai P,Podoloff DA,Choi H.Imaging of gastrointestinal
11.stromal tumors and assessment of benefit from systemic therapy.Hematol Oncol ClinNorthAm,2009,23:35-48钱 民,李小荣,林伟光,等 .胃肠道间质瘤的CT诊断价值 .中国医
12.学计算机成像杂志,2006,12:36-39

