HSP70在化学性缺氧诱导毛细胞损伤中的作用
曹 磊,张世平,胡亿文
(广州市红十字会医院耳鼻喉科,广东广州 510220)
噪声、炎症及缺氧是导致耳蜗毛细胞损伤的重要原因,而缺氧在其他损伤因素的作用过程中常起着协同损伤的作用[1]。另外,在分娩过程中引起的新生儿窒息也是导致耳蜗毛细胞损伤的重要原因之一。深入研究缺氧性毛细胞损伤的分子机制可为耳蜗相关性疾病的防治提供理论依据。热休克蛋白(heat shock proteins,HSPs)是一类广泛存在于原核、真核细胞中,进化上高度保守的细胞保护蛋白。它们可在细胞遭受应激损伤(如高温、缺血、缺氧及炎症等)时反应性上调,以保护细胞对抗不利环境引起的损伤。热休克蛋白70(heat shock protein 70,HSP70)是细胞内含量最丰富的热休克蛋白之一,其在螺旋缘、血管纹及毛细胞均有表达[2],而HSP70在缺氧性毛细胞损伤时的表达情况,及其在缺氧性毛细胞损伤中的作用仍鲜有报道。为此,本实验拟观察在化学性缺氧模拟剂氯化钴(cobaltchloride,CoCl2)损伤毛细胞时HSP70的表达及HSP70在此损伤过程中的作用。
1 材料与方法
1.1 材料
CoCl2和槲皮素(quercetin,Quer)购自美国 Sigma-Aldrich公司,细胞计数试剂盒-8(cell count kit 8,CCK-8)购自碧云天生物技术研究所,HSP70抗体由Santa Cruz生物技术公司提供,DMEM高糖培养基购自Gibico公司。
1.2 细胞培养
永生化的HEI-OC1听细胞株由中山大学实验动物中心提供。HEI-OC1听细胞株具有外耳毛细胞的特性,能特异性地表达math1和myosin7a蛋白,在耳毒性的科学研究中已被广泛应用[3]。HEI-OC1听细胞株在33℃、7%CO2条件下,培养于含有15%胎牛血清的DMEM高糖培养基中。
1.3 CCK-8比色法检测细胞存活率
HEI-OC1听细胞株生长至70%融合时,接种于96孔培养板中,过夜培养,经不同浓度的CoCl2处理24 h,或用Quer预处理2 h后再与CoCl2共同处理24 h。处理完成后,每孔加10 μl CCK-8,室温下轻摇 3 h,用酶标仪(ELX-800,BIO-TEK,USA)记录450 nm波长处的吸光度(A)。取4孔A值的平均数按公式计算细胞存活率,即细胞存活率(%)=(A处理组-A空白组)/(A对照组-A空白组)×100%,重复 3次。
1.4 Western blot法检测HSP70蛋白的表达
HEI-OC1听细胞株被接种于35 mm培养皿内,经CoCl2处理和(或)Quer预处理后再与CoCl2共同处理。处理完成后,用预冷的PBS洗2次,加入细胞裂解液,4℃静置30 min。12 000 r/min离心10 min,取上清液,用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上。用5%脱脂奶粉(TBS-T缓冲液)封闭1.5 h,随后加入HSP70抗体(1∶600)或 β-actin 抗体(1∶10 000),4℃轻摇过夜,TBS-T 缓冲液洗3次,加入辣根过氧化物酶标记的二抗,孵育1.5 h,TBS-T缓冲液洗3次。ECL显色后,用ImageJ 1.41o进行灰度分析。
1.5 统计学处理
所有数据用SPSS 13.0软件进行统计学分析,结果以均数±标准差(±s)表示,组间差异采用 One-way ANOVA 及LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 氯化钴诱导HEI-OC1 听细胞的缺氧性损伤
见图1。图1显示,150~750 μmol/L浓度的CoCl2作用听细胞24 h后,细胞存活率显著降低,与对照组比较,差异有统计学意义(P<0.05、P<0.01),经相关性分析显示,具有剂量依赖关系(r=-0.99)。此结果表明,化学性缺氧模拟试剂CoCl2能够在听细胞诱导缺氧性损伤作用。
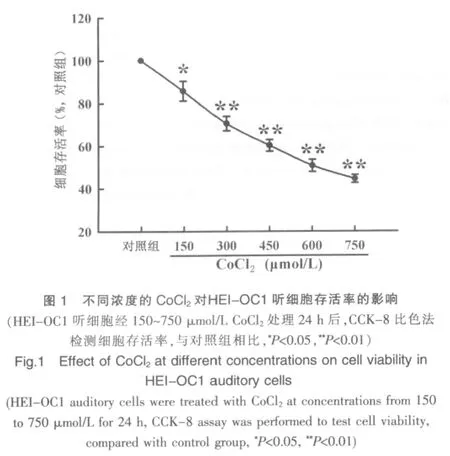
2.2 氯化钴上调HEI-OC1 听细胞内HSP70 的表达
听细胞经300 μmol/L的CoCl2处理不同时间后,Western blot检测显示,细胞内HSP70的表达较基础水平显著上调(图 2),30 min 时开始升高(P<0.05),240 min 时达到高峰(P<0.01)。
2.3 槲皮素加重氯化钴诱导的HEI-OC1 听细胞毒性
为了明确HSP70的表达上调在CoCl2诱导听细胞损伤中的作用,在 300 μmol/L CoCl2处理 24h 前,分别用 20、40和80 mol/L Quer预处理2 h再与CoCl2共培养,结果见图3,Quer剂量依赖性地加重了CoCl2的听细胞损伤作用,而Quer本身对细胞活力并无明显影响(P>0.05)。

2.4 槲皮素抑制氯化钴诱导的HEI-OC1 听细胞内HSP70 的表达上调
听细胞在经300μmol/L的CoCl2处理120min前,用80mol/L Quer预处理120 min再与CoCl2共培养,Western blot检测显示见图4,Quer本身不影响HSP70的水平,但可明显抑制CoCl2诱导的细胞内HSP70的表达上调(P<0.01)。此结果进一步证实,适应性HSP70表达上调对缺氧诱导的听细胞损伤具有抑制作用。

3 讨论
本研究显示化学性缺氧模拟试剂CoCl2能在HEI-OC1听细胞中引起缺氧性细胞损伤作用,并上调HSP70的蛋白表达。适应性HSP70的表达增加对CoCl2引起的缺氧性听细胞损伤具有明显的抑制作用。这些数据可为以HSP70为靶点的缺氧性耳蜗外毛细胞损伤的治疗提供有益的理论支持。
缺氧性耳蜗外毛细胞损伤是分娩过程中新生儿窒息最常见的并发症之一,如不及时给予恰当的治疗措施,听觉障碍将会影响人的一生[4]。因而,通过建立实验模型,深入研究缺氧性耳蜗损伤的机制具有重要的现实意义和应用价值。目前使用的动物模型包括让动物呼出的气体进行重复呼吸、堵塞动物的气管或者结扎小脑前下动脉以阻断耳蜗的血流,这些方法虽然可以获得缺氧性听觉障碍的模型,但由于此时动物并非处于生理状态,因而反映的不仅仅是耳蜗缺氧引起的听觉障碍,也可能与听性脑干受损有关[5]。CoCl2是常用的缺氧模拟试剂,其中钴能与铁竞争氧,从而达到常氧、缺氧的目的,已经在缺氧性损伤的细胞模型中被广泛应用[6-7]。本研究采用CoCl2损伤具有耳蜗外毛细胞特性的HEI-OC1听细胞,能够很好地模拟缺氧性耳蜗损伤,为进一步分子机制的探讨提供了简单易行的手段。
HSP70是一类广泛存在于体内的应激反应蛋白质,在多个器官,如心、脑、肝、肾等组织中均见表达,但是对于其在正常及损伤的耳蜗内的表达尚存在不同的观点[2,8-9]。本文观察到在未受刺激的HEI-OC1听细胞内有低水平的HSP70的表达,但当给予缺氧刺激时,HSP70的表达呈剂量依赖性地增加。研究显示,在螺旋缘、血管纹、柱状细胞及外毛细胞中可在转录水平检测到HSP70的表达[2],这为本文提供了重要的实验支持。本文推测,HSP70表达增加可能是细胞为了对抗外源性的损伤作用而启动了自身的防御机制。
关于HSP70在外周听觉系统中的确切作用目前尚不清楚。有些学者认为,在听觉系统遭受噪声、缺血、缺氧等损害时,HSP70的表达升高具有细胞保护作用,能对抗这些应激反应,使听觉细胞免受进一步的损害[10];但是由于其在对应激反应敏感的细胞中HSP70优先表达,故也有研究认为含有HSP70免疫活性的细胞可能暗示是易受损害的部位[11]。槲皮素是HSP70的抑制剂,可在多种组织细胞抑制HSP70的表达[12]。为了明确HSP70在CoCl2损伤听细胞过程中的作用,本文进一步应用槲皮素抑制HSP70的表达,发现槲皮素对正常细胞生长没有明显的影响,但是可以加重缺氧对细胞的损伤作用,从而证实了适应性HSP70表达增加可保护听细胞对抗缺氧诱导的损伤。
总之,本结果为缺氧性耳毒性的研究提供了简单易行的实验模型,更重要的是,为HSP70在缺氧性耳毒性中的病理生理学意义提供了重要的实验依据。
[1]Mazurek B,Haupt H,Gross J.Pharmacotherapy in acute tinnitis,the special role of hypoxia and ischemia in the pathogenesis of tinnitis[J].HNO,2006,54(1):9-15.
[2]Neely JG,Thompson AM,GowerdJ.Detection and localization of heat shock protein 70 in the normalguinea pig cochlea [J].Hear Res,1991,52(2):403-406.
[3]Kim HJ,So HS,Lee JH,et al.Heme oxygenase-1 attenuates the cisplatin-induced apoptosis of auditory cells viadown-regulation of reactive oxygen speciesgeneration [J].Free Radic Biol Med,2006,40(10):1810-1819.
[4]罗元芝,胡南,刘勇,等.脑干听觉诱发电位检测在新生儿窒息脑损伤诊断中的价值[J].医学临床研究,2008,25(2):344-345.
[5]丁大连,曲雁,亓卫东,等.缺氧性内耳损害[J].中华耳科学杂志,2008,6(4):468-474.
[6]Chandel NS,Maltepe E,Goldwasser E,et al.Mitochondrial reactive oxygen species trigger hypoxia-induced transcription[J].Proc Natl Acad Sci USA,1998,95(20):11715-11720.
[7]Chen SL,Yang CT,Yang ZL,et al.Hydrogen sulfide protects H9c2 cells against chemical hypoxia-induced cell injuries[J].Clin Exp Pharmacol Physiol,2010,37(3):316-321.
[8]Pratt WB,Morishima Y,Peng HM,et al.Proposal for a role of the Hsp90/Hsp70-based chaperone machinery in making triagedecisions when proteins undergo oxidative and toxicdamage [J].Exp Biol Med(Maywood),2010,235(3):278-289.
[9]Young JC.Mechanisms of the Hsp70 chaperone system[J].Biochem Cell Biol,2010,88(2):291-300.
[10]Lim HH,Jenkins OH,Myers MW,et al.Detection of HSP 72 synthesis after acoustic overstimulation in rat cochlea[J].Hear Res,1993,69(1/2):146-150.
[11]王鹏举.热休克蛋白70与自身免疫性内耳病[J].听力学及言语疾病杂志,2000,8(2):117-119.
[12]Alekseeva OS,Vetosh AN,KorzhevskiidE,et al.Influence of quercetin on the progress of nitrogen narcosis and accumulation of heat shock proteins in cells of the rat cerebral cortex[J].Dokl Biol Sci,2010,430:11-13.

