利用Minitab优化耐高温淀粉酶发酵培养条件
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
在纺织工业中,耐高温的α-淀粉酶可以作为退浆酶将织物的浆料退浆除去,并且具有有效、经济、环保等优点[1]。产耐高温α-淀粉酶的菌种有许多,目前,研究和应用较多的是芽孢杆菌属(Bacillus)[2],常用的是地衣芽孢杆菌(Bacillus licheninformis)、枯草芽孢杆菌(Bacillus subtilis)、嗜热芽孢杆菌(Bacillus stearothermophilus)等。另外,也有关于嗜热细菌和古菌的研究[3],不过它们最适生长温度较高,多为80 ℃以上,生长条件较苛刻,并不适合工业化生产的要求。因此,常温菌株芽孢杆菌属(Bacillus)仍然是研究的重点。本实验室通过筛选,获得一株产耐高温α-淀粉酶的枯草芽孢杆菌(Bacillus subtilis),命名为Bacillus subtilis C1,并对其所产粗酶的相关性质进行了研究。现对其进行进一步研究,以确定其最优发酵条件。Minitab作为世界著名的数据分析软件,具有强大的实验设计(design of experiments,DOE)功能及数据管理、统计分析等功能[4]。在此,本文作者进行Plackett-Burman实验[5]、最陡爬坡实验[6]和 Box-Behnken等实验[7],并利用 Minitab软件对Bacillus subtilis C1发酵生产的相关影响因素进行研究和探索。
1 材料与方法
1.1 菌种及培养基
菌种由本实验室选育。
种子培养基成分为:淀粉 1%(质量分数,下同),蛋白胨 1%,酵母粉 0.5%,NaCl 1%。
基础发酵培养基成分为:麸皮 1%,棉粕粉 1%,酵母粉 0.2%,NaCl 0.5%。
采用500 mL摇瓶盛装200 mL培养基。
1.2 粗酶液制备
采用三角瓶(500 mL)装培养基200 mL,接种后于45 ℃恒温振荡培养48 h,在4 ℃取发酵液于10 000 r/min离心20 min,上清液即为粗酶液。
1.3 酶活测定
采用Yoo改良法测定酶活[8−9]。在20 mL试管中加入5 mL 0.5%淀粉溶液(用pH=6.0磷酸盐缓冲液新鲜配制),在70 ℃预热10 min。然后加入稀释一定倍数的0.5 mL酶液,在70 ℃准确反应5 min后,加入5 mL 0.1 mol/L HCl终止反应。取0.5 mL反应液加入盛有5 mL 0.4 mmol/L I2-KI溶液的试管中显色。在波长为620 nm处测定吸光度。酶活力单位U定义:在pH为6.0、温度为70 ℃、于5 min水解1 mg淀粉所需的酶量。
1.4 实验设计
1.4.1 单因素实验
采用单次单因素法[10],假设各因素间不存在交互作用,1次改变培养基的1个因素的水平而其他因素保持不变,然后逐个进行考察优化。
作为Plackett-Burman实验的准备,此实验用来确定最佳C源、N源、温度和初始pH、转速等。1.4.2 Plackett-Burman实验设计
Plackett-Burman实验设计(PBD)[11]被称作筛选实验设计,当实验因素较多时,实验进行不方便,且不考虑交互作用时,才会考虑使用此方法。虽然与其他方法相比,Plackett-Burman实验设计不能区分主效应与交互作用的影响,但可以确定对结果影响显著的因素,从而达到筛选的目的。
Plackett-Burman实验对每个因素取2个水平来进行分析,通过比较各因素2个水平的差异与整体的差异来确定因素的显著性。通过Plackett-Burman实验的筛选,能避免在后期的优化实验中由于因素数太多或部分因素不显著而造成的实验资源浪费。
利用Minitab软件创建Plackett-Burman实验,每个因素取2个水平。按照传统的实验方式,高水平一般为低水平的 1.0~1.5倍。在前期单因素实验获得结果的基础上,本实验选取影响较大的6个因素,即基础发酵培养基的成分:麸皮、棉粕粉、酵母粉、NaCl以及用于稳定酶构象而使酶活增加的 CaCl2和诱导物淀粉。其他因素如温度、初始pH、转速等均恒定,选用变量个数N=12的Plackett-Burman设计表,另加3个虚拟变量,用于考察实验误差。各因素所代表参数、水平见表1,实验设计及结果见表2。

表1 Plaekett-Burman实验设计参数和水平Table 1 Factors levels of Plackett-Burman design
1.4.3 最陡爬坡实验设计
响应面的拟合方程必须在紧接邻域内才近似真实情形,在其他区域,拟合方程与被近似的方程毫无相似之处,几乎无意义;因此,找出主要因素后,必须通过使主要因素同时朝向响应值的最大方向变化,逼近最大响应区间,找出峰值,才能建立有效响应面方程[12]。在最陡爬坡实验中,对酶活影响不显著的其他因素取最低水平,而影响显著的3个因素以实验值的变化方向为爬坡方向,根据各因素效应值与比例来确定变化步长,最快地逼近最佳值区域。
1.4.4 Box-Behnken实验设计
Box-Behnken(BBD)实验设计是一种常用的响应面分析法,用来评价指标和因素间的非线性关系,估计一阶、二阶与一阶交互作用项的多项式模式,是一种有效的响应面设计法[13]。

表2 Plaekett-Burman实验设计表及结果Table 2 Design matrix and experimental results of Plackett-Burman design

表3 Box-Behnken实验设计表及实验数据Table 3 Design matrix and experimental results of Box-Behnken design
结合前面实验结果,利用Minitab软件创建Box-Behnken实验设计。实验中的3个因素为麸皮、棉粕粉和淀粉,每个因素取3个水平。实验共有15个实验点,其中有12个析因点和3个零点。对零点实验进行3次,以估计误差。
Adinarayana等[14]论述了响应面法的主要原理。根据用多项式回归分析对实验数据进行拟合,可得到二次多项式。它是一个描述响应变量(因变量)与自变量(操作条件)关系的模型。
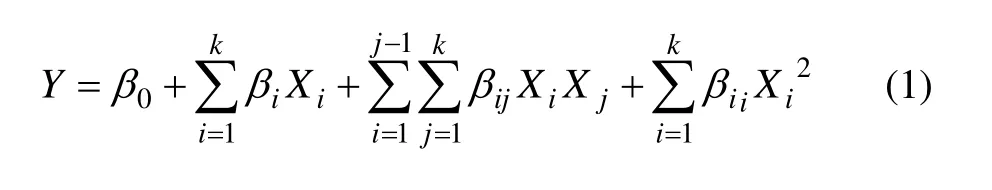
其中:Y为预测响应值;β0,βi,βii和βij分别为常量、一次项系数、二次项系数和交互作用系数;Xi为自变量编码,

xi为自变量真实值;x0为试验中心点处自变量;xΔ为自变量的变化步长。
2 结果分析
2.1 Plackett-Burman实验结果分析
利用Minitab对Plackett-Burman实验数据进行分析,结果如表4所示,其标准偏差为61.041 0,预测误差平方和为268 272,回归方程的系数R2为0.985 8;调整后R2为0.921 9。
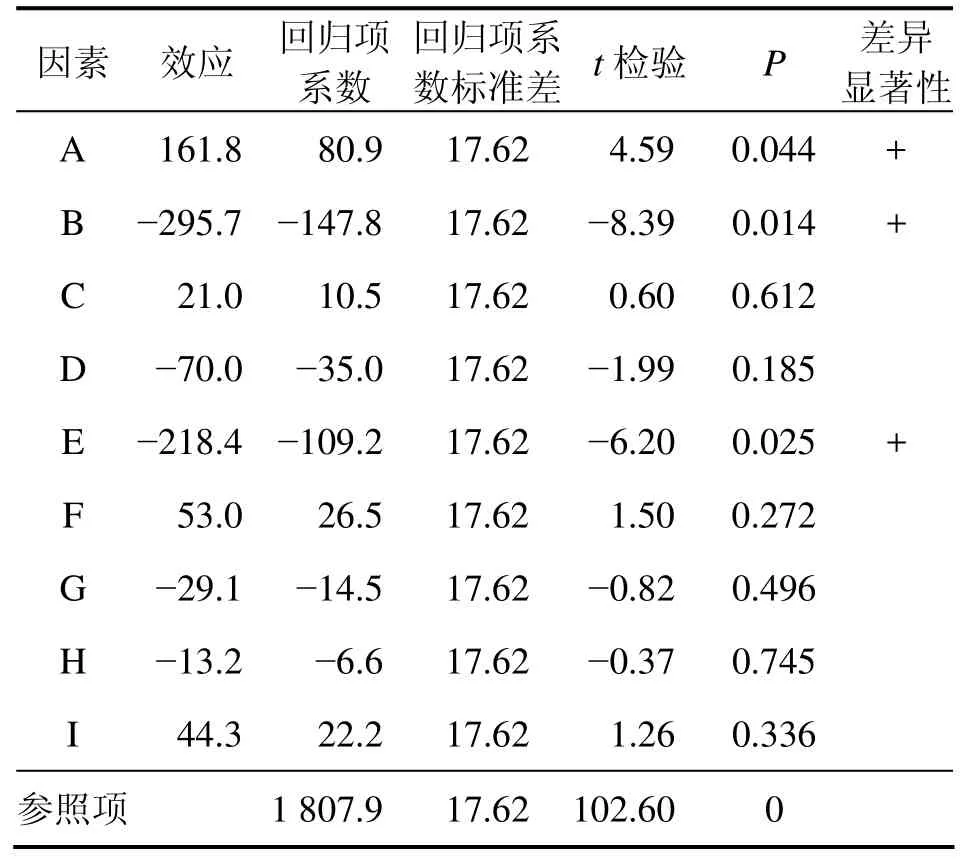
表4 Plackett-Burman实验设计分析结果Table 4 Analytic result of Plackett-Burman experiment design
从单因素效应的检验结果可以看出:主效应中,因素A(麸皮)、B(棉粕粉)、E(淀粉)效应显著,其P分别为0.044,0.014和0.025,均小于0.050,可以作为进一步优化的因素。其他因素对结果影响不大,在进一步研究中,取中间水平,对影响效果不进行分析。
2.2 最陡爬坡实验结果分析
对Plackett-Burman实验结果进行分析,发现因素A(麸皮)对酶活具有正促进作用,B(棉粕粉)、E(淀粉)对酶活具有负促进作用,适当增加A(麸皮),减少B(棉粕粉)、E(淀粉)的量,会使酶活增加。实验设计和结果如表5所示。

表5 最陡爬坡试验设计结果Table 5 Design matrix and experimental results ofsteepest accent
由表5可知:第4组实验的酶活最大。这说明最优点在第4组实验附近。故以实验4的条件为响应面实验因素水平的中心点,麸皮、棉粕粉、淀粉质量分别为2.20,1.80和0.11 g,进行下一步研究。
2.3 Box-Behnken实验结果分析
实验数据用 Minitab进行分析,并得出回归方程系数显著性检验、方差分析结果分别如表6~7所示。
由表6可知酶活与麸皮、棉粕粉、淀粉含量的关系可用下列回归方程来表示:Y=2 335.43+75.40X1−49.38X2−33.02X3−48.38X12−223.67X22−61.55X32−13.37X1X2−3.29X1X3−32.92X2X3(3)其标准偏差为39.964 9,预测误差平方和为98 942.3,回归方程的系数R2为0.971 7;R2经调整后为0.920 6。
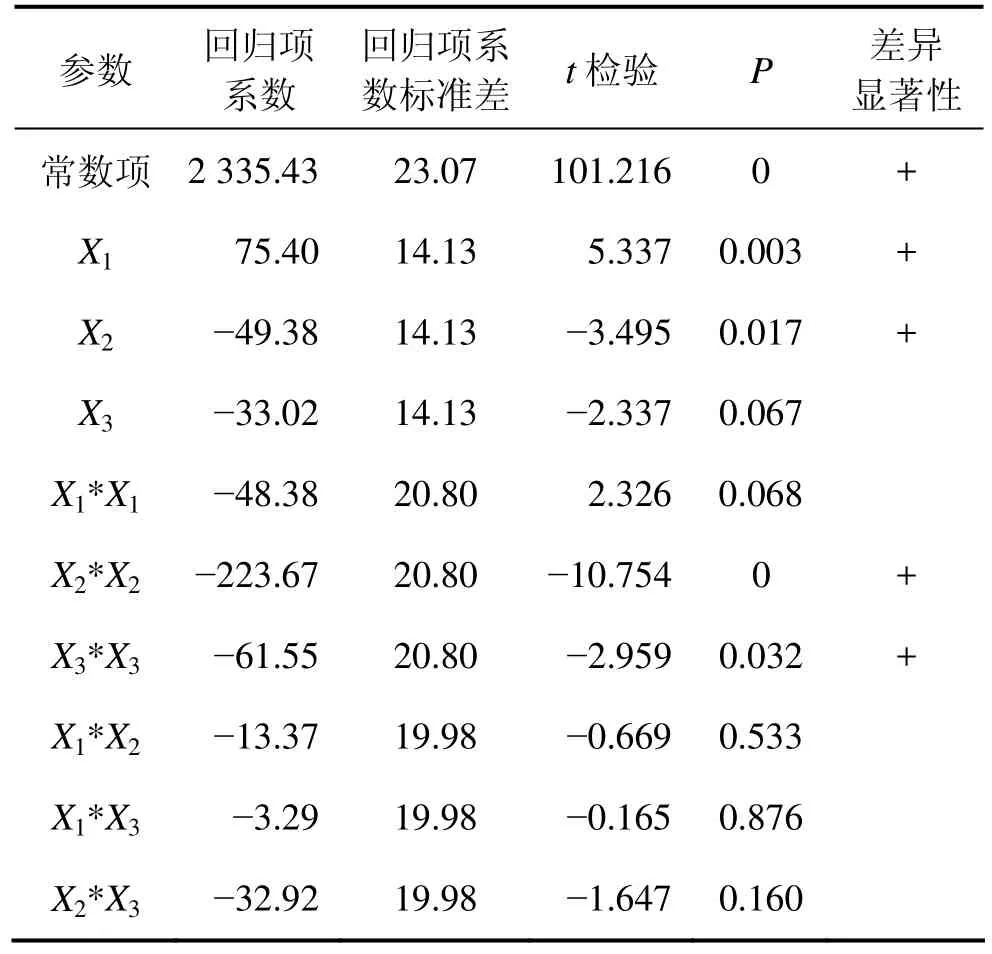
表6 回归方程系数显著性检验Table 6 Significance test of regression coefficient
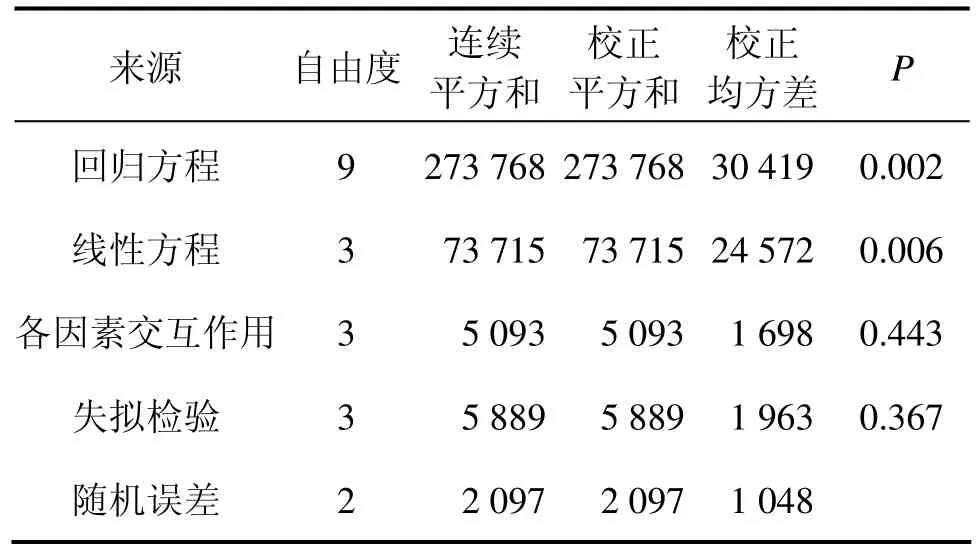
表7 回归方程的方差分析Table 7 ANOVA for regression equation
从表6可以看出,模型方程中常数项P为0,表明该模型是显著的。同时,模型中的参数X1,X2,X2*X2,X3*X3的P分别为0.003,0.017,0和 0.032,均小于0.050,表明这些参数也是显著的。
失拟(Lack-of-Fit)表示模型预测值与实际值不拟合的概率,反应拟合出来的模型与实验数据的接近程度。从表7可知:模型失拟检验的P为0.367,大于0.050,因此,回归模型适合,不需对回归议程调整。Joglekar等[15]认为:1个相关性好的回归模型,R2不应低于0.8。从表6所示数据可得:R2为 0.971 7,调整后R2为0.920 6,这2个值高于0.900 0且较接近,表示可以使用该模型来分析响应值。
各因素间交互作用对响应的影响如图1~3所示。可见:麸皮和棉粕粉、棉粕粉和淀粉间的交互作用对酶活的影响显著,而麸皮和淀粉间交互对酶活影响不显著。为了进一步验证最佳值,对回归方程进行分析,令一阶偏导等于0,并整理得:
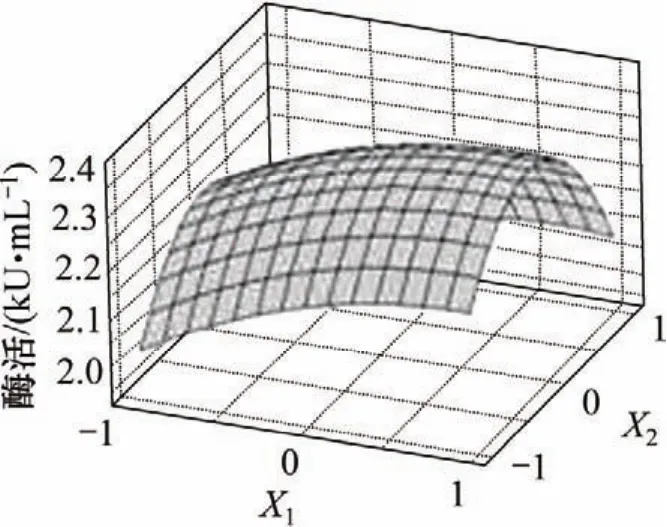
图1 麸皮(X1)和棉粕粉(X2)交互作用对酶活的影响的响应曲面Fig.1 Response surface plot for interaction effects of wheat bran and cotton seed meal on enzyme activity
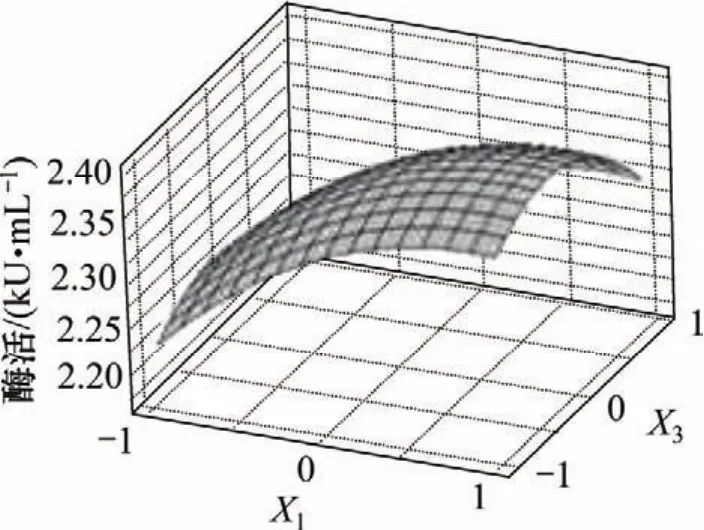
图2 麸皮(X1)和淀粉(X3)交互作用笃酶活的影响的响应曲面Fig.2 Response surface plot for interaction effects of wheat bran and starch on enzyme activity
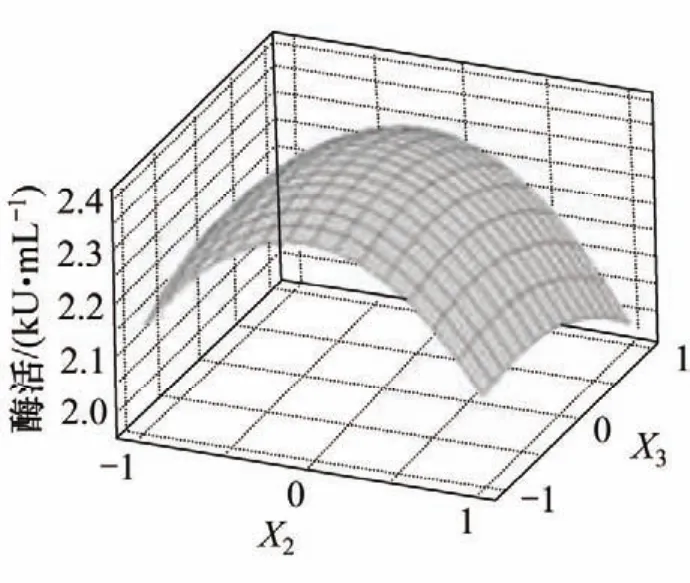
图3 棉粕粉(X2)和淀粉(X3)交互作用对酶活的影响的响应曲面Fig.3 Response surface plot for interaction effects of cotton seed meal and starch on enzyme activity

解上述方程组,得各因素编码分别为X1=0.80,X2= −0.12,X3= −0.26。代入式(3),可得Y=2 372.86。又由各因素编码与其真实值之间的关系,可求得当酶活为2 372 U/mL时,麸皮、棉粕粉和淀粉真实质量分别为2.16,1.98和0.10 g。为了对预测的结果进行验证,用以上得到的最优培养基进行3次重复实验,所得平均酶活为2 329 U/mL,与预测值(2 372 U/mL)相差 1.83%,证实了模型的有效性。酶活为优化前酶活(185.60 U/mL)的12.55倍。
3 结论
(1) 在单因素试验的基础上,借助 Minitab 将响应面法应用于产耐高温 α-淀粉酶生产菌株Bacillus subtilis C1发酵培养基的优化。回归分析结果表明:麸皮和棉粕粉、棉粕粉和淀粉间的交互作用对酶活的影响显著。
(2) 通过对响应方程的回归分析,得到 Bacillus subtilis C1培养基的最佳成分(200 mL):麸皮2.16 g,棉粕粉1.98 g,酵母粉0.40 g,NaCl 1.00 g,CaCl20.40 g,淀粉0.10 g。经过实验验证,该营养条件下的酶活为2 329 U/mL,约是培养基优化前酶活的12.55 倍,为工业化生产提供了一定的理论依据。
[1] 蒲宗耀, 陈松, 卢涛, 等. 耐碱耐温淀粉酶性能及退浆工艺试验研究[J]. 纺织科技进展, 2006(1): 24−26.PU Zong-yao, CHEN Song, LU Tao, et al. Study on thermo-stable amylase desizing for cotton fabric(Ⅰ)[J]. Progress in Textile Science & Technology, 2006(1): 24−26.
[2] Sajedi R H, Manesh H N, Khajeh K, et al. A Ca-independent α-amylase that is active and stable at low pH from the Bacillus sp. KR-8104[J]. Enzyme and Microbial Technology, 2005,36(5/6): 666−671.
[3] Bertoldo C, Antranikian G. Starch-hydrolyzing enzymes from thermophilic archaea and bacteria[J]. Curr Opin Chem Biol,2002, 6(2): 151−160.
[4] Basem S. Manufacturing and design for six sigma (X-FSS)[M].Michigan: University of Michigan, 2002: 15−20.
[5] Montgomery DC. Design and analysis of experiments[M]. 5th ed.New York: John Wiley & Sons, 2000: 46−51.
[6] Muralidhar R V, Chirumamila R R, Marchant R. A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J].Biochem Eng, 2001, 9(1): 7−23.
[7] Ferreira S L C, Bruns R E, Ferreira H S, et al. Box-Behnken design: An alternative for the optimization of analytical methods[J]. Analytica Chimica Acta, 2007, 597(2): 179−186.
[8] Young J Y, Juan H, Randolph T. Hatch. Comparison of α-amylase activities from different assay methods[J].Biotechnology and Bioengineering, 1987, 30(1): 147−151.
[9] 史永昶, 姜涌明. 五种 α-淀粉酶测活方法的比较研究[J]. 微生物学通报, 1996, 23(6): 371−373.SHI Yong-chang, JIANG Yong-ming. Comparision of five methods for the assaying of α amylase activity[J]. Microbiology,1996, 23(6): 371−373.
[10] Ertola R J, Giulietti A M, Castillo F J. Design, formulation and optimization of media[J]. Bioprocess Technol, 1995, 21:89−137.
[11] 钱俊青, 周文武, 匡春兰. 响应面法优化丁酸缩水甘油酯的酶法拆分工艺[J]. 生物工程学报, 2008, 24(6): 1062−1067.QIAN Jun-qin, ZHOU Wen-wu, KUANG Chun-lan.Optimization of enzymatic resolution technique of glycidyl butyrate via response surface methodology[J]. Chinese Journal of Biotechnology, 2008, 24(6): 1062−1067.
[12] LI Chan, BAI Jing-hua, CAI Zhao-ling, et al. Optimization of a cultural medium for bacteriocin production by Lactococcus lactis using response surface methodology[J]. Journal of Biotechnology, 2002, 93(1): 27−34.
[13] BOX G E P, BEHNKEN D W. Some new three level designs for the study of quantitative variables[J]. Technometrics, 1960 (2):455−467.
[14] Adinarayana K, Ellaiah P, Srinivasulu B, et al. Response surface method of logical approach to optimize the nutritional parameters for neomyc in production by Streptomyces marinensis under solid-state fermentation[J]. Process Biochemistry, 2003, 38(11): 1565−1572.
[15] Joglekar A M, May A T. Product excellence through design of experiments[J]. Cereal Foods World, 1987, 32: 857−868.

