黄瓜抗病基因同源序列的表达分析
许春梅,秦智伟,丁国华,周秀艳
(1.东北农业大学园艺学院,哈尔滨 150030;2.哈尔滨师范大学生命科学与技术学院,哈尔滨 150025)
霜霉病(Downy Mildew)是一种危害黄瓜生产的世界范围内的叶部病害,如果防治不力则会造成严重损失[1-2]。该病害在黄瓜整个生育期都能发生,主要危害黄瓜叶片,幼苗子叶期即可染病,子叶上出现褪绿色的不规则形小斑点,渐渐变成黄褐色。发病初期时,叶背或者叶缘出现水浸状淡黄色的不规则小斑点,随着病情发展,病斑会逐渐扩大,沿着叶脉形成多角型黄色病斑。发病严重时小病斑汇集成大病斑,潮湿条件下病斑背面会长出灰黑色的霉层。发病叶由下向上发展,严重时导致全株叶片枯萎。1~2周内就能使瓜田全部枯黄,黄瓜产量下降,甚至造成绝产。
抗病基因类似序列(Resistance Gene Analog,RGA)是存在于植物基因组中与已分离出来的30多个抗病基因某些保守序列存在较高同源性的DNA片段[3]。RGA在植物基因组中大量存在,与抗病基因相关的RGA只是其中一部分[4]。不过就现有的RGA的研究来看,NBS类保守域基本只出现在抗病基因当中,而STK(PK)类和LRR类的出现比较复杂。
RGA1、RGA2、RGA4、RGA5、RGA8和RGA10是己克隆的黄瓜抗病基因同源序列片段[3],其中部分片段具有NBS类型抗病基因的磷酸结合环(p-Loop)和保守结构域(Kinase2)结构。与己克隆的甜瓜RGA基因存在较高的同源性。蛋白同源性分析显示RGA的推测产物与几百种蛋白质存在很高的同源性,这些蛋白质基本上都是假定的抗病蛋白[5]。
本研究基于RGA基因在黄瓜中的多态性特征及其产物的抗病蛋白同源性特征,采用半定量方法分析其在黄瓜植株各部位和霜霉菌诱导后各时期的表达情况。
1 材料与方法
1.1 材料
试验材料为黄瓜抗霜霉病品种东农129,将种子播种于营养钵中,在人工气候箱中按光照12 h、黑暗12 h的光周期,18~25℃下培养。在幼苗长至三叶一心时,接种霜霉菌,采样时间为诱导后0、6、12、18、24、48、72 和 96 h,另对未做任何人工诱导的东农129黄瓜植株材料的子叶、根、果实等采样保存。
1.2 总RNA、DNA提取与完整性检测
用上海生工的Trizol RNA提取试剂盒分别提取黄瓜真叶、子叶、茎、果实、根及接种霜霉菌不同时间段的真叶的RNA;用常规方法提取未经人工接种霜霉菌的真叶总DNA;用琼脂糖电泳和紫外分光光度计检测RNA和DNA的纯度和浓度。
1.3 cDNA的合成
用试剂盒TaKaRaDRRT1900A合成cDNA。
1.4 定量
扩增18S内参基因,通过调整反应体系中cDNA模板量和各种反应底物的浓度,使琼脂糖电泳上各诱导时间点的PCR产物亮度一致。
1.5 黄瓜抗病基因同源序列RGA的扩增
1.5.1 引物设计
根据己获得的黄瓜同源序列RGA基因的编码区序列设计了一对特异性引物(见表1),由上海生工合成,PAGE纯化。
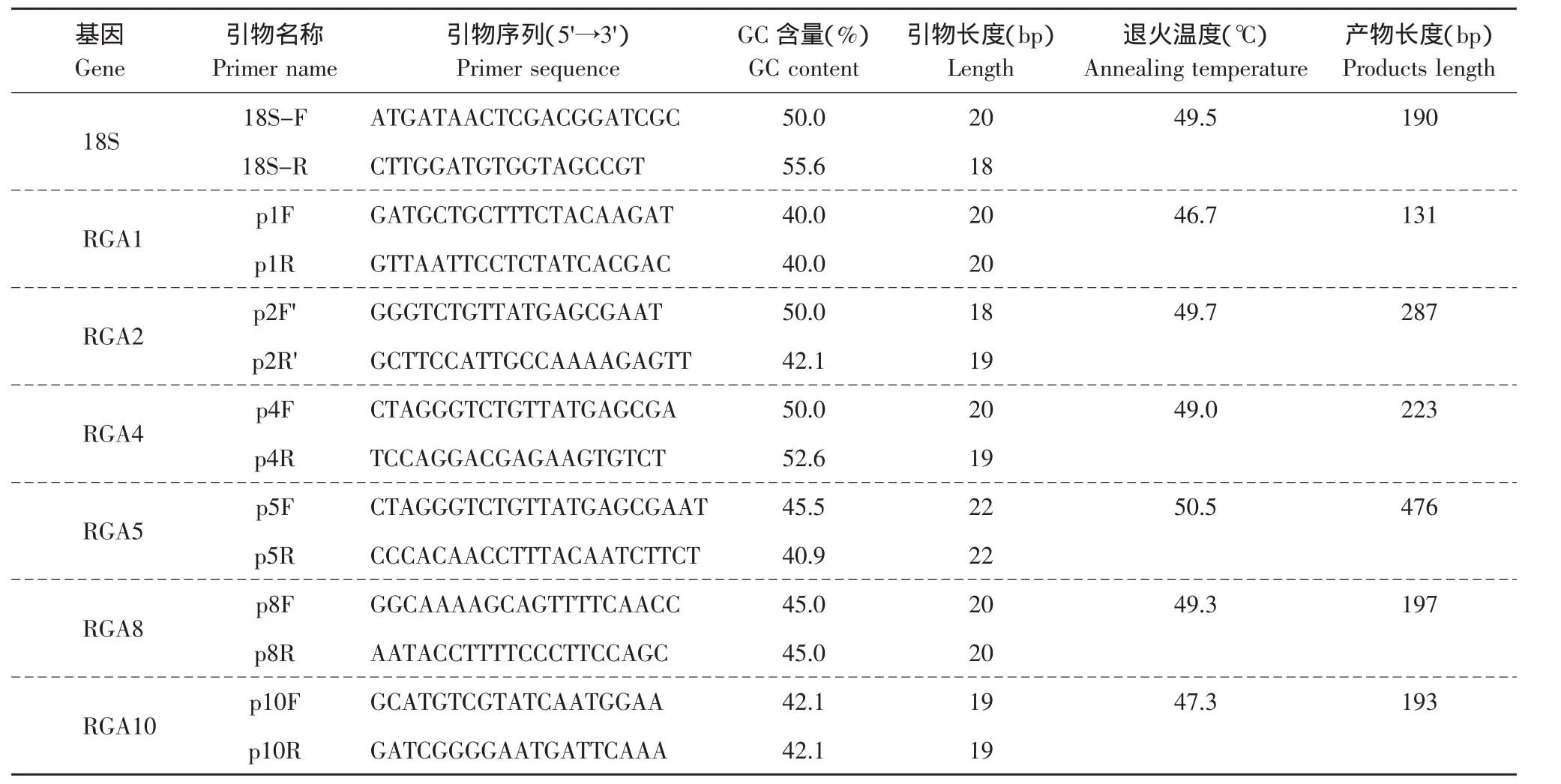
表1 用于连锁和资源分析的RGA特异引物Table1 Special primers of CsRGA for analysis of linkage and germplasm in cucumber
1.5.2 PCR扩增
PCR反应采用25 μL反应体系,分别加入等量不同器官及诱导后不同时间点的cDNA(1 μL)及未做任何诱导的DNA模板(100 ng),10×PCR Buffer(Mg2+)2.5 μL,rTaqDNA 聚合酶(购自 TaKaRa 公司)0.2 μL(5 U·μL-1),dNTPs(购自TaKaRa公司)1.0μL(2.0mmol·L-1),上游引物1.0 μL(20 μmol·L-1),下游引物1.0 μL(20 μmol·L-1),ddH2O 17.8 μL。PCR反应程序为:94℃预变性2 min,94℃变性30 s,退火30 s,72℃延伸90 s,35个循环,72℃延伸10 min。反应在Eppendorf梯度PCR仪上进行。取5 μL PCR产物加上样缓冲液经1%琼脂糖凝胶电泳,EB染色,紫外灯观察照相。
2 结果与分析
2.1 定量
用半定量RT-PCR方法对黄瓜RGA基因进行分析,18S基因在霜霉病诱导后不同时间的叶片中扩增条带亮度基本相同(见图1),以此为对照分析了黄瓜抗病植株东农129中RGA基因的表达情况。
2.2 霜霉菌诱导后RGA基因表达情况
RGA1基因在未诱导的黄瓜抗霜霉病品种东农129叶片中有一定量表达,但表达相对含量较低,在其他组织中无表达,当黄瓜植株受霜霉菌诱导后,诱导18 h后表达水平明显提高,诱导24 h相对表达量达最高水平,48 h表达量下降(见图2)。
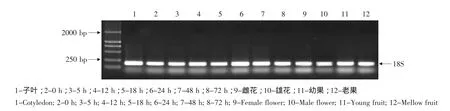
图1 接种霜霉病菌后的黄瓜18S基因的PCR产物的电泳Fig.1 Electrophoresis of PCR product of 18S gene in cucumber inoculated with P.cubensis
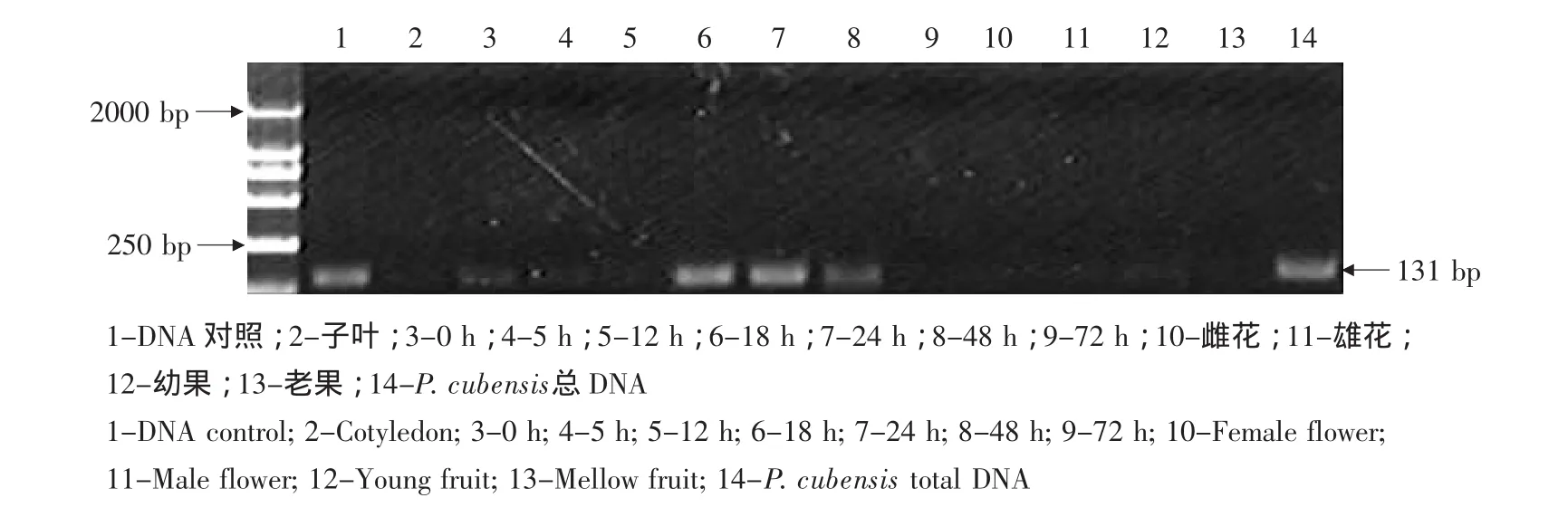
图2 接种霜霉病菌后的黄瓜RGA1基因PCR产物的电泳Fig.2 Electrophoresis of PCR product of RGA1 in cucumber inoculated with P.cubensis
RGA4基因在未诱导的黄瓜抗霜霉病品种东农129植株子叶中无表达,在其他器官中均有表达,在霜霉菌诱导植株中也有表达,且表达量明显增强(见图 3)。
RGA5在未诱导霜霉病植株中均无表达,但诱导后12 h开始表达,24 h表达相对含量达最高水平,诱导后72 h表达量达诱导前水平(见图4)。

图3 接种霜霉病菌后的黄瓜RGA4基因PCR产物的电泳Fig.3 Electrophoresis of PCR product of RGA4 in cucumber inoculated with P.cubensis
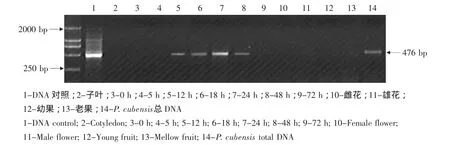
图4 接种霜霉病菌后的黄瓜RGA5基因PCR产物的电泳Fig.4 Electrophoresis of PCR product of RGA5 in cucumber inoculated with P.cubensis
由图5可知,RGA8在抗霜霉病品种东农129黄瓜植株经霜霉菌诱导后各时间点均有表达,诱导后24 h表达达到高峰,然后慢慢减弱。在叶片以外部位仍表达,但表达量较弱。在霜霉菌诱导后总cDNA中仍有大量表达。
RGA10基因在抗霜霉病品种东农129黄瓜植株经霜霉菌诱导后各时间点均有表达,且诱导前后相对表达量无明显差异(见图6)。

图5 接种霜霉病菌后的黄瓜RGA8基因PCR产物的电泳Fig.5 Electrophoresis of PCR product of RGA8 in cucumber inoculated with P.cubensis
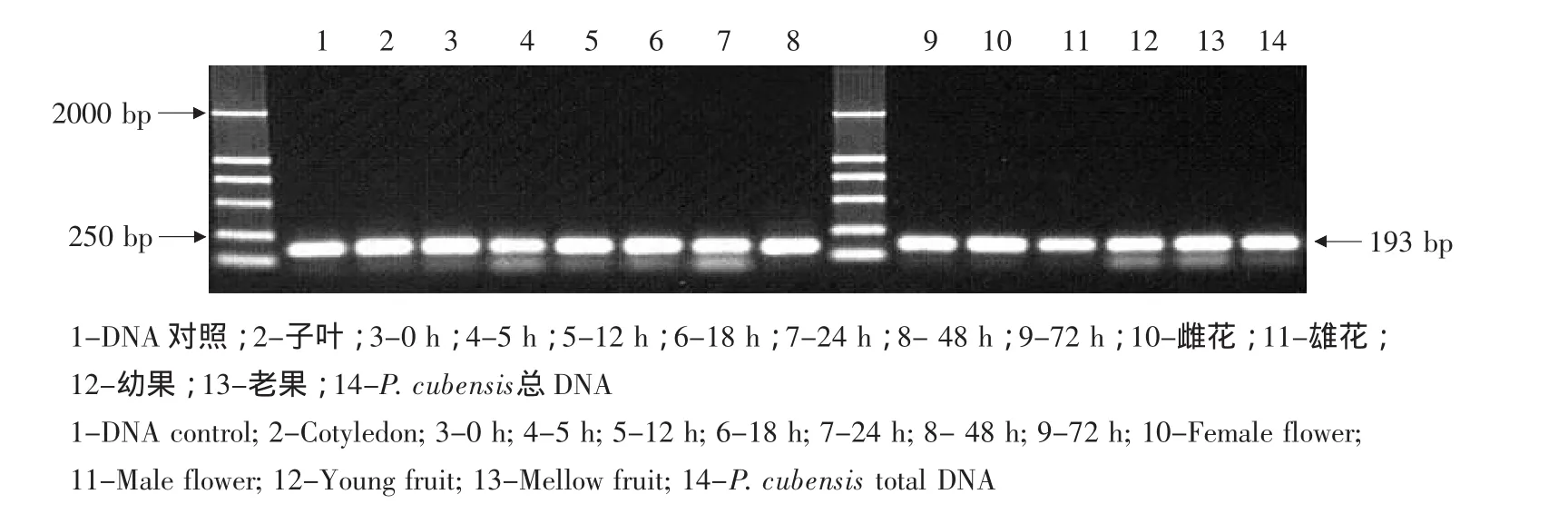
图6 接种霜霉病菌后的黄瓜RGA10基因PCR产物的电泳Fig.6 Electrophoresis of PCR product of RGA10 in cucumber inoculated with P.cubensis
RGA2基因在抗病品种东农129中经霜霉菌诱导前后均有表达,在诱导后表达量有所增强。由以上表达情况可以看出,霜霉菌可以影响多数RGA基因的表达,经霜霉菌诱导后表达相对含量增强的基因有 RGA1、RGA2、RGA4、RGA5、RGA8;而RGA10的相对表达量在霜霉菌诱导前后都比较高,初步认为RGA10的表达不受霜霉菌的影响。
3 讨 论
a.由以上表达情况可初步证明RGA是与黄瓜抗霜霉病有关的调控基因,RGA的表达情况和霜霉菌有密切的关系,这为以后进行RGA基因全长克隆以及黄瓜抗病性的研究奠定了基础。
b.以稳定表达的18S RNA基因作为对照[6],用半定量的RT-PCR方法来检测基因表达情况,并进行定量分析。与传统的检验基因表达的Northern杂交相比较,具有特异性高,操作简单,可靠性强的优点,在植物基因的表达分析方面应用广泛。Wan等以微管蛋白基因作为对照,用半定量RTPCR方法研究小麦的锌蛋白基因属组成型表达基因[7]。王维平等则以水稻的肌动蛋白基因为对照,用半定量RT-PCR方法,研究发现水稻COI1基因表达受茉莉酸甲酯诱导[8]。
c.运用半定量RT-PCR方法研究黄瓜RGA基因在转录水平的表达需要注意以下几点:① 总RNA和cDNA的质量。只有在总RNA未被降解的情况下才能保证其中mRNA的完整性和随后反转录的cDNA质量,从而真实反映基因的表达。②总RNA的定量。在反转录之前,作为起始模板各个样品中的总RNA质量要一样,cDNA量和电泳PCR产物量也要一样,才能保证PCR扩增产物能真实反映基因表达的实际情况。③PCR循环数的确定。PCR扩增产物的量与循环数之间有一定线性关系。前期的扩增产物的量随循环数的递增而成比例增加,随着DNA聚合酶活性的下降和溶液中反应底物的消耗,扩增产物将达到一个平台。半定量分析的循环数确定在成比例的线性关系范围内,表达丰度不同的基因半定量分析的PCR循环数不同。
[1]Lebeda A.Screening of wild cucumis species against downy mildew(Pseudoperonospora cubensis)isolates from cucumbers[J].Phytoparasitica,1992,20(3):203-210.
[2]Thomas CE.Downy and powdery mildew-resistant muskmelon breeding line MR-1[J].Hort Science,1986,21:329.
[3]易图永,谢丙炎,张宝玺,等.植物抗病基因同源序列及其在抗病基因克隆与定位中的应用[J].生物技术通报,2002(2):16-20.
[4]秦跟基,李万隆,陈佩度.植物抗病基因结构特征及其类似序列的研究进展[J].南京农业大学学报,1999,22(3):102-107.
[5]丁国华,秦智伟,刘宏宇,等.黄瓜NBS类型抗病基因同源序列的克隆与分析[J].园艺学报,2005,32(4):638-642.
[6]Halterman D A,Wei F,Wise R P.Powdery midew-induced Mla mRNAs are alternatively spliced and contain multiple upstream open reading frames[J].Plant Physiology,2003,131(2):558-567.
[7]Wan P,Ling L J,Zhou W J,et al.Cloning,sequence and expression analysis of a zine finger protein gene in wheat[J].Acta Genetion Sinica,2004,31(9):895-900.
[8]王维平,曹凯鸣,王喜萍.水稻中一个与COI1同源的基因克隆及其表达分析[J].复旦学报:自然科学版,2004,43(2):206-209.

