PI3KI/Akt1在辐射诱导的乳腺癌细胞自噬发生中表达调控及作用机制
高 琳,刘晓冬,孔德娟,马淑梅*
(1.吉林大学公共卫生学院卫生部放射生物学重点实验室,吉林长春130021;2.中国科学院深圳先进技术研究院,广东深圳518031)
自噬(autophagy)是细胞通过溶酶体来降解和消化自身受损、衰老以及丧失功能的蛋白、细胞器和部分细胞质等生物大分子的过程。自噬过程是真核细胞特有的行为,为细胞的再生与修复提供原料,实现细胞的再循环和再利用[1]。有文献报道,在人类乳腺癌细胞株MCF-7中电离辐射照射可引起自噬泡的出现,提示辐射可诱导自噬[2]。电离辐射对细胞的生物学效应,主要是改变细胞内肿瘤基因或肿瘤抑制基因的表达,从而来调控照射后由相应基因表达的细胞内外信号转导通路的变化。PI3KI/Akt1是一条生长因子信号转导通路,参与细胞代谢、生长、死亡、恶变等肿瘤的发生发展。早期研究PI3KI/Akt1通路是其基于细胞凋亡的基础上研究的[3],但有关辐射诱导的乳腺癌自噬性细胞死亡过程中是否有PI3KI/Akt1参与,尚未见报道。本研究在乳腺癌细胞中建立Akt1沉默与过表达模型,检测自噬相关基因MAPLC3B的表达,以研究自噬发生中PI3KI/Akt1通路的变化及可能的作用机制,为寻求肿瘤治疗新靶点提供理论依据。
1 材料和方法
1.1 主要试剂与仪器 Trizol试剂、R T-PCR试剂盒、SYBR○RPremix Ex Taq TM(Perfect Real Time)试剂盒等购于大连宝生物公司;兔抗beclin1、鼠抗GapdH、增强化学发光法(ECL)发光试剂盒等均购自美国Santa Cruz公司;Lipofectamine TM2000脂质体购于美国Invitrogen公司;仪器:美国 Bio-Rad电泳仪,美国PE公司TC-1 PCR扩增仪,美国Stratagene Mx3000 PCR仪。
1.2 细胞培养与照射 人类乳腺癌细胞株(MCF-7)由本实验室保存。使用10%胎牛血清的RPMI 1640培养基,37°C、5%CO2培养箱中培养,0.25%胰酶消化传代。(1)mRNA检测:正常MCF-7与模型组分别生长至80%后,将其分为假照组和照射组,假照组根据照射后收获细胞时间分为4、8、16和32 h组;根据照射剂量不同分为2、4、8和12 Gy组。(2)蛋白检测:分为假照组与照射组,假照组根据提取蛋白时间分为0.5、1、2、4、8、24 h;根据照射剂量分为 2、4、8 和 12 Gy。正常细胞组照射采用国产X.S.S.205(FZ)型固定式X射线深部治疗机,滤板0.5 mmCu+1.0 mmAl。单次照射靶皮距500 mm,吸收剂量率0.287 Gy/min;模型细胞组照射条件为单次照射靶皮距600 mm,吸收剂量率0.41 Gy/min。
1.3 细胞转染
磷酸钙共沉淀法 MCF-7在1640完全培养液中常规培养。实验分组:空白对照组,不给予任何干预措施;空载体转染组 psuper retro,转染 体系如下:Ampho Pack 10 μ g、Akt si RNA10 μ g 、2 mol/l CaCl231 μ l、ddH2O 补 至 250 μ l 和 2 ×HBS 250 μ l。混合液混匀在规定时间内转染MCF-7细胞;Akt1 siRNA转染组,方法同空载体转染组。转染48 h后药物浓度为0.9 μ g/ml puromycin筛选至阳性克隆出现。
1.4 RT-PCR
1.4.1 细胞总RNA提取。
1.4.2 按照试剂盒说明书进行逆转录反应操作。
1.4.3 引物 Akt1(NM-001014432.1)序列如下。
上游引物 5′-CTGAGATTGTGTCAGCCCTGGA-3′,下游引 物5′-CACAGCCCGAAGTCTGTGATCTTA-3′;MAP1LC3B(NM-022818.4)引物:上游引物 5′-CCTAGAAGGCGCTTACAGCT-3′,下游 引 物 5′-GGGACAATTTCATCCCGAAC-3′;GAPDH(NM-002046.3)引物:上游引物 5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物 5′-TGGTGAAGACGCCAGTGGA-3′。
1.5 实时荧光定量RT-PCR
采用大连宝生物公司的SYBR○RPremix Ex Taq TM(Perfect Real Time)试剂盒。
PCR扩增程序 在美国Stratagene Mx3000 PCR仪中进行。反应条件如下,95℃预变性5 s;95℃变性5 s,60℃退火20 s,共40个循环。实验设计是按照△△Ct解析法来进行目的基因与管家基因的相对定量。
1.6 免疫印迹
Western blot蛋白煮沸5 min进行变性,SDS-PAGE电泳。上样蛋白量为60μ g,电压分别为 90和100 V;电泳后湿式转印NC膜上(100 V 60 min);5%脱脂奶粉封闭1 h,加1∶250稀释的一抗于4℃摇床过夜;TBS洗膜3次;加1∶1 000稀释二抗反应90 min,TBS洗膜3次,ECL显色并记录结果。
1.7 统计学处理 beclin 1基因与蛋白检测结果采用Image J软件进行电泳条带灰度分析;MAP1LC3B检测结果采用SPSS 17.0统计软件进行方差齐性检验,以表示,各组与假照组之间采用单因素方差分析;两两比较则用Dunnet t检验,P<0.05(或<0.01)为差异有统计学意义。
2 结果
2.1 照射后MCF-7细胞中的Akt1基因表达的变化
首先,采用实时定量PCR方法检测Akt1的剂量-效应关系,即在不同时间点检测MAP1LC3B随剂量变化的规律。从图1a可以看出,照射后4、8 h量效结果表明,Akt1表达分别在2、4、8 Gy区间内明显呈剂量依赖下降变化,12 Gy有所回升但仍低于假照组,差异显著(F=210.684,555.937,P<0.01);16 h量效表明,Akt1表达分别在2、4、8 Gy区间剂量依赖下降,12 Gy有所回升仍低于假照组(F=63.766,P<0.01);32 h量效结果表明,Akt1表达明显呈剂量依赖下降变化,4、8、12 Gy有显著性差异(F=45.461 P<0.05)。
在时间效应研究中,Akt1的变化如图1b。MCF-7细胞照射2 Gy后16h表达降至最低,无显著性差异;4、8、12Gy时程研究Akt1表达量均于8 h降至最低,差异显著(F=73.059,275.927,152.760,P<0.05)。照射后Akt1基因总体变化均低于假照组。
2.2 照射后MCF-7细胞中的Akt1蛋白表达的变化
采用Western-blot检测方法beclin1蛋白表达水平的变化,结果如图2。2 Gy时效研究表明,照射后2 h Akt1蛋白表达即有明显下降趋势(与假照组相比下降70%),24 h达至最低值(与假照组相比下降87.1%);4 Gy时效研究表明,照射后0.5 h Akt1蛋白表达明显下降(与假照组相比下降87.7%),8 h达至最低值(与假照组相比下降94%),24 h有所回落但仍低于假照组;8 Gy时效研究表明,照射后Akt1蛋白表达在0.5-4 h区间内呈时间依赖下降趋势,4 h达至最低值(与假照组相比下降67.3%),8 h-24 h有所回升,但仍低于假照组。

图1 MCF-7细胞照射后Akt的剂量-效应变化(a)与时间-效应变化(b)
2.3 MCF-7细胞中的Akt1沉默细胞模型的建立
我们利用磷酸钙沉淀法将表达载体的si R NA导入包装细胞293T,收集假病毒颗粒后直接感染靶细胞MCF-7,采用Western blot方法检测Akt基因的表达,结果如图 3所示,Akt1 siRNA组与对照组相比,模型组Akt1基因表达明显减少,表明发挥了基因沉默的效果。
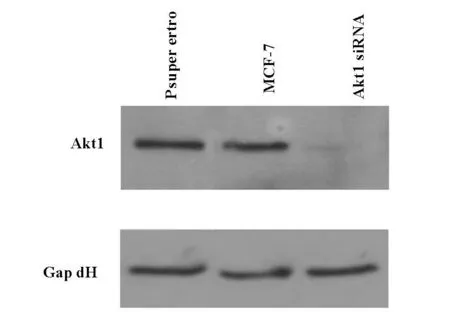
图3 MCF-7细胞AKT沉默模型建立模型蛋白表达
2.4 Akt1 siRNA细胞模型中照射对自噬发生的影响
Akt1 siRNA沉默细胞模型建立后,我们采用实时定量PCR检测其中MAP1LC3B表达量的变化。如图4a,4 h量效表明,MAP1LC3B表达上升但并无显著性变化;8 h量效表明,MAP1LC3B表达呈剂量依赖上升变化,8、12 Gy有统计学差异(F=18.181,P<0.05),于12Gy达至最大值;16 h与32 h量效表明,MAP1LC3B在2-4Gy区间内呈剂量依赖上升变化,8 Gy有所回落,12 Gy上升至最大值,均有显著性差异(F=35.057,P<0.01;F=21.056,P<0.05)。
其次,我们检测了其时间效应关系,结果如图4b。2 Gy与4Gy时效表明,4、8 h并无显著性差异,但MAP1LC3B表达均于16 h与32 h时间点开始上升,差异显著(F=19.447,28.405,P<0.01);8 Gy时效表明,MAP1LC3B表达呈剂量依赖上升变化16 h与32h差异显著(F=7.169,P<0.05);12Gy时效表明,8、16、32 h MAP1LC3B表达呈剂量依赖上升变化,有显著性差异,于32 h达至最大值(F=35.580,P<0.05)。
3 讨论
放射治疗是治疗乳腺癌的主要组成部分,是局部治疗手段之一。但目前常用的放疗设施较难达到完全杀灭肿瘤的目的,因此,放射治疗与特异性靶点基因治疗联合作用来杀死肿瘤就成为一个研究方向。
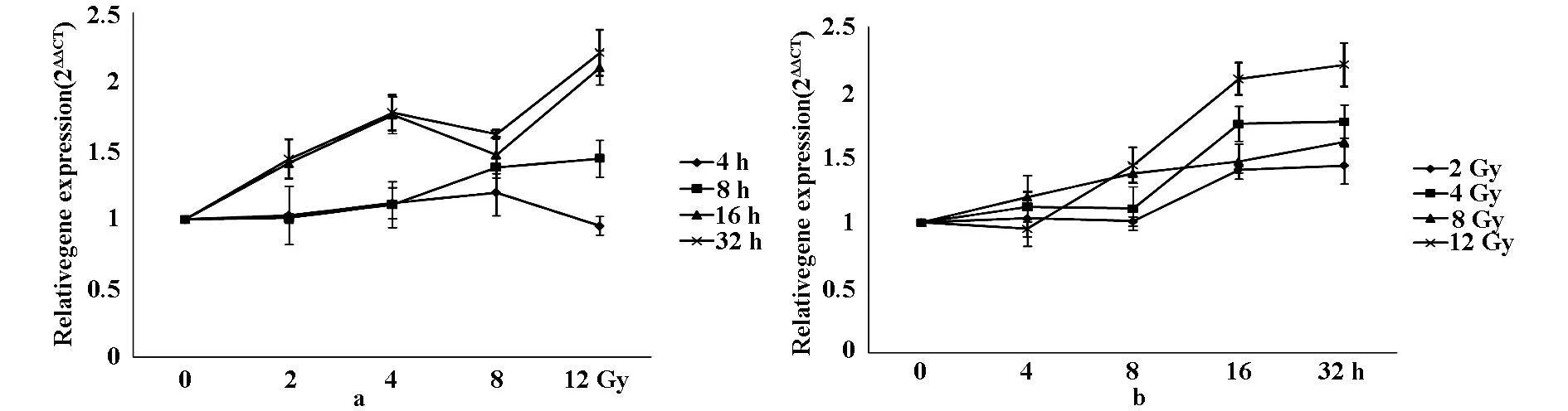
图4 照射后Akt1 siRNA沉默细胞模型中MAP1LC3B的剂量-效应变化(a)与时间-效应变化(b)
自噬是细胞通过溶酶体包裹自身衰老或死亡的蛋白或细胞器而进行的自我存活的机制,但持续的自体吞噬会导致程序性细胞死亡[4]。LC3蛋白是自噬标记物,位于自噬体和自噬溶酶体膜上,通过检测细胞内MAP1LC3B的表达量的变化,可以判断自噬是被诱导还是被抑制。
磷脂酰肌醇3-激酶I(phosphatidylinositol 3-kinase I,PI3KI)是调节细胞增殖和细胞周期的早期信号分子,具有胰岛素的功能,在各类癌症的发生、发展、侵袭及转移过程中具有重要的作用。PI3KI由具有调节功能的亚单位p85和具有催化功能的亚单位p110异二聚体组成[5,6,7],这种结构由蛋白酪氨酸激酶活性受体和G蛋白偶联受体所激活。活化PI3K下游信号分子Akt、mTOR关系密切,Akt是一个 PI3KI下游重要的靶激酶,具有丝-苏氨酸激酶活性Akt的活化可以调节细胞内蛋白的各项功能,包括促进细胞转录与增殖、加强细胞的能动性/粘附性、细胞周期进程加速、加速肿瘤血管生成使细胞发生恶性转化。
研究表明,无血清饥饿方法可以诱发细胞自噬,同时也可以引起细胞周期阻滞;抑制PI3KI/Akt通路可抑制细胞周期运行,并且细胞周期受抑时往往可以观察到自噬的发生[8]。电离辐射作用后Bax/Bak(-/-)MEF细胞的PI3K/Akt/mTOR信号减弱,ATG5、ATG12、beclin1等自噬相关基因表达增强,经mTOR抑制剂Rad001治疗后,自噬进一步增强,MEF细胞则发生自噬性死亡[9]。X线照射可以促使MCF-7细胞发生自噬[10],本研究中发现正常组MCF-7照射后Akt1基因与蛋白总体表达均低于假照组,这说明电离辐射在一定时间内能够有效的抑制Akt1的表达,阻断PI3KI/Akt1通路。
为了进一步研究MCF-7是否由于辐射抑制了PI3KI/Akt1通路而发生自噬,探讨PI3KI/Akt1与自噬之间的作用机制,我们在MCF-7细胞株中建立了Akt沉默的细胞模型。首先,Akt1 siRNA模型照射组量效研究表明,MAP1LC3B表达在8、16、32 h均有不同程度升高变化,12 Gy达至最大值。2、4、8 Gy时间效应表明,MAP1LC3B表达在16 h、32 h上升变化显著;12 Gy时效表明,8、16、32 h MAP1LC3B表达呈剂量依赖上升变化,这个结果说明运用RNA干扰的手段可以有效的抑制Akt1的表达,电离辐射诱导的基础上MAP1LC3B表达均有不同程度的升高,表明电离辐射作用联合Akt1基因沉默后自噬发生更加显著。
目前,PI3KI/Akt1信号转导通路在肿瘤的发生、发展、治疗中成为热点研究目标,有关它的报道多数仍以诱导肿瘤细胞凋亡为主。电离辐射诱导的肿瘤细胞自噬性死亡中PI3KI/Akt1是如何转导调控的尚未见报道。因此,本研究通过建立基因沉默及过表达模型,进一步探讨该通路与自噬之间的作用机制,针对该信号转导通路寻找新的抗肿瘤药物对于肿瘤的治疗将具有十分重要的意义。
[1]Degenhardt K,Mathew R,Beaudoin B,et al.Autophagy promotes tumor cell survival and restricts necrosis,inflammation,and tumorigenesis[J].CancerCell,2006,10(1):51.
[2]Paglin S,Lee NY,Nakar C.Rapamycin-sensitive pathway regulatesmitochondrial membranepotential,autophagy,and survival in irradiated MCF-7 cells[J].Cancer Res,2005,65:(23)11061.
[3]Ren Y,Huang F,Liu Y,et al.Autophagy inhibition through PI3K/Akt increases apoptosis by sodium selenite in NB4 cells[J].BMB reports,2009,42(9):599.
[4]Tsujimoto Y,Shimizu S.Another way to die:autophagic programmed cell death[J].Cell Death Differ,2005,12(2):1528.
[5]Oak JS,Chen J,Peralta RQ,et al.The p85beta regulatory subunit of phosphoinositide 3-kinase has unique and redundant functions in B cells[J].Autoimmunity,2009,42(5):447.
[6]Finlay D,Cantrell D.Phosphoinositide 3-kinase and the mammalian target of rapamycin pathways control T cell migration[J].Ann N Y Acad Sci,2010,1183:149.
[7]Menakongka A,Suthiphongchai T.Involvement of PI3K and ERK1/2 pathways in hepatocyte growth factor-induced cholangiocarcinoma cell invasion[J].World J Gastroenterol,2010,16(6):713.
[8]GE Jun-Na,HUANG Dan,XIAO Tian,et al.Efect of Starvation-induced Autophagy on Cell Cycle of Tumor Cells[J].Chinese Journal of Cancer,2008,27(8):788.
[9]Kwang WK,Mutter RW,Cao C,et al.Autophagy for cancer therapy through inhibition of pro-apop totic proteins and mammalian target of rapamycin signaling[J].J Biol Chem,2006,281(48):36883.
[10]高 琳,刘晓冬,马淑梅.beclin 1在辐射诱导的乳腺癌细胞自噬发生中表达的变化.中华放射医学与防护杂志,2010,30(2):17.

