碱性介质中甲醇氧化红外光谱电化学循环伏吸研究
傅东祺 金葆康
(安徽大学化学化工学院,合肥 230039)
碱性介质中甲醇氧化红外光谱电化学循环伏吸研究
傅东祺 金葆康*
(安徽大学化学化工学院,合肥 230039)
本文利用红外光谱电化学循环伏吸法,对碱性体系下甲醇在Pt电极上的氧化过程的中间产物进行分析和研究。结果表明,碱性体系中,CH3OH在Pt电极上具有较好的电化学活性,存在和在酸性体系中不同的反应机理。利用现场红外差谱对氧化过程的产物进行分析,对生成的产物进行指认,并未发现毒化中间产物COL的生成。运用红外光谱电化学循环伏吸及导数伏吸法,对生成的中间体的生成过程进行分析和指认,结果表明:CH3OH的氧化中间产物为HCOO-,在碱性体系下,会继续转化为CO2,
现场红外光谱;红外循环伏吸法;碱性介质;甲醇
0 引 言
近年来,直接甲醇燃料电池(DMFC)以其较高的能量密度和价格便宜,体积小,清洁环保等优点,已经引起了人们的普遍关注[1-7]。目前,随着对DMFC的催化材料和质子交换膜等方面的探索逐渐深入[8-11],研究甲醇在不同的催化体系及不同的酸碱介质中的反应机理的研究就显得极为重要。
孙世刚等[12]利用快速扫描时间分辨红外光谱技术,研究了碱性溶液中甲醇在纳米修饰的Pt电极上氧化的动力学过程,观察到了毒性中间产物CO的生成,同时也观察到了活性中间产物HCOO-的生成,并且指出桥式吸附的COB和HCOO-是优先于线性吸附的COL生成。林仲华[13]利用FTIR及循环伏安等技术对碱性介质中甲醇在Pt电极上的表面吸附和氧化行为进行研究,证明碱性介质中甲醇电氧化的最终产物是CO2和CO32-,中间体是HCOO-,并推测了CH3OH氧化的机理。Tripkovic等[14]研究了CH3OH在pH和温度不同的溶液中的电化学过程,证明了在碱性体系下,甲醇具有比酸性体系下更高的活性,且在333 K时Pt电极的催化活性比在295 K时的活性要高。
1981年,Bancroft提出了紫外光谱电化学CVA(循环伏吸法)[15-16],该方法在液/液界面膜、导电聚合物膜和分子生物膜等领域研究等到广泛应用。与CV(循环伏安)曲线相比,DCVA(导数循环伏吸法)曲线没有电容背景信号,因此,DCVA方法具有能分别监测反应中特定步骤的优势。本课题组[17-18]已成功将DCVA技术用于红外光谱电化学,对可逆体系及不可逆体系开展了电极过程反应动力学及电子转移机理的研究。与紫外光谱相比,红外光谱具有更丰富的吸收峰,为跟踪电化学反应过程的中间体、产物的生成提供较为丰富的信息。本文利用红外光谱电化学循环伏吸法对CH3OH在NaOH溶液中氧化中间产物进行跟踪和测定,开展甲醇碱性体系下的反应机理研究。
1 实验部分
1.1 仪器与试剂
CHI630C电化学工作站,EG&G PARModel283恒电位/恒电流仪,铂盘电极(φ=4 mm)为工作电极,Ag/AgCl为参比电极,铂丝为对电极,Nicolet Nexus 870 红外光谱仪。 色谱纯无水甲醇(ω=99.9%),NaOH(ω=95%),二次蒸馏水,D2O(ω=99.9%)。
1.2 实验技术
电化学实验采用CHI 630C电化学工作站循环伏安测试技术,三电极系统,实验前分别用砂纸(2000、3000 及 4000 目)和 Al2O3(0.5 和 0.1 μm)将铂盘电极抛光成镜面,超声清洗干净后,浸入浓度为0.1 mol·L-1H2SO4中,以 50 mV·s-1扫描,在-0.24~1.0 V的进行循环伏安实验[19],扫描至稳定谱图,二次水清洗干燥后备用。
现场红外光谱实验是在Nicolet Nexus 870红外光谱仪上进行,配以iTR反射附件,(MCT/A)液氮检测器。电解池为本实验室自制的外反射红外光谱电化学池,以CaF2为红外光窗。电解池剖面图装置如下所示:

实验中,将薄层池置于iTR反射附件上,由红外光谱仪发出的光通过反射附件,反射到CaF2光窗上,产生吸收信号。现场红外差谱结果表示为:

R(ER)和R(ES)分别是在参比电位ER和研究电位ES下采集的光谱,分辨率为16 cm-1。
快速扫描时间分辨红外光谱由 Omnic E.S.P.5.2 Series程序采集,三维图用Grams/3D software软件处理。
2 结果与讨论
2.1 甲醇在NaOH溶液中的循环伏安研究
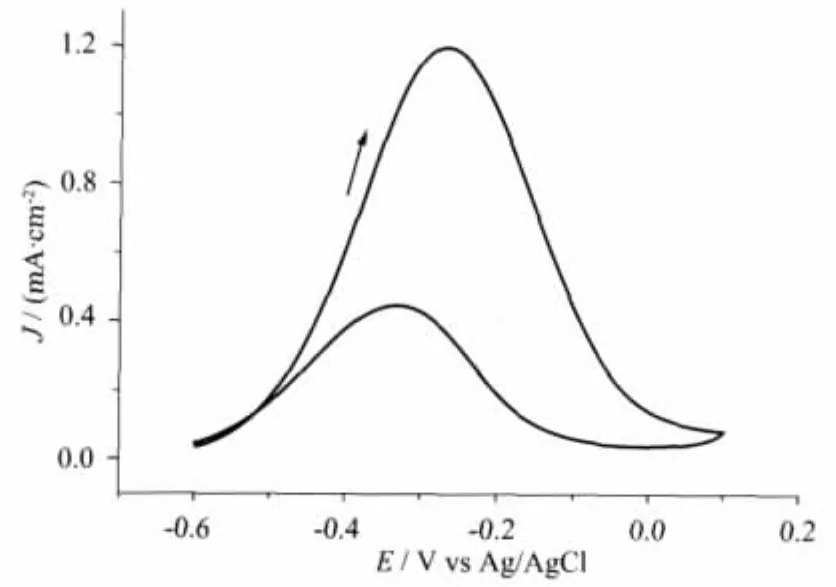
图1 0.5 mol·L-1CH3OH+0.5mol·L-1NaOH 水体系中的循环伏安实验Fig.1 Cyclic voltammogram in aqueous solution containing 0.5 mol·L-1CH3OH and 0.5 mol·L-1NaOH.Ag/AgCl as reference electrode
图1是甲醇在NaOH水溶液中的电化学循环伏安图,初始电位为-0.6 V,随着正向扫描的进行,电流逐渐增大,在-0.27 V达到最大值,生成第1个氧化峰,后峰电流减小到最小,在负向扫描的过程中,电流在-0.10 V左右开始逐渐增加明显,在-0.36 V时达到最大,生成第2个氧化峰,然后电流又逐渐减小,第2个氧化峰比第1个氧化峰的峰电流要小很多,这是由于电极表面的氧化物种的消耗造成的[20-21]。碱性体系下甲醇的正向扫描过程只出现1个氧化峰,这与酸性体系下不同,对于甲醇在酸性体系下的电氧化机理是经历了CH3OH的逐步脱质子,生成毒化中间产物CO[22],最后CO被溶液中含氧物种氧化成CO2。
反应机理为:CH3OH+3Pt→PtCO+4H++2Pt+4e-→CO2+H2O
目前对于甲醇在碱性NaOH溶液中的反应机理,有多种解释。有指出其反应是以甲醇的解离吸附开始[23],甲醇在Pt电极表面会有几种不同的吸附形式,产生不同的吸附中间产物,Pt和CH3OH中的H形成较强的化学键,从而促成了C-H键或O-H的断裂[24]。也有学者指出,CH3OH首先被氧化成HCOO-,HCOO-继续和溶液中的OH-反应生成CO2,在NaOH浓度较高情况下,CO2会继续被氧化成或,即并不通过CO中间体的生成过程。CH3OH在以重水为溶剂时,我们同样观察到了和图1类似的结果,由于同时采集的红外光谱具有更好的信噪比,后面将采用重水作为溶剂,研究甲醇的现场红外结果,用来推断甲醇在碱性体系下的反应机理。
2.2 甲醇在NaOH溶液中的现场红外差谱
图2是甲醇以重水为溶剂的NaOH溶液中的现场红外反射差谱图,以-0.8 V为参比电势,电势间隔为0.1 V。从图中可以清晰的看出,当电势阶跃到-0.4 V时,1593和1358 cm-1处即出现向下的生成峰,而且随着电势向较正的电位阶跃,峰的强度逐渐增加,对应甲酸盐的生成,同时,1385 cm-1也出现较弱的峰,但电势阶跃到-0.2 V时,此处的峰便消失,1405 cm-1处的向上峰逐渐增大,应为CH3OH中C-H的伸缩振动,而2343 cm-1对应的CO2生成峰则逐渐增加,电势阶跃到-0.1 V附近时,1319 cm-1处和1 634 cm-1处的峰也逐渐增强,对应溶液中HCO3-的生成。表1列出了各峰的归属与电位的关系。

图2 0.5 mol·L-1CH3OH+0.5 mol·L-1NaOH 在重水中的现场红外差谱图Fig.2 FTIR spectroelectrochemistry difference spectra of 0.5 mol·L-1CH3OH+0.5 mol·L-1NaOH in heavy water

表1 0.5 mol·L-1CH3OH+0.5 mol·L-1NaOH的重水溶液现场红外实验过程中,各特征峰的归属Table 1 Assignment of IR absorption peaks of 0.5 mol·L-1CH3OH in 0.5 mol·L-1NaOH(solvent:D2O)
从现场红外差谱图中可以发现,在甲醇的电化学氧化过程中, 溶液中存在 HCOO-、CO2、及等产物,而且可以得出了各物质的生成次序,即为了进一步研究甲醇的电化学氧化机理,本文开展了甲醇的CVA及DCVA的研究。
2.3 CH3OH在NaOH溶液中的循环伏吸及导数循环伏吸研究
图3是电化学循环伏安过程的同时,记录的现场红外光谱3D图。从图中可以看出在电化学的氧化过程中,出现了1593和1358 cm-1处HCOO-的生成[12],而且图中可以很清晰的观察到CO2的生成。上方图是将1 593 cm-1处的峰放大后的结果,可见1634 cm-1处的峰的生成,此外在低波数区观察到更多的红外特征峰,这与通过红外反射差谱得到的结果一致。从上图中,并未发现毒化中间产物CO的生成。

图3 0.5 mol·L-1CH3OH+0.5 mol·L-1NaOH 的重水溶液的现场红外结果Fig.3 In-situ rapid sacn FTIR 3D spectra of 0.5 mol·L-1CH3OH in 0.5 mol·L-1NaOH D2O solution
图4是不同波数下吸光度与时间(电位)的关系(数据来源于图3)。其中1593和1358 cm-1处的吸光度随时间先逐渐增大,而且在140 s附近时,二者同时达到最大值,也就是说此时HCOO-的生成达最大值,而溶液中2343 cm-1处CO2在0~140 s附近时吸光度几乎没有变化。在140 s附近时,CO2开始生成,而此时HCOO-的生成达到最大值。此后,HCOO-因消耗而减少,但是CO2的吸光度却逐渐增加,220 s附近时,HCOO-吸光度达最小值,而CO2则到达最大值。反向扫描时,HCOO-的生成和消失的变化趋势和正向扫描时完全一样,只是氧化峰电流较正向扫描时小,吸光度也较小。也就是说HCOO-的减少对应CO2的生成,即CO2是由HCOO-转化而来的。

图4 0.5 mol·L-1CH3OH+0.5 mol·L-1NaOH 的重水溶液的循环伏吸图Fig.4 CVAs of 0.5 mol·L-1CH3OH in 0.5 mol·L-1NaOH D2O solution
此外,1634 cm-1处的红外吸收峰也随时间逐渐增大,而且在HCOO-未达到最大值的时候,已经有HCO3-生成,其在160 s左右滞后HCOO-达到最大值。吸光度增加的原因可能是由于HCOO-的转化;1385 cm-1处的吸光度起始也随时间增加,该峰对应的生成过程[27]。但是在110 s之后,却呈现减小的趋势,可能的原因是溶液中CH3OH氧化,导致δCH3(1405 cm-1)的消失,两峰部分重叠造成。有文献[28]指出 1385 cm-1对应于 HCOO-中 δC-H,但是从CVA图中可知,如果1385 cm-1的峰对应HCOO-,就应与1594和1356 cm-1处的峰同时得到最大值,由此可以证明此处1385 cm-1对应。
图5是甲醇在NaOH溶液中CV正向扫描时得到的DCVA图。从图中可以清晰的看到各物种达到最大生成速度的先后顺序,即1593和1358 cm-1处的 HCOO-先达到最大,然后是,最后是CO2。我们发现,在HCOO-的生成还没有达到最大生成速度的时候,已经开始有的生成,这表明溶液很可能是由扩散引起的,甲醇氧化生成HCOO-,HCOO-进一步氧化为两步电子转移过程氧化电位很接近,从而在CV图上无法得到分辨的两个氧化峰,这与CV结果是一致的。CO2最后才达到最大值的原因是因为溶液中的OH-浓度较大,使得CO2迅速转化为了,这一步反应可能是吸附造成的结果。比较CH3OH在不同NaOH溶液中的CVA,结果表明CO2的生成与NaOH浓度有关,NaOH浓度越大,CO2的CVA峰越不明显,证明了HCOO-为甲醇氧化过程的中间产物,由此,我们证明了甲醇可能的氧化机理是经过氧化中间体 HCOO-,CO2,最终转化为的过程[13],即:

图5 0.5 mol·L-1CH3OH+0.5 mol·L-1NaOH 的重水溶液中氧化过程的DCVA图Fig.5 DCVAs of of 0.5 mol·L-1CH3OH in 0.5 mol·L-1NaOH D2O solution
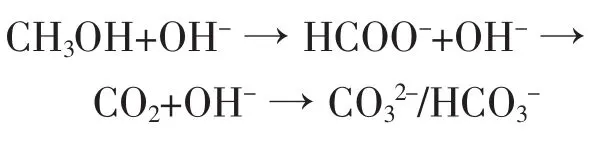
3 结 论
本文通过电化学和红外光谱电化学循环伏吸法,对甲醇在碱性体系下的电化学氧化行为进行研究。结果表明,CVA可以用来跟踪多个物种的吸光度随时间的变化规律,并以此来推测中间体和可能的产物,此外DCVA技术也可以用来跟踪每种物质到达最大生成速度的时间,以此来推测每种物质的生成顺序和可能的反应机理,结果证明了碱性体系下,甲醇的电化学氧化是经历了HCOO-中间体,最终产物为 CO2,CO32-和 HCO3-。
[1]Parsons R,VanderNoot T.J.Electroanal.Chem.,1988,257(1):39-45
[2]LI Xiao-Qin(李筱琴),REN Bin(任 斌),TIAN Zhong-Qun(田中群).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1998,19(1):120-122
[3]GU Ren-Ao(顾仁敖),CAO Wen-Dong(曹文东),CAO Pei-Gen(曹佩根),et al.J.Light Scattering(Guang Sanshe Xuebao),2001,13(1):8-11
[4]Chen Y X,Miki A,Ye S,et al.J.Am.Chem.Soc.,2003,125(13):3680-3681
[5]Wei Z D,Li L L,Luo Y H,et al.J.Phys.Chem.B,2006,110(51):26055-26061
[6]RAO Gui-Shi(饶贵仕),WANG Guo-Fu(王国富),TIAN Zhong-Qun(田中群),et al.J.Light Scattering(Guang Sanshe Xuebao),2008,20(2):126-130
[7]WANG Qi(王 琪),SUN Gong-Quan(孙公权),YAN Shi-You(闫世友),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2006,27(11):2123-2127
[8]HU Xi-Duo(胡西多),ZENG Zhi-Feng(曾志峰),XU Chang-Wei(徐常威),et al.J.Dongguan Univ.Technol.(DongguanLigong Xueyuan Xuebao),2007,14(1):30-35
[9]WANG Jin(王 瑾),DONG Guo-Jun(董国君),MAO Zong-Qiang(毛宗强),et al.Battery Bimonthly(Dianchi),2007,37(4):315-317
[10]LIN Cai-Shun(林才顺),RONG Jie-Peng(荣洁鹏),WANG Tong-Tao(王同涛),et al.Nonferrous Metals(Youse Jinshu),2008.(4)41-43
[11]ZHANG Yu(张 瑜).Appl.Chem.Ind.(Yingyong Huagong),2009,38(5):737-739
[12]Zhou Z Y,Tian N,Chen Y J,et al.J.Electroanal.Chem.,2004,573,111-119
[13]LIN Heng(林 珩),CHEN Guo-Liang(陈国良),LIN Zhong-Hua(林仲华),et al.Acta Chimca Sinica(Huaxue Xuebao),2005,63(23):2137-2140
[14]Tripkovic A V,Popovic K D,Grgur B N,et al.Electrochim.Acta,2002,47,3707-3714
[15]Bancroft E E,Sidwell J S,Blount H N.J.Anal.Chem.,1981,53:1390-1398
[16]He J B,Lin X Q.Bioelectrochemistry,2007,71,157-163
[17]Jin B K,Li L,Huang J L,et al.Anal.Chem.,2009,81:4476-4481
[18]JIN Bao-Kang(金葆康),YAN Yu-Li(闫玉丽).Chin.J.Anal.Chem.(Fenxi Huaxue),2009,37(9):1363-1366
[19]LI Chang-Shun(李长顺).Guangzhou Chem.(Guangzhou Huaxue),2006,34(3):48-49
[20]CHEN Guo-Liang(陈国良),CHEN Sheng-Pei(陈声培),SUN Shi-Gang(孙世刚),et al.Electrochemistry(Dian Huaxue),2001,7(4):452-458
[21]Assiongbon K A,Roy D.Surf.Sci.,594(2005),99-119
[22]ZHOU Wei-Jiang(周卫江),ZHOU Zhen-Hua(周振华),SUN Gong-Quan(孙公权),et al.Chem.Bull.(Huaxue Tongbao)2003,66(4):228-234
[23]LIU Shi-Bin(刘世斌),LIU Yong(刘 勇),SUN Yan-Ping(孙彦平),et al.Chin.J.Catal.(Cuihua Xuebao),2006,627(9):787-792
[24]LI Lan-Lan(李兰兰),WEI Zi-Dong(魏子栋),SUN Cai-Xin(孙才新),et al.Acta Chimica Sinica(Huaxue Xuebao),2006,64(11):1173-1178
[25]Love J G,Brooksby P,McQuillan A J.J.Electroanal.Chem.,1999,464:93-100
[26]ZHOU Wei(周 尉),YAN Man-Ming(严曼明),SHENG Hai-Tao(盛海涛),et al.Acta Chimica Sinica(Huaxue Xuebao),2000,58(11):1447-1451
[27]Arihara K,Kitamura F,Ohsaka T,et al.J.Electroanal.Chem.,2001,510:128-135
[28]Ortiz O P,Marquez J,Ma′rquez,et al.J.Phys.Chem.,1996,100:8389-8396
FTIR Spectroelectrochemistry Cyclic Voltabsorptometry Studies of Oxidation of Methanol in Alkaline Media
FU Dong-QiJIN Bao-Kang*
(Department of Chemistry,Anhui University,Hefei 230039)
In this paper,infrared spectroelectrochemistry cyclic voltabsorptometry (CVA)technique was used to investigate the intermediate of methanol oxidation on Pt electrode in basic system.The result indicates that CH3OH shows a great electrochemical activity on Pt electrode in an alkaline media,which exists a different reaction mechanism in the acid media.By using the infrared difference spectra,we do not find the poisonous intermediate formation of COL.What is more,the use of IR CVA and DCVA (Derivative Cyclic Voltabsorptometry)can help us assign the possible intermediate products.We also believe that the intermediate formation of the methanol oxidation is HCOO-,and subsequent further oxidation of HCOO-to the final products:CO2,CO32-and HCO3-.
in-situ FTIR;IR spectroelectrochemistry cyclic voltabsorptometry;alkaline media;methanol
O646.54;O613.3
:A
:1001-4861(2010)11-2001-05
2010-05-24。收修改稿日期:2010-08-16。
国家自然科学基金(No.20775001,20875001),教育部新世纪优秀青年资助计划(No.NECT-07-0002),安徽大学“211计划”资助项目。
*通讯联系人。 E-mail:bkjinhf@yahoo.com.cn
傅东祺,女,24岁,硕士研究生;研究方向:光谱电化学。

