黑曲霉 bgl基因在毕赤酵母中的表达研究
陈士华,耿瑞凡,薛 珍,吴兴泉
(河南工业大学生物工程学院,河南郑州 450001)
黑曲霉 bgl基因在毕赤酵母中的表达研究
陈士华,耿瑞凡,薛 珍,吴兴泉
(河南工业大学生物工程学院,河南郑州 450001)
为构建具有分泌黑曲霉β-葡萄糖苷酶活力的酵母工程菌,探讨β-葡萄糖苷酶基因 (bgl基因)在酵母菌中的表达情况.克隆了黑曲霉 bgl基因的 cDNA片段,利用质粒 pPICZαA构建了该基因的酵母表达载体,经线性化后采用电穿孔法转入毕赤酵母菌中.以甲醇为诱导物进行诱导培养,检测结果表明黑曲霉 bgl基因已成功转入酵母菌中并可正常表达,重组蛋白具有β-葡萄糖苷酶水解活性,在诱导培养 72 h后,发酵液的酶活力可达到 0.78 U/mL.
黑曲霉;毕赤酵母;β-葡萄糖苷酶基因;表达
0 前言
β-葡萄糖苷酶 (β-1,4-glucosidase,BGL)是纤维素酶水解纤维素过程中最后一步关键酶,对纤维素糖化水解具有关键性作用,也可催化葡萄糖苷的水解过程,该酶广泛存在于植物、动物和微生物中.在食品工业中,β-葡萄糖苷酶可作为风味酶用于提高果汁的天然风味.茶叶、水果、蔬菜中的芳香成分不仅以游离态形式存在,而且有相当一部分是以风味前体物——β-糖苷 (单萜烯基-β-D-葡萄糖苷)的形式存在,β-葡萄糖苷酶与其他风味酶协同作用释放出挥发性糖苷配基,起到增香作用,从而提高果汁品天然风味[1-3].β-葡萄糖苷酶也可应用于生产低聚龙胆糖,低聚龙胆糖比麦芽糖浆具有更高的吸水性和较低的黏度,可预防食品中的淀粉老化和保持食品中的水分;它不易为人体消化酶所消化,对双歧杆菌具有较强的增殖作用,特别适合于在咖啡制品和巧克力制品中应用,具有增味或味觉改良作用.另外,β-葡萄糖苷酶在农业、医药、饲料等领域均有广泛的应用[4].
在产β-葡萄糖苷酶的微生物中,曲霉被普遍认为是产酶性能优良的菌种,尤以黑曲霉的催化效率最高[5-6],但微生物所产纤维素酶中,天然β-葡萄糖苷酶所占比例很低 (不足 1%),总体产量不高,很难满足工业生产的需求.因此,许多研究者正致力β-葡萄糖苷酶的研究,尤其是对酶基因的克隆与分子改造等,然而,目前关于黑曲霉β-葡萄糖苷酶基因克隆与表达方面的研究报道较少[7].
1 材料与方法
1.1 材料
大肠杆菌 DH5α和黑曲霉为河南工业大学微生物实验室保存;酵母表达载体 pPICZαA由吉林农业大学的吴庆海博士惠赠,毕赤酵母 GS115由河南工业大学潘涛硕士惠赠.其他分子操作试剂均购自 MB I公司、TaKaRa、Invitrogen公司、天为时代等生物公司.
1.2 方法
1.2.1 黑曲霉 bgl基因 cDNA的克隆
依据 GenBank中已公布的黑曲霉 bgl基因序列设计引物,上游引物 L1:5’-atgaattc atgaggttcactttgatcgaggcgg-3’(下划线处为 EcoRⅠ酶切位点),下游引物 L2:5’-atgcggccgc ttagtgaacagtaggcagagacg-3’(下划线处为 N otⅠ酶切位点).
将黑曲霉划线接种于产酶诱导培养基 (以小麦秸秆粉为碳源)上,28℃静置培养 2 d,此时菌丝长满平板,孢子尚未长出.采用植物总 RNA提取试剂盒提取黑曲霉总 RNA,利用上述引物进行RT-PCR扩增 bgl基因 cDNA,将 PCR产物与pMD18-T连接,转入 E.coli.DH5α感受态细胞中,并进行序列测定与分析.
1.2.2 重组表达载体 pPICZαA-bgl的构建
采用 EcoRⅠ、NotⅠ双酶切含有 bgl基因的pMD18-T-bgl质粒,回收纯化 bgl基因 cDNA后备用.提取保存在 E.coli.中的质粒 pPI CZαA,经EcoRⅠ、N otⅠ双酶切后进行纯化回收.将上述双酶切后纯化的 pPI CZαA与 bgl基因 cDNA采用 T4 DNA连接酶进行连接,构建重组表达载体pPICZαA-bgl,将该载体转入 E.coli.DH5α感受态细胞.在选择性培养基中筛选转化子,提取质粒后进行双酶切鉴定.
1.2.3 bgl基因在毕赤酵母中的表达
综合分析载体 pPICZαA-bgl中的酶切位点,选择 B stX I对载体进行酶切线性化.制备毕赤酵母 GSIl5菌株感受态细胞,采用电穿孔转化法将线性化的重组载体转入毕赤酵母菌中,具体方法参照文献[8]进行.将转化后的毕赤酵母菌涂布于含 100μg/mL zeocin的 YPDS平板培养基上筛选.培养筛选获得的菌落,提取其基因组 DNA,以此为模板进行 PCR鉴定.
对通过 PCR鉴定的重组酵母菌,在含 100 μg/mL Zeocin的 YPD平板培养基上筛选获得pPICZαA-bgl多拷贝菌株.培养该菌株,同时采用甲醇诱导 bgl基因表达,室温下离心取上清液,与等体积的 2×SDS上样缓冲液混合,100℃水浴煮沸 3~5 min使蛋白变性,10 000 r/min离心 3 min,取 20μL上清液上样进行 SDS-PAGE检测.
1.2.4 转化 bgl基因酵母产β-葡萄糖苷酶活力检测
采用以 pNPG为底物的比色测定法[9]测定β-葡萄糖苷酶酶活力:用微量进样器取 0.1 mL稀释 10倍的粗酶液,加入 0.9 mL pH 4.5的 0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液,于50℃恒温水浴中预热 10 min.加入已预热 10 min的 5 mmol/L的 pNPG溶液 1 mL,用秒表精确计时,10 min后立即加入 1 mL 1 mol/L的 Na2CO3溶液终止反应,室温放置 5 min,于 400 nm处测光吸收值.以加热失活的酶液 (沸水中加热 10 min)按照同样的方法处理作空白.在上述条件下,每毫升酶液每分钟水解产生 1μmol对硝基苯酚的酶活力,定义为一个酶活单位 U.

式中:U为酶活单位 (U/mL);T为反应时间 (10 min);N为原酶液稀释倍数 (10倍);V为反应中所取酶液的体积;C为对应于对硝基苯酚-光密度曲线上的值(C=0.485·OD);OD为反应样品的吸光值.
1.2.5 影响重组蛋白活性的因素分析
采用 http://gcua.schoedl.de/index.ht ml网站中的“each codon vs.usage table”分析黑曲霉bgl基因码子偏好性与酵母菌密码子偏好性间的差异.利用 PROSITE(http://www.expasy.org/prosite)分析BGL中磷酸化位点的分布情况.
2 结果与分析
2.1 黑曲霉 bgl基因 cDNA的克隆
以小麦秸秆粉为诱导物培养黑曲霉,以其总RNA为模板,利用引物 L1、L2进行 RT-PCR,扩增得到 2 600 bp左右的 DNA片段 (图 1),与pMD18-T载体连接后转入 E.coli.并进行序列测定.测序结果显示该 DNA片段长 2 583 bp,与已公布的其他黑曲霉菌株 bglmRNA的序列同源性也高达 99%,证明确为黑曲霉 bgl基因 cDNA(Genbank序列号:DQ655704).
2.2 重组表达载体 pPI CZαA-bgl的构建
将 pMD18-T-bgl质粒经 EcoRⅠ和 N otⅠ双酶切后,回收纯化 bgl基因,与采用同样方法双酶切并回收纯化的表达载体 pPICZαA(长 3 600 bp)连接,构建 pPI CZαA-bgl基因表达载体.将该载体转入 E.coli.DH5α,提取质粒进行双酶切鉴定,结果证明 pPICZαA-bgl基因表达载体构建成功 (图2),并已保存在 E.coli.中.
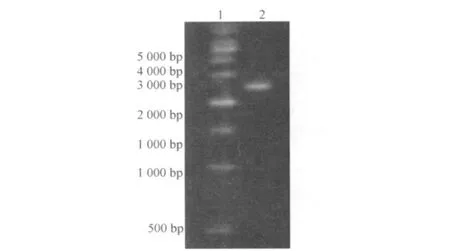
图1 黑曲霉 bgl基因 cDNA的 PCR扩增
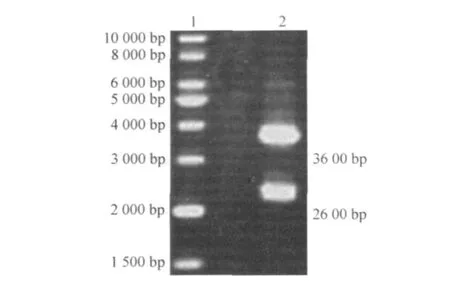
图2 重组质粒 pPICZαA-bgl的双酶切鉴定
2.3 bgl基因在毕赤酵母中的表达
经线性化后的 pPICZαA-bgl载体采用电转化法转入毕赤酵母 GSIl5菌株中,提取经选择性培养基筛选后的重组酵母基因组DNA,采用引物 5’AOX1(序 列 :5′-GACTGGTTCCAATTGACAAGC-3′)和 3’AOX1(序列 :5′-GCAAATGGCATTCTGACATCC-3′)进行 PCR检测.该方法中的 PCR产物可在 bgl基因 (2 600 bp)上增加 588 bp的 DNA片段,长度应在 3 188 bp左右.对重组酵母菌基因DNA的 PCR检测结果证明在 3 200 bp左右确实出现了一条电泳条带 (图 3),与理论预期的相符合,说明目的基因已同源重组到酵母染色体上.
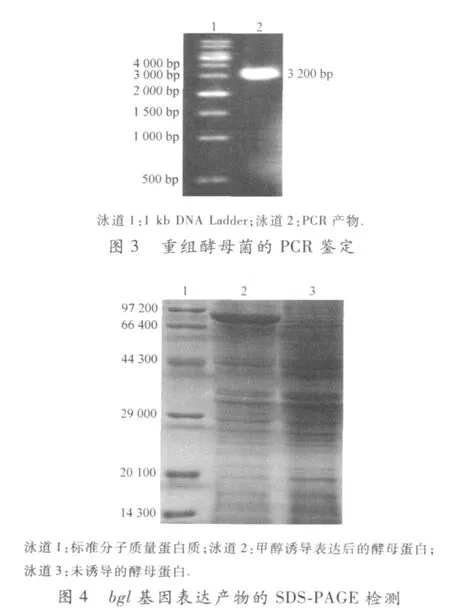
用甲醇诱导 pPI CZαA-bgl转化的重组酵母菌株,同时采用未诱导表达宿主菌作空白对照,离心取上清后,进行 SDS-PAGE电泳检测,结果见图4.图 4证明:经诱导后,重组菌发酵液中明显出现了一个诱导蛋白,该蛋白的相对分子质量为87 000左右,与预期的重组蛋白的分子质量大小相符,表明重组的BGL蛋白表达成功.
2.4 重组的 BGL蛋白的活性测定
将酵母工程菌经甲醇诱导表达后,离心取上清,测定 BGL酶活力.结果表明重组的 BGL具有β-葡萄糖苷酶活性,重组菌经诱导培养 72 h后,上清液的酶活力可达到 0.78 U/mL.
2.5 影响重组蛋白活性的因素分析
密码子偏好性分析结果表明:由于黑曲霉 bgl基因中密码子 GCG和 CGC的使用频率与酵母菌的使用频率相差较大,可能对β-葡萄糖苷酶的表达产生较大影响.另外,分析表明β-葡萄糖苷酶分子中的磷酸化位点较多,有 18个丝氨酸磷酸化位点、12个苏氨酸磷酸化位点和 24个酪氨酸磷酸化位点,酵母在表达外源蛋白时可能会出现过度修饰作用,导致过多的磷酸基团的添加,致使表达的蛋白丢失部分活性.
3 结论
作者克隆了黑曲霉 bgl基因的 cDNA片段并进行了序列测定,将该片段插入到 pPI CZaA载体构建了 bgl基因的酵母表达载体.pPI CZaA载体具有信号肽可将重组蛋白分泌到培养基中,并且具有 Zeocin抗性标记以利于抗生素筛选.用 BstX I将重组表达质粒 pPI CZαA-bgl线性化后,采用电转化法转入毕赤酵母 GSIl5菌株中,进行 PCR鉴定证明该基因插入到毕赤酵母染色体的高效启动子 AOXI的下游.用高浓度的 Zeocin抗生素筛选获得了高拷贝转化子.将阳性重组酵母转化子在添加 1%甲醇的培养条件下进行诱导表达,表达产物经 SDS-PAGE电泳和 BGL酶活检测,证明甲醇诱导的转基因工程菌可分泌表达具有β-葡萄糖苷酶活性的重组蛋白,成功地获得了一株可产β-葡萄糖苷酶的重组酵母菌.
利用上述重组的酵母工程菌进行果酒发酵生产时,酵母菌可表达产生β-葡萄糖苷酶,通过β-葡萄糖苷酶的催化作用可使酒中的风味物质的释放量大大提高,从而提高果酒的香味.由此可见,本研究所构建的酵母工程菌具有较高的应用开发前景.
[1] 宛晓春,汤坚.β-葡萄糖苷酶提高果酒的天然风味[J].食品科学,1998,19(7):32-34.
[2] 陶宁萍.苦杏仁酶在纯天然青梅果汁中的应用[D].南京:南京农业大学,1993.
[3] 李平,宛晓春,丁霄霖,等.黑曲霉β-葡萄糖苷酶的食品增香应用 [J].食品与发酵工业,2000,26(2):5-6.
[4] 邵金辉,韩金祥,朱有名,等.β-葡萄糖苷酶在工农医领域的应用 [J].生命的化学,2005,25(1):22-23.
[5] 张芳,阙生全,黎定标.β-葡萄糖苷酶高产菌株筛选 [J].南昌高专学报,2007(4):123-125.
[6] 朱凤妹,李军,杜彬,等.黑曲霉产β-葡萄糖苷酶发酵培养基的优化研究[J].酿酒科技,2008(3):43-45.
[7] 闫会平,吴兴泉,陈士华,等.黑曲霉β葡萄糖苷酶的基因克隆[J].河南工业大学学报:自然科学版,2006,27(1):39-42.
[8] 杨晟,黄鹤,章如安.重组人血清蛋自在Pichia pastoris中分泌表达影响因素的研究[J].生物工程学报,2000,16(6):675-678.
[9] 闫会平.黑曲霉β-葡萄糖苷酶的基因克隆[D].郑州:河南工业大学,2006.
RESEARCH ON THE EXPRESSI ON OFbglGENE OF ASPERGILLUS N IGERI NPICHIA PASTORIS
CHEN Shi-hua,GENG Rui-fan,XUE Zhen,WU Xing-quan
(School of B iotechnology,Henan University of Technology,Zhengzhou450001,China)
In order to construct an engineering yeast strain capable of secretingβ-1,4-glucosidase ofAspergillus niger,the article studied the expression ofβ-1,4-glucosidase gene(bgl)in yeast.The cDNA ofbglgene of Aspergillus nigerwas cloned,and a yeast expression vector of thebglgene cDNA was constructed by using pPICZαA plas mid.The vector was linearized and transferred intoPichia pastorisby electroporation method.The results showed that the gene was transferred toPichia pastorisand was expressed successfully through induction culture in methanol as the inducer;the recombinant protein had the activity in hydrolyzingβ-1,4-glucosidase;after induction culture for 72 hours,the enzyme activity of the borth was up to 0.78 U/mL.
Aspergillus niger;Pichia Pastoris;β-1,4-glucosidase gene;expression
TS201.3
B
1673-2383(2010)05-0042-04
2010-05-11
河南工业大学校博士科研启动基金项目;河南省优秀青年骨干教师项目(155)
陈士华 (1972-),女,黑龙江克东人,硕士,副教授,研究方向为生物信息学与分子生物学.

