天祝牧区牦牛乳酥油中产脂肪酶菌株筛选及产酶条件的研究
孙国政,甘伯中,3,*,张卫兵,李晓鹏
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学研究测试中心,甘肃兰州730070;3.甘肃省干酪素工程技术研究中心,甘肃兰州730000)
天祝牧区牦牛乳酥油中产脂肪酶菌株筛选及产酶条件的研究
孙国政1,2,甘伯中1,2,3,*,张卫兵1,2,李晓鹏1,2
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学研究测试中心,甘肃兰州730070;3.甘肃省干酪素工程技术研究中心,甘肃兰州730000)
从甘肃省天祝牧区牦牛乳酥油中分离筛选产脂肪酶微生物。经初筛、复筛后得菌株S122产脂肪酶活力较高;形态学观察和26S rDNA序列比对分析表明该菌为Geotrichum sp.S122。对菌株Geotrichum sp.S122发酵产酶条件进行研究表明,其最适的发酵培养基组成成分(%):蔗糖1.0、蛋白胨2.0、硫酸镁0.1、磷酸氢二钾1.0、橄榄油乳化液1.0;最适发酵产酶条件:培养基初始pH8.0,培养温度28℃,接种量4%,装液量60mL/250mL,摇床转速200r/min,发酵周期96h,优化后脂肪酶活力最高达59U/mL。
牦牛乳酥油,脂肪酶,分离筛选,产酶条件
脂肪酶(lipase,EC3.1.1.3)全称甘油三酯水解酶,是一类重要的甘油酯键水解酶,广泛存在于动物、植物和微生物中,能够在油水界面催化甘油三酯水解生成脂肪酸、甘油、甘油一酯及甘油二酯,也可催化合成脂类化合物及完成酯交换[1-2]。因此,脂肪酶在食品、医药、生物化工、洗涤剂、制革、水产、饲料、造纸、油脂、环保等许多工业领域中均有广泛的应用[3-6]。脂肪酶来源非常广泛,在许多动植物和微生物中都存在[7]。目前对微生物脂肪酶的研究已有报道[8-11],其均为从土壤中分离筛选产脂肪酶微生物,从牦牛乳酥油中分离筛选产脂肪酶微生物的报道目前尚未出现。甘肃天祝藏族自治县的牧民将牦牛乳经过离心脱脂制成酥油,牧民在长期贮藏酥油过程中酥油的品质发生劣变,一方面由于在贮藏过程中酥油自身发生油脂氧化反应;另一方面酥油在粗放型环境中制作,外界微生物侵染,在后续贮藏过程中由于酥油丰富的营养使微生物大量生长繁殖释放胞外脂肪酶催化酥油裂解成游离脂肪酸导致酥油品质变化。天祝牧区地处高原,常年气温低下[12],酥油在贮藏过程中油脂自身发生氧化反应几率相对小,因此推断酥油发生品质变化的主要原因是微生物分泌胞外脂肪酶催化所致,所以天祝牦牛乳酥油是分离筛选产脂肪酶微生物很好的来源。本研究对从甘肃省天祝牧区牦牛乳酥油中筛选分离的菌株进行产脂肪酶性能研究并对其鉴定,同时研究了该菌株的生长产酶条件,为进一步开发利用脂肪酶资源提供依据。

表1 不同菌株在基础发酵培养基中的发酵酶活力
1 材料与方法
1.1 材料与仪器
牦牛乳酥油 采集甘肃省天祝牧区;富集培养基 酵母膏2g/L、磷酸氢二钠3.5g/L、磷酸二氢钾1.5g/L、硫酸镁0.5g/L、氯化钠0.5g/L、橄榄油乳化液10mL/L,pH7.0;平板分离培养基 酵母膏1g/L、牛肉膏1g/L、蛋白胨10g/L、氯化钠5g/L、琼脂20g/L、橄榄油乳化液20mL/L,pH7.0;种子培养基 蛋白胨25g/L、蔗糖10g/L、硫酸铵5g/L、硫酸镁0.5g/L、酵母膏2g/L、磷酸氢二钾1g/L、橄榄油乳化液10mL/L,pH自然;摇瓶复筛培养基[13]蛋白胨20g/L、蔗糖10g/L、硫酸铵 1g/L、硫酸镁 0.5g/L、磷酸氢二钾1g/L、橄榄油乳化液10mL/L,pH8.0;橄榄油乳化液制备 橄榄油与体积分数4%的聚乙烯醇(PVA)以1∶3(V/V)的比例混合,10000r/min搅拌乳化5min即为橄榄油乳化液。
SW-CJ-2FD超净工作台 苏州净化;YX-280A高压灭菌锅 上海三申;HG303-4电热恒温培养箱
南京实验仪器厂;PB203-N电子天平 上海;pHS-25数显pH计 上海精密科学仪器厂;XSP-18S显微镜。
1.2 菌种分离
1.2.1 富集培养 准确称取1.00g样品于灭菌的100mL三角瓶中,每瓶中含30mL生理盐水,10粒玻璃珠,室温下120r/min振荡10min;吸取样品悬液5mL于装有50mL富集培养基的250mL三角瓶中,28℃摇床培养24h后,转接2mL浑浊的样品悬液到新鲜的富集培养基中,连续富集培养3次。
1.2.2 初筛 吸取富集培养液1mL于9mL无菌生理盐水中,采用梯度稀释法稀释至10-5,取10-3、10-4、10-5三个稀释度菌悬液200!L涂布到平板分离培养基。28℃培养24h以获得产脂肪酶的菌株。观察培养基上是否有透明圈,根据透明圈直径与菌落直径比值的大小,选取比值较大的菌株于PDA培养基4℃保存,以备进一步复筛。
1.2.3 复筛 初筛分离后的菌株转接到基础发酵培养基中,28℃条件下摇床培养48h,10000r/min离心10min,取上清液测定酶活。
1.3 脂肪酶活力的测定
脂肪酶活力为在40℃,pH8.0条件下,每1min催化底物(橄榄油)产1!mol脂肪酸所需的酶量定义为1个活力单位(IU)[14]。
脂肪酶活测定方法采用碱滴定法测定酶活[15]。50mL的三角瓶中加入4mL pH8.0的甘氨酸-NaOH缓冲液,5mL聚乙烯醇橄榄油乳化液,将其放置40℃水浴预热 5min,然后精确加入 1mL酶液,保温10min,立即加入15mL乙醇终止反应,加入酚酞指示剂2滴,用0.05mol/L NaOH滴定至红色为终点。
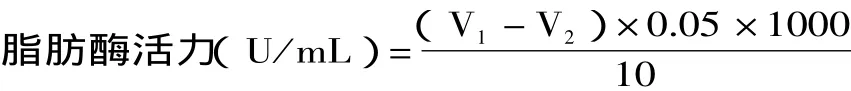
其中:V1—样品溶液滴定值(mL);V2—对照滴定值(mL)。
1.4 菌种鉴定
1.4.1 形态学观察 分离纯化后的菌株在28℃马铃薯琼脂营养平板培养48h,观察菌落形态及其在显微镜下的菌丝形态。
1.4.2 26S rDNA序列测定及系统发育分析 将菌体于10!L灭菌水中99℃变性10min,离心取上清液作为模板。使用 TaKaRa Fungi Identification PCR Kit(Code No.D317)进行PCR扩增目的片段(正向引物:5′-GCATATCAATAAGCGGAGGAAAAG-3′;反向引物:5′-GGTCCGTGTTTCAAGA CGG-3′),反应体系共50!L,94℃预变性5min,94℃变性0.5min,55℃退火0.5min,72℃延伸1min,30个循环,72℃保温5min。取5!L进行3%琼脂糖凝胶电泳,然后切胶回收目的片段进行26S rDNA测序,测序由宝生物(大连)公司完成。将测定的26S rDNA序列与GenBank中核酸序列数据库进行比对分析,并基于相关属菌株的26S rDNA序列,利用软件MEGA 4.0构建系统发育进化树,进行系统发育分析。
1.5 菌株产酶条件的研究
以摇瓶复筛培养基为基础发酵培养基,分别改变其中的碳源、氮源、无机盐、橄榄油添加量研究其对脂肪酶产生的影响,其他条件均为培养基初始pH8.0、培养温度 28℃、接种量 5%、摇床转速180r/min、培养时间48h。在获得的优化培养基上进一步研究培养基初始pH、培养温度、摇床转速、发酵时间、装液量、接种量等对脂肪酶产生的影响。
2 结果与分析
2.1 产脂肪酶菌种的分离和筛选菌株
利用油脂平板分离法,从牦牛乳酥油中富集培养得到的微生物中初筛产脂肪酶菌株,根据水解透明圈直径的大小挑选出10株形态各异的产脂肪酶单菌落菌株作为复筛对象。将分离得到的菌株转接到复筛培养基摇瓶中,28℃、200r/min培养48h,发酵液10000r/min离心20min,取上清液测定脂肪酶酶活性。结果见表1。
由表1可知,10株产脂肪酶菌株在基础发酵培养基中发酵48h后,菌株S122的酶活最高38.9U/mL,故将产脂肪酶株菌S122进行鉴定并对其进行后续研究。
2.2 菌株的鉴定
2.2.1 形态学鉴定 菌株S122在28℃马铃薯琼脂营养平板上培养48h后,菌落呈圆形平面扩散,乳白色,短绒状或近于粉状;显微镜下观察,菌体具有分支的菌丝体,形成单个或成链的节孢子,节孢子呈长筒形或方形,也有椭圆或圆形(图1)。根据魏景超[16]《真菌鉴定手册》鉴定菌株 S122为半知菌类(Fungi imperfecti)、丛梗孢目(Moniliales)、丛梗孢科(Moniliaceae)、卵形孢霉菌(Oosporeae)、地霉属(Geotrichum LK.)。
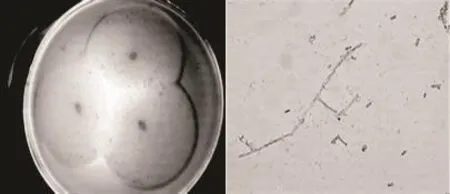
图1 菌株S122的菌落及菌体形态
2.2.2 26S rDNA序列测定及系统发育分析 测序得到菌株S122的26S rDNA核酸序列去载体、拼接处理后得26S rDNA目的核酸序列,其长度为522bp;将得到26S rDNA目的核酸序列在NCBI网站上进行序列同源性比对,绘制系统发育进化树(图2)。结果表明,菌株S122与Geotrichum silvicola M17系统位置最近,同源性为 100%,结合形态学鉴定,鉴定为Geotrichum sp.S122。

图2 根据26S rDNA序列同源性构建的S122与相关菌株系统进化树
2.3 菌株S122产酶条件的研究
2.3.1 不同碳源对产酶的影响 基础发酵培养基中分别添加1%葡萄糖、可溶性淀粉、玉米粉和蔗糖,均接入5%的种子液,28℃摇床转速为180r/min的条件下培养48h,测定酶活,确定产脂肪酶微生物Geotrichum sp.S122的最适碳源。由图3可知,菌株Geotrichum sp.S122利用不同碳源产脂肪酶差异较大,当以蔗糖为碳源时发酵液酶活最高为31U/mL。
2.3.2 不同氮源对产酶的影响 基础发酵培养基中分别添2%的蛋白胨、牛肉膏、酵母膏、黄豆粉和0.5%的硫酸铵、尿素、氯化铵和硝酸铵,均接入5%的种子液,在28℃摇床转速为180r/min的条件下培养48h,测定酶活,确定产脂肪酶微生物Geotrichum sp.S122的最适氮源。由图 4可知,不同氮源对Geotrichum sp.S122产脂肪酶的影响显著,有机氮源蛋白胨对发酵产酶影响最显著,无机氮源对发酵产酶影响不显著。
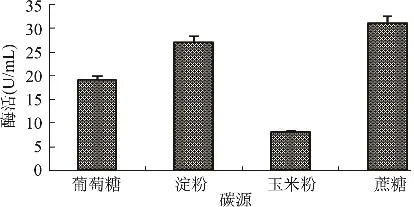
图3 不同碳源对发酵产酶的影响

图4 不同氮源对发酵产酶的影响
2.3.3 无机盐对产酶的影响 基础发酵培养基中分别添加0.1%的硫酸镁、磷酸氢二钾、氯化钙、氯化钠、硫酸锌、硫酸亚铁、硫酸锰和1%磷酸氢二钾,均接入5%的种子液,28℃摇床转速为180r/min的条件下培养48h,测定酶活,确定不同无机盐离子对发酵产酶的影响。由图5可以看出,在培养基中添加Mg2+、K+、Zn2+、Fe2+和Mn2+对发酵产酶有促进作用,其中Mg2+的效果更显著;K2HPO4在培养基中主要起酸碱缓冲作用;Na+对发酵产酶具有抑制作用。

图5 无机盐离子对发酵产酶的影响
2.3.4 不同橄榄油含量对产酶的影响 基础培养基中分别添加不同量的橄榄油乳化液,均接入5%的种子液,28℃摇床转速为180r/min的条件下培养48h,测定酶活,确定不同橄榄油含量对发酵产酶的影响。由图6可知,培养基中添加不同量橄榄油对产酶有显著影响,当培养基中不含橄榄油时,发酵液酶活较低;当橄榄油含量为1%时,酶活最高36U/mL。
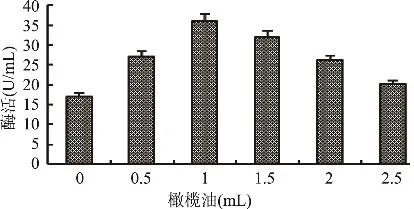
图6 不同橄榄油含量对产酶的影响
经过以上实验对产脂肪酶培养基组分优化,确定Geotrichum sp.S122的最佳产酶培养基组成为1%蔗糖、2%蛋白胨、0.1%硫酸镁、磷酸氢二钾1%、橄榄油乳化液1%。
2.3.5 培养温度对发酵产酶的影响 温度影响发酵液的物理性质,直接影响到菌株的生长速度,因此在培养过程中必须保证稳定和合适的温度。250mL的三角瓶中分别装100mL基础发酵培养基,接入5%的种子液分别置于25、28、30、35和40℃条件下摇床培养48h,以离心后的粗酶液酶活为指标,考察温度对发酵产酶的影响。由图7可知,随着发酵温度的升高,酶活逐渐增大,在28℃时发酵液酶活达到最高为30U/mL;温度高于28℃时,发酵液酶活逐渐降低。故选择培养温度为28℃。
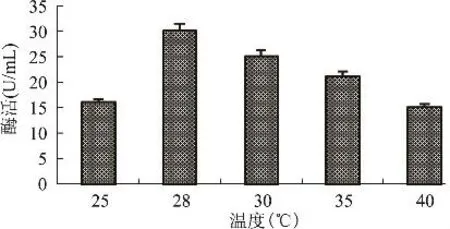
图7 温度对发酵产酶的影响
2.3.6 培养基初始pH对发酵产酶的影响 pH是影响微生物发酵的一个重要因素,不同微生物生长繁殖的最适pH不同。将基础发酵培养基的pH分别调至4.0、5.0、6.0、7.0、8.0和9.0,接入5%的种子液28℃摇床培养48h,以离心后的粗酶液酶活为指标,考察pH对发酵产酶的影响。由图8可知,基础发酵培养基pH为4~7时,菌株S122发酵液酶活变化幅度不大;当培养基初始pH为8.0时,发酵液酶活最高为32U/mL;pH为9.0时,发酵液酶活明显降低。故选择培养基初始pH为8.0。
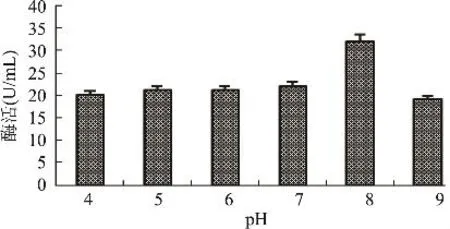
图8 培养基初始pH对发酵产酶的影响
2.3.7 发酵时间对发酵产酶的影响 发酵时间主要影响发酵过程中酶的产量,发酵时间过短,培养基中的营养物质没有完全被菌体利用,酶产量较低;发酵时间过长,菌体会耗尽培养基中的营养物质,导致菌体自溶,pH上升,对酶的产量也有影响。将基础发酵培养基的pH调至8.0,接入5%的种子液,28℃摇床培养,在不同的发酵时间测定发酵液酶活。由图9可知,随着发酵时间的延长,发酵液酶活逐渐增大,当连续发酵96h时发酵液酶活最高为35U/mL。
2.3.8 摇瓶装液量对发酵产酶的影响 溶解氧的浓度会影响微生物的生长,在培养过程中微生物只能利用溶解在培养基中的溶解氧。如果中断供氧,菌体就会短时间内把培养基中的氧耗尽,所以在发酵过程中必须不断地供给空气,使培养基中的溶解氧保持一定水平,装液量显著影响培养基中溶解氧的浓度。在250mL的三角瓶中分别装30、40、50、60、70mL的基础发酵培养液,接入5%的种子液,28℃摇床培养96h,以离心后的粗酶液酶活为指标,考察装液量对发酵产酶的影响。由图10可知,随着摇瓶装液量的增加,发酵液酶活逐渐增大,当250mL三角瓶中装 60mL发酵培养基时,发酵液酶活最高为37U/mL。

图9 发酵时间对发酵产酶的影响
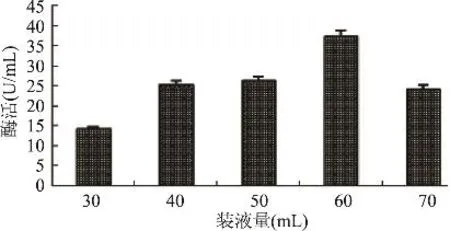
图10 装液量对发酵产酶的影响
2.3.9 不同接种量对发酵产酶的影响 接种量影响菌体的生长和形态。接种量较少,对菌体生物量和酶的合成不利;适中的接种量可以缩短菌体的生长周期,这是由于种子量多,同时种子液中含有大量体外水解酶类,菌种进入发酵培养基后容易适应,有利于对基质的利用;接种量过大往往使菌体生长过快,培养液粘度增大,造成基质缺乏或溶解氧不足。因此,实验中应选择合适的接种量。在60mL/250mL的基础培养基中分别接种2%、4%、6%和8%的种子液,28℃摇床培养96h,以离心后的粗酶液酶活为指标,考察接种量对发酵产酶的影响。由图11可知,当接种量为4%时发酵液酶活最高为50U/mL。

图11 接种量对发酵产酶的影响
2.3.10 摇床转速对发酵产酶的影响 在60mL/ 250mL的基础培养基中接入4%的种子液,分别在摇床转速0、150、175、200、225r/min条件下28℃培养96h,以离心后的粗酶液酶活为指标,考察摇床转速对发酵产酶的影响。由图 12可知,摇床转速为200r/min时发酵液酶活最高为59U/mL。当摇床转速较低时,酶活较低,可能由于转速较低时不利于菌体与培养基的充分接触,导致菌体未获得充足的营养;另一方面转速较低导致发酵液中溶氧量低,抑制菌体繁殖,从而抑制了酶的分泌。当转速高于200r/min时,粗酶液酶活明显降低,可能由于转速较高时溶液中的剪切力过大,对菌体造成损伤。
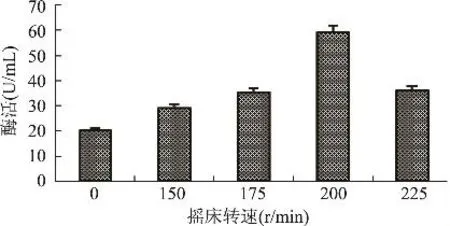
图12 摇床转速对发酵产酶的影响
3 讨论
国内对Geotrichum LK.脂肪酶的研究已有报道,其均从土壤中分离筛选得到,从牦牛乳酥油中分离筛选产脂肪酶微生物的研究目前尚未报道。本研究采用平皿透明圈法对产脂肪酶菌株进行大量的筛选,从甘肃天祝牧区牦牛乳酥油中筛选得到一株产脂肪酶活性较高的菌株S122,经形态学和26S rDNA序列同源性比对分析鉴定为Geotrichum sp.S122。
对菌株Geotrichum sp.S122发酵产酶条件研究表明,其最适的发酵培养基组成成分(%):蔗糖1.0、蛋白胨2.0、硫酸镁0.1、磷酸氢二钾1.0、橄榄油乳化液1.0;最适发酵产酶条件为:培养基初始pH8.0,培养温度28℃,接种量4%,装液量60mL/250mL,摇床转速200r/min,发酵周期 96h。王蕾[17]等对 Geotrichum sp.GXU33脂肪酶发酵条件进行研究,优化后脂肪酶活力只有10.68U/mL;本研究对 Geotrichum sp.S122脂肪酶发酵条件初步优化后,酶活最高达59U/mL。
在发酵产酶过程中,以葡萄糖为碳源时脂肪酶活力较低,与文献[18]报道的葡萄糖不利于脂肪酶产生相一致;在培养基组成中,蔗糖对发酵产酶的影响最显著。很多菌株产生的脂肪酶属于诱导酶,在培养基中添加适量的油脂或金属盐可有效促进产酶或提高酶活性[19]。本研究中,Mg2+、K+、Zn2+、Fe2+和Mn2+对发酵产酶有促进作用,其中Mg2+的效果更显著,周海霞[20]等对脂肪酶产生菌假单胞菌研究表明,Mg2+对产酶有良好的促进作用,但是Zn2+和Mn2+对产酶有一定的抑制作用,与本研究结果相反。Geotrichum sp.S122产脂肪酶还需油脂的诱导,培养基中不含橄榄油时菌体产酶活力较低,但过多的橄榄油会抑制脂肪酶的产生,这可能是因为油脂降解后的脂肪酸有阻遏抑制产脂肪酶的作用。
本研究对从天祝牧区牦牛乳酥油筛选出的产脂肪酶菌株 Geotrichum sp.S122目前只做了初步的研究,在后续的研究中将对菌株Geotrichum sp.S122进行诱变处理并对其产脂肪酶的培养基进行系统优化,以进一步提高其发酵酶活力。
[1]Candhi N N.Applications of lipase[J].J Am Oil Chem Soc,1997,74(6):621-634.
[2]李香春,甄宗园.脂肪酶特性及其应用[J].粮食与油脂,2003(3):19-20.
[3]Jaeger KE,Dijkstra BM,Reetz MT.Bacterial biocatalysts:molecular biology, three - dimensional structures, and biotechnological applications of lipase[J].Annu Rev Microbiol,1999,53:315-351.
[4]孙宏丹,孟秀香,贾莉.微生物脂肪酶及其相关研究进展[J].大连医科大学报,2001,23(4):292-295.
[5]吴松刚.碱性脂肪酶研究进展及其产业化对策[J].发展论坛,2001(2):18-20.
[6]高贵,韩四平,王智.国内脂肪酶研究状况分析[J].生物技术通讯,2003(6):543-546.
[7]沈同,王镜岩.生物化学[M].北京:高等教育出版社,1991:151-152.
[8]韦晗宁,申佩弘,石玲玲,等.对映选择性 Geotrichum sp.GXU33脂肪酶的筛选、产酶及酶学性质研究[J].工业微生物,2008,38(1):30-36.
[9]段学辉,欧阳军梅,高鹤,等.产脂肪酶菌 Geotrichum candidum NS3的固定化及其稳定性[J].食品与生物技术学报,2009,28(2):224-227.
[10]王蕾,蔡宇杰,廖祥儒,等.Geotrichum sp.SYBCWU-3脂肪酶的双水相萃取和酶学性质[J].生物加工过程,2009,7(2):57-62.
[11]王俊华,杨洁,付建红,等.白地霉Cryytococcus neoformans脂肪酶的双水相萃取[J].中国生物工程杂志,2007,27(6):71-75.
[12]龙瑞军.藏民农户中传统饲养管理条件下牦牛的产奶性能[J].草业学报,1994,3(1):71-76.
[13]韦晗宁,申佩弘,石玲玲,等.对映选择性 Geotrichum sp.GXU33脂肪酶的筛选、产酶及酶学性质研究[J].工业微生物,2008,38(1):30-36.
[14]施巧琴.碱性脂肪酶的研究[J].微生物学通报,1998,8(3):108-110.
[15]郭勇.酶工程[M].北京:中国轻工业出版社,1994:317-318.
[16]魏景超.真菌鉴定手册[M].上海科学技术出版社,1979.[17]王蕾,蔡宇杰,廖祥儒,等.一株碱性低温脂肪酶产生菌发酵条件的优化[J].食品与生物技术学报,2008,27(3):510-514.
[18]胡朝阳,韦晗宁,李春苑,等.产脂肪酶菌株的筛选及酶学性研究[J].广西农业生物学,2006,25(3):261-264.
[19]伊芳芳,白方文,段静波,等.一株碱性脂肪酶产生菌的分离鉴定及其产酶条件[J].上海交通大学学报:农业科学版,2008,26(3):242-246.
[20]周海霞,袁丽红,欧阳平凯.脂肪酶假单胞菌的分离培养及最佳产酶条件的研究[J].现代医学进展,2008,8(2):259-262.
Screening lipase-producing microorganisms from yak butter of Tianzhu pasturing area and study on its fermentation conditions
SUN Guo-zheng1,2,GAN Bo-zhong1,2,3,*,ZHANG Wei-bing1,2,LI Xiao-peng1,2
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Analysis and Research Center of Gansu Agricultural University,Lanzhou 730070,China;3.Gansu Casein Engineering Technical Research Center,Lanzhou 730000,China)
Lipase-producing microorganisms were isolated from yak butter in the Tianzhu pasturing area of Gansu province.The high lipase-producing strain S122 was isolated by secondary screening.It was identified as Geotrichum sp.S122 through the morphological feature observation and 26S rDNA sequence analysis.The fermentation conditions of the lipase-production strain were optimized and fermentation techniques on the lipase production were studied.The results showed that the optimal medium composition for lipase production was as follows(%):sucrose 1.0,peptone 2.0,MgSO40.1,K2HPO41.0,olive oil 1.0.The optimal fermentation conditions were as follows:the initiation pH 8.0 for the culture medium,the optimal culture temperature 28℃,inoculation volume 4%,rotation speed 200r/min,culture medium 60mL/250mL(v/v)and the culture time 96h.After optimization,the lipase activity was 59U/mL.
yak butter;lipase;isolation and screening;conditions for lipase production
TS201.1
A
1002-0306(2010)12-0195-05
2009-12-11 *通讯联系人
孙国政(1982-),男,硕士研究生,研究方向:乳品微生物与酶工程。
甘肃省科技重大专项(0702NKDA034)。

