重组谷氨酸棒杆菌产苏氨酸发酵培养基的优化*
吕扬勇,伍展红,郑穗平
(华南理工大学生物科学与工程学院,广东广州,510006)
重组谷氨酸棒杆菌产苏氨酸发酵培养基的优化*
吕扬勇,伍展红,郑穗平
(华南理工大学生物科学与工程学院,广东广州,510006)
通过基因敲除构建了蛋氨酸合成途径关键酶基因metX缺失的重组谷氨酸棒杆菌R102ΔmetX。采用部分因子实验设计考察发酵培养基中各组分对重组菌产苏氨酸的影响。结果表明,葡萄糖、酵母粉和酶解酪素对产苏氨酸影响显著。继而采用最陡爬坡路径逼近最大响应区域,并结合中心组合实验和响应面对3个显著性因素进行分析,得到优化的发酵培养基组成:葡萄糖50.78g/L,酵母粉6g/L,酶解酪素0.99g/L,生物素80μg/L,VB12mg/L,CaCO320g/L,(NH4)2SO415.15g/L,MgSO4·7H2O 0.5g/L,KH2PO40.5g/L,K2HPO40.5g/L,Fe-SO4·7H2O 0.02g/L,MnSO4·7H2O 0.02g/L,接种量8%。采用该优化培养基,供试菌株的胞外苏氨酸浓度为3.35g/L,较优化前提高了30%。
谷氨酸棒杆菌,L-苏氨酸,响应面,培养基优化
L-苏氨酸是人和动物体内一种必需氨基酸[1],同时也是一种重要的营养强化剂,已广泛应用于饲料工业、保健食品和医药工业。自1935年 Rose和Meger在纤维蛋白水解物中分离并鉴定出苏氨酸以来[2],已发现的能产生苏氨酸的微生物主要有以下几种:大肠杆菌(Escherichiacoli)、谷氨酸棒杆菌(Corynebacterium glutamicum)、粘质沙雷氏菌(Serratia marcescens)和黄色短杆菌(Brevibacterium flavum)。近年来随着谷氨酸棒杆菌模式菌株ATCC 13032基因组测序的完成[3],利用基因工程改造谷氨酸棒杆菌成为现实[4]。要提高苏氨酸产量,为进一步的育种工作提供好的基础,除利用基因工程改造以外,发酵培养基的优化也较为重要。目前还未见针对重组谷氨酸棒杆菌发酵培养基响应面优化生产苏氨酸的相关报道。
基于非完全平衡块原理的Plackett-Burman(PB)法能通过对每个因子取2水平进行分析,通过比较各个因子两水平的差异与整体的差异来确定因子的显著性[5]。响应面法(Response Surface Methodology,RSM)可以建立连续变量曲面模型,并可以同时对影响产量的各因子水平及其交互作用进行优化与评价。因此PB设计及响应面法已广泛应用于各类培养基的优化研究中[6-7]并取得了良好的效果。本研究利用PB设计法,对重组谷氨酸棒杆菌产苏氨酸培养基的主要影响因子进行筛选,然后采用响应面法对主要影响因子间的交互作用进行了研究,以获得产苏氨酸的最优培养基,提高重组谷氨酸棒杆菌的产酸能力,为食品工业苏氨酸育种提供基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
重组谷氨酸棒杆菌R102ΔmetX(Corynebacterium glutamicum R102(AHVr)with deletion in the metX gene),为本实验室构建。
1.1.2 培养基
种子培养基:种子培养基(g/L):葡萄糖40,蛋白胨20,KH2PO41.5,K2HPO40.5,MgSO4·7H2O 0.5,酵母粉 5,生物素 50μg/L。
发酵培养基(g/L):葡萄糖100,KH2PO40.5,K2HPO40.5,(NH4)2SO420,MgSO4·7H2O 0.25,Fe-SO4·7H2O 0.01,MnSO4·4H2O 0.01,CaCO320,酵母粉5,生物素 400μg/L,VB12mg/L,上述培养基均需要调整pH值为7.0。
1.2 试验方法
1.2.1 菌种活化
将保存在-80℃冻存管中的菌种接于LB固体培养基上,30℃培养24 h,划线转接3次得到活化的菌种。
1.2.2 培养方法
将活化的菌种挑取単菌落接种于种子培养基中,于30℃,200 r/min培养24 h,以10%接种量接于装有25mL发酵液的250mL的三角瓶中30℃,215 r/min发酵72 h,HPLC法检测胞外苏氨酸浓度。
1.2.3 发酵液中苏氨酸的含量测定
采用高效液相分析系统(HPLC)柱前衍生测定。衍生方法:取发酵液1mL,12 000 r/min离心5 min,取上清液100μL加入1.5mL离心管中,加入已经配制好的衍生缓冲溶液(0.5mol/L NaHCO3溶液,pH9.0)100μL,摇匀后再加入衍生试剂溶液(1%2,4-二硝基氟苯的乙腈溶液)150μL,摇匀,将离心管置于60℃水浴中暗处恒温加热60 min后取出,冷却溶液至室温后,加入定容缓冲液(0.01mol/L KH2PO4,pH 7.0) 稀释至1.2mL,用0.22 μm 针筒式过滤器过滤后,用于色谱分析。采用Agilent 1100高效液相色谱仪,Agilent 20RBAX SB-C18(4.6×150 nm,5 μm)色谱柱,紫外检测器,360 nm 检测。流动相分别为A:乙酸钠缓冲溶液(pH 6.5,含10mL/L N,N-二甲基甲酰胺),B:60%乙腈。流动相速度为1.0mL/min;柱温22℃。梯度洗脱程序见表1。
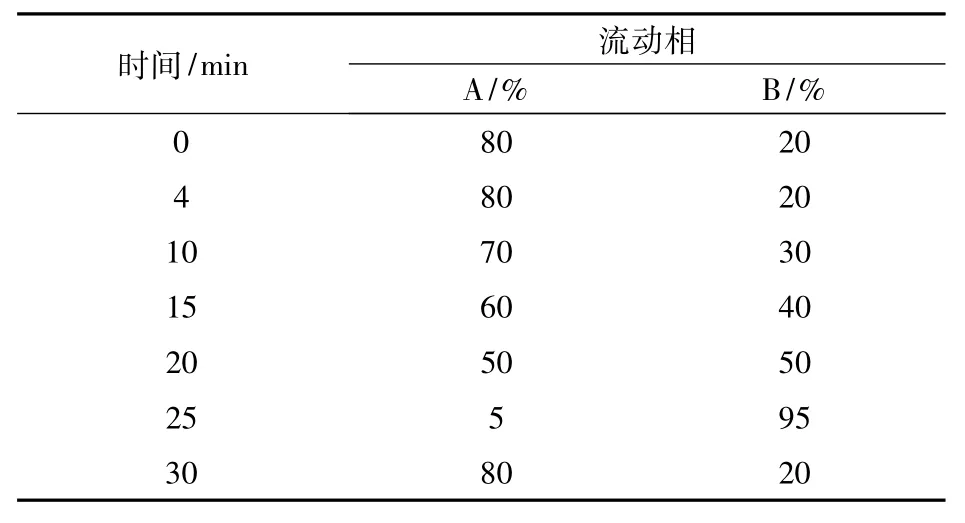
表1 流动相梯度程序
测定完毕以后利用标准曲线计算发酵液中苏氨酸的含量。
1.3 试验设计
1.3.1 PB实验
本试验选取12个因子(变量)进行试验,各参数所代表因子及其水平见表2。每个试验均进行2次,对应的响应值取2次试验结果的平均值,评价指标(响应值)为发酵液中苏氨酸浓度。
1.3.2 最陡爬坡试验
根据PB试验结果得到的一阶模型按其回归系数的符号和大小,设计显著因子的最陡爬坡路径和步长,找出峰值,从而快速接近最大响应区域。
1.3.3 响应面分析
由最陡爬坡试验逼近最大响应区域后,采用旋转中心组合设计(central composite rotatable design,CCD)法对其进行进一步研究,以获得最佳发酵培养基。用多项式回归对试验数据进行拟合,得到一个描述响应值(苏氨酸浓度)与自变量(发酵条件)关系的一个二次多项式方程(以3因素为例):
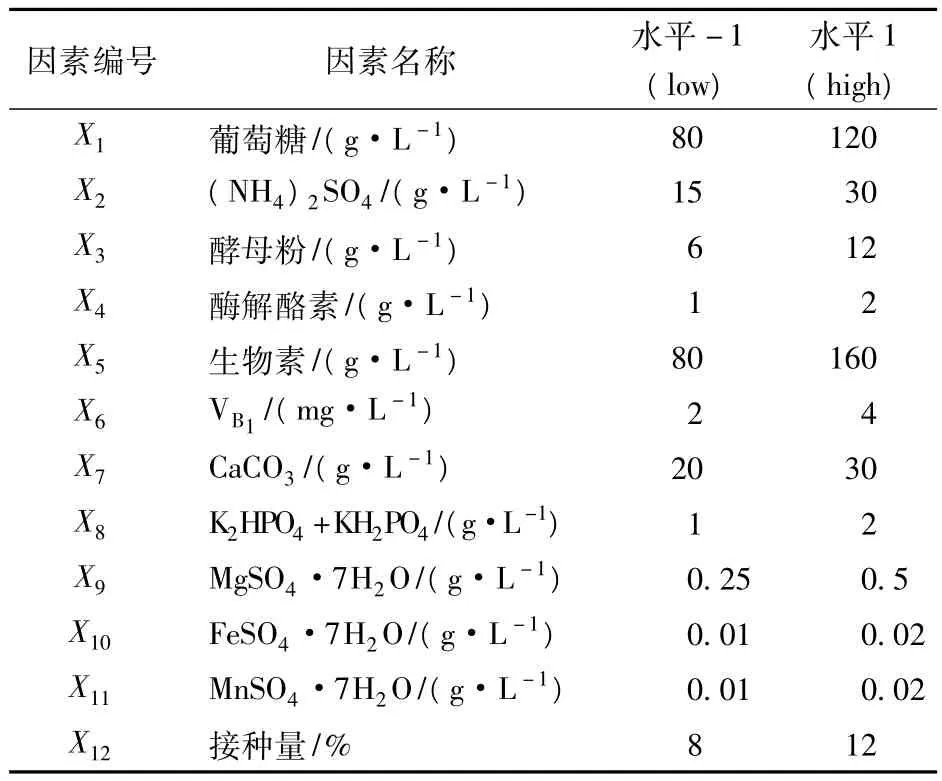
表2 Plackett-Burman试验设计的因子水平及其编码
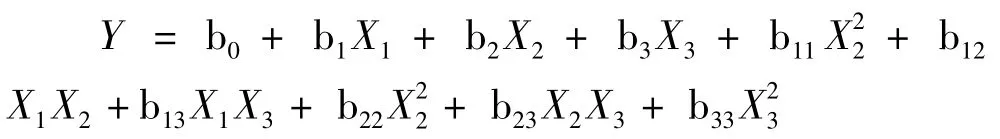
式中:X1、X2、X3为由部分因子实验确定对响应值影响显著的3种培养基组分的编码值,Y为预测响应值,即苏氨酸浓度(g/L),b0、b1、b2、b3、b11、b12、b13、b22、b23、b33为方程系数。上述每个试验均进行 2次,对应的响应值取2次试验结果的平均值。实际考察的变量及其试验水平编码见表3。

表3 旋转中心组合设计试验的因素水平及其编码
2 结果与分析
2.1 PB筛选影响苏氨酸产量的显著因子
PB试验结果见表4。通过minitab 15软件对表4试验数据进行方差分析,结果见表5,各因子显著性分析见表6
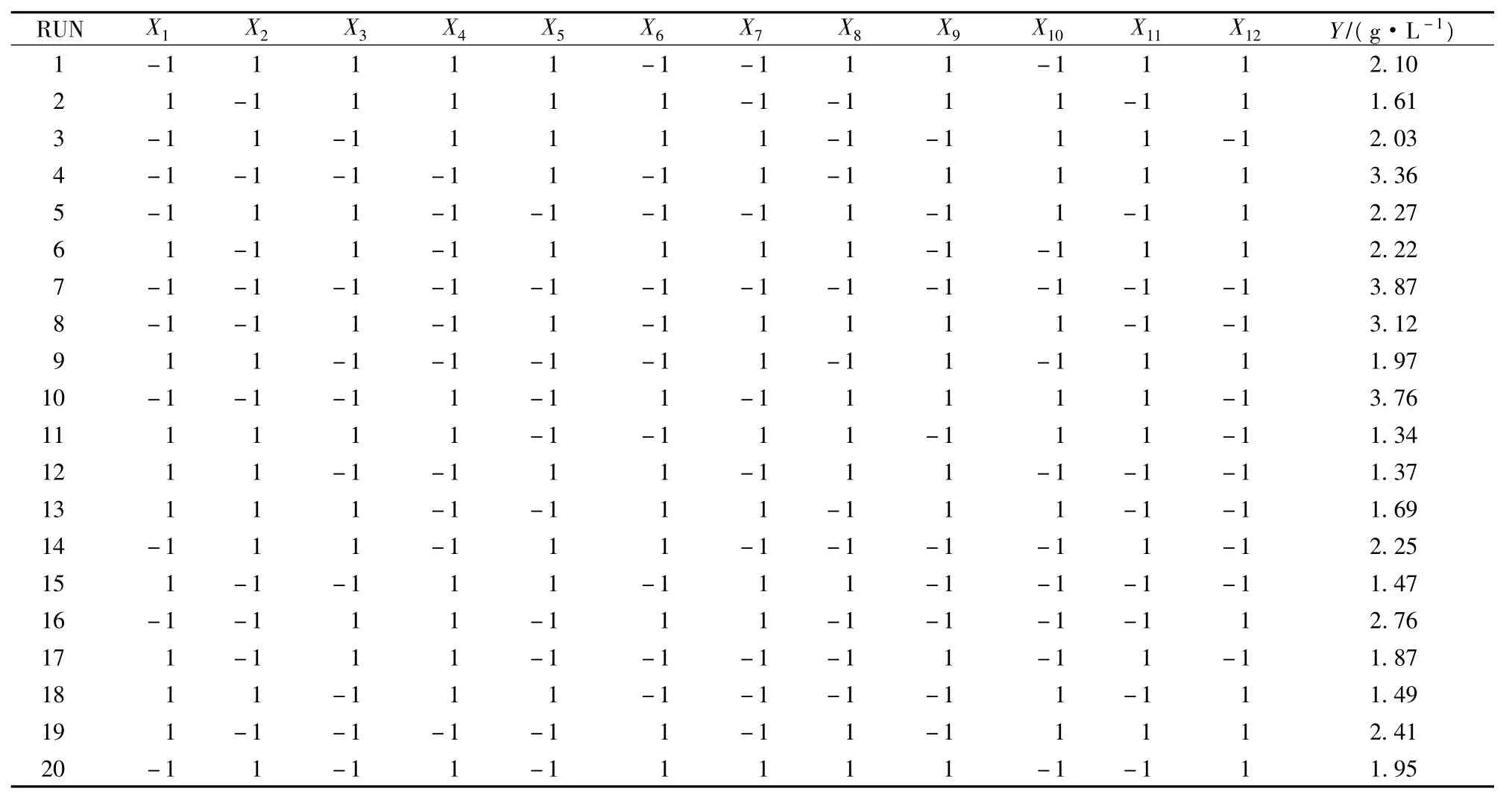
表4 Plackett-Burman设计及试验结果
采用minitab 15对表4中的苏氨酸产量数据进行逐步回归分析,剔除掉不显著因子,得到以苏氨酸产量为响应值的一阶回归方程:


表5 Plackett-Burman试验回归方程方差分析
回归方程方差分析(表5)表明,所得方程达到极显著(P=0.009),说明该回归模型在被研究的整个回归区域拟合的较好。相关系数R2=0.92,说明相关性较好,校正决定系数AdjR2=0.80,表明80%的试验数据的变异性可用此回归模型来解释。
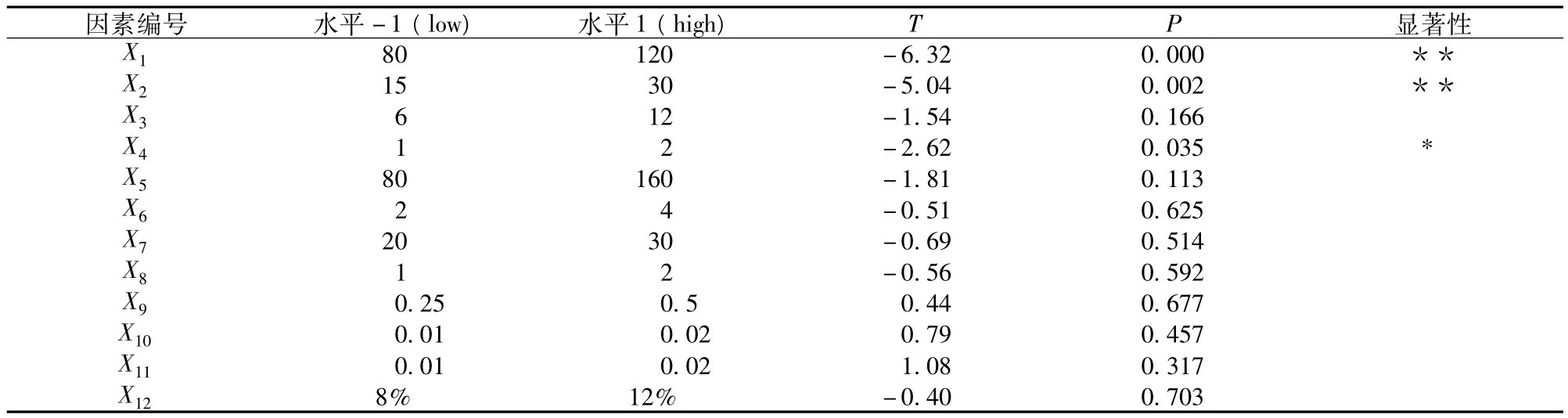
表6 Plackett-Burman试验回归方程系数的显著性检验
由表6可以看到,影响R102ΔmetX发酵产苏氨酸的重要因素为:X1、X2、X4,即葡萄糖、(NH4)2SO4和酶解酪素。3者对苏氨酸产量的影响均为负效应,在后续最陡爬坡试验中应该降低3者数值。不显著因素中 MgSO4·7H2O、FeSO4·7H2O、MnSO4·7H2O为正效应,在后续试验应取其高水平;其余均为负效应,在后续响应面试验中应取其低水平。
2.2 最陡爬坡试验
最陡爬坡试验设计及结果见表7。由表7可知,X1、X2和X43个因子的浓度在试验4附近时苏氨酸浓度最高,故选择试验4中的各因子的浓度,即葡萄糖55g/L、(NH4)2SO412g/L、酶解酪素0.9g/L为后续旋转组合试验设计的中心点。

表7 爬坡实验设计及结果
2.3 发酵培养基的响应面分析
2.3.1 二次回归模型拟合及检验
以2.2中确定的葡萄糖、酵母粉和酶解酪素3个因子的浓度为中心点,以苏氨酸浓度Y为响应值,设计旋转中心组合试验。根据试验设计表进行了20组试验,每组试验重复2次,取其平均值为响应值,结果见表8。
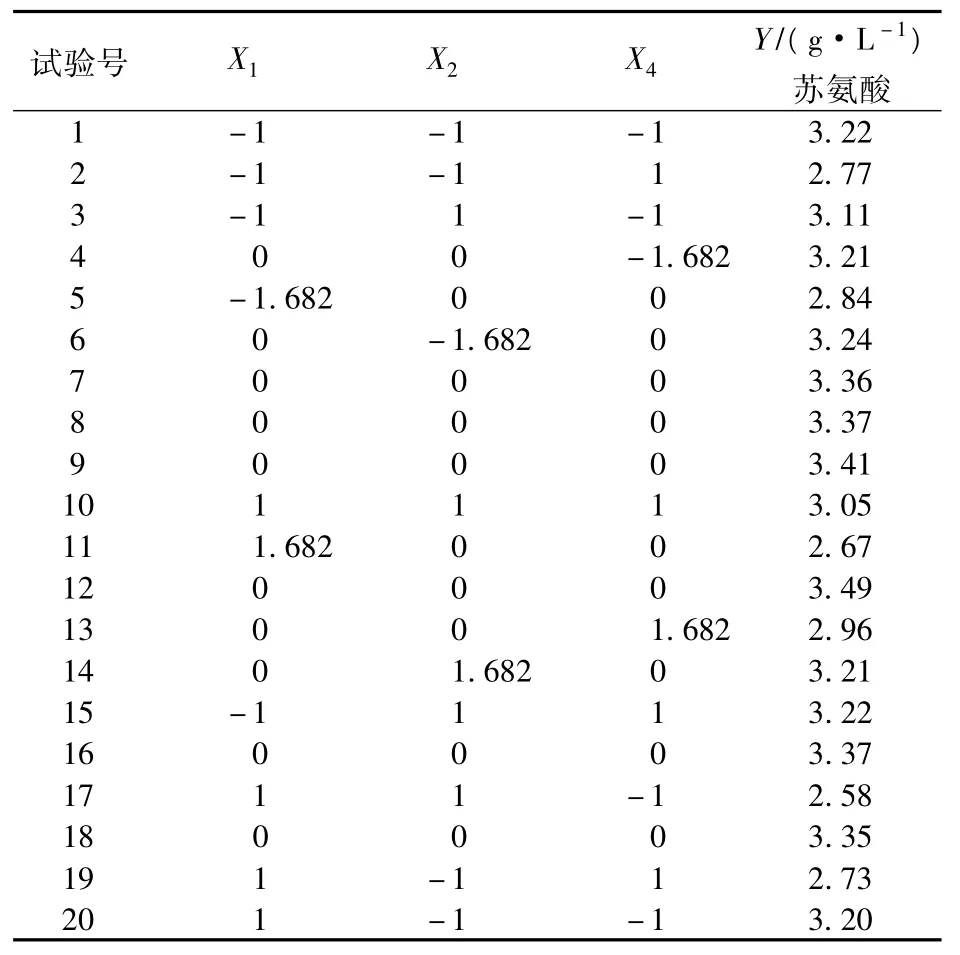
表8 旋转中心组合设计及其试验结果
对表8试验数据进行二次多项回归拟合,得二次多项式回归方程为:
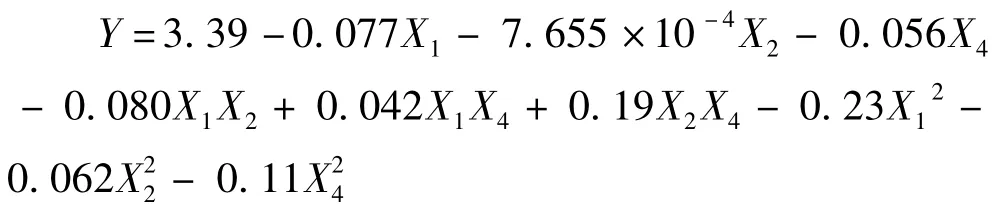
式中:Y为苏氨酸浓度预测值,X1、X2和X4分别为葡萄糖、(NH4)2SO4和酶解酪素的编码值。对得到的模型(上述方程)进行方差分析和系数显著性检验,方差分析结果表见表9,显著性检验结果见表10。
由表9可看出,该模型极显著(P <0.000 1),失拟项不显著(P=0.212 1>0.1)。经分析计算,该模型的确定系数R2=0.969 1,表明模型与实际情况符合很好,该模型可用于苏氨酸浓度的预测。

表9 苏氨酸浓度预测回归模型的方差分析
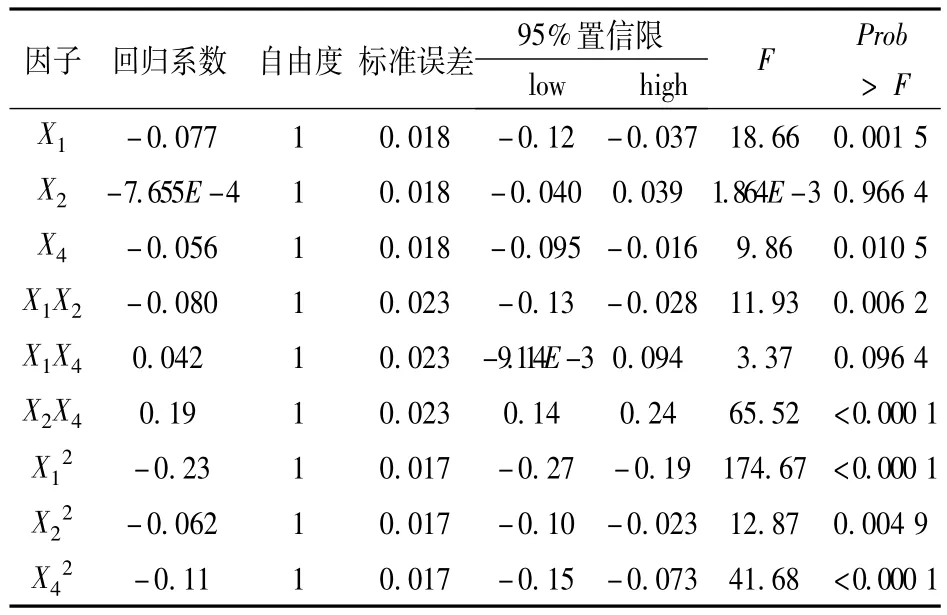
表10 苏氨酸浓度预测回归方程系数的显著性检验
表10说明,X1对苏氨酸浓度Y的影响达到极显著水平,即葡萄糖浓度是对试验结果影响较大的因子,同时X1与X2、X2与X4对苏氨酸浓度Y的交互影响均达极显著水平;X22、X42对酶活力Y的影响也达极显著水平,说明葡萄糖、酶解酪素对苏氨酸浓度的影响是二次关系。
2.3.2 响应面分析及最佳培养基成分的确定
图1、图2、图3是上述二次多项式拟合出的响应曲面图及其对应的等高线图。
比较3组图可知,葡萄糖浓度和(NH4)2SO4浓度、(NH4)2SO4浓度和酶解酪素浓度之间的交互作用显著。葡萄糖浓度和酶解酪素浓度对苏氨酸浓度的交互作用不显著。这些直观的分析结果与表10的分析一致,说明能真实地反应变量之间的交互作用。
图1显示在酶解酪素浓度一定的情况下,葡萄糖和硫酸铵对苏氨酸浓度的交互影响效应。随着葡萄糖浓度和硫酸铵浓度的不断增加,苏氨酸产量开始不断提高,后期呈现小幅下降。葡萄糖含量在48~60g/L,酶解酪素在10.25~13.75g/L时,苏氨酸浓度达到最高。说明一定程度上提高培养基中葡萄糖的浓度,有利于菌体生长并提高胞外苏氨酸含量,但过高的浓度对菌体产生高渗作用,不利于菌株生长,从而影响苏氨酸的分泌量。图2表示在(NH4)2SO4浓度一定的情况下葡萄糖和(NH4)2SO4对苏氨酸浓度的影响,当葡萄糖浓度为47.2~55.2g/L、酶解酪素浓度为0.78~0.85g/L时,苏氨酸浓度最高;图3表示在葡萄糖浓度一定情况下(NH4)2SO4和酶解酪素对苏氨酸含量的影响,当硫酸铵浓度8.5~13g/L,酶解酪素为0.7~0.9g/L时,苏氨酸浓度最高。

图1 酶解酪素浓度一定时,葡萄糖和(NH4)2SO4对苏氨酸的交互影响作用
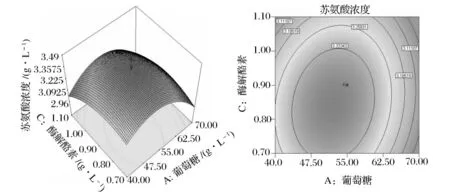
图2 (NH4)2SO4浓度一定时,葡萄糖和酶解酪素浓度对苏氨酸浓度的影响
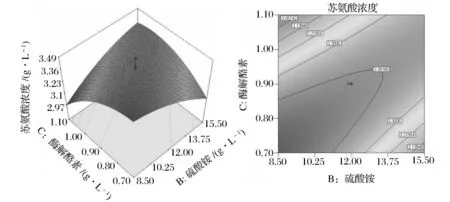
图3 葡萄糖浓度一定时,(NH4)2SO4和酶解酪素对苏氨酸含量的影响
方程二次项系数为负数,说明此方程有极大值,其表征的抛物面开口向下(图1、图2和图3),二次回归方程分别对X1、X2和X4求一阶偏导,整理得如下三元一次方程:

解得:X1=-0.281,X2=0.899,X4=0.468;即对应的非编码水平上3者的条件为:葡萄糖50.78g/L、(NH4)2SO415.15g/L、酶解酪素0.99g/L,此时苏氨酸浓度预测值为3.38g/L。
2.3.3 模型验证
以2.3.2确定的主要因子浓度配制发酵培养基,重复3次,然后测定胞外苏氨酸含量,同时将初始发酵培养基发酵所得结果作为对照。结果显示,苏氨酸浓度由优化前的2.58g/L上升到3.35g/L,提高了30%,与预测值较为接近。说明回归模型能够真实地反映各筛选因子对发酵产苏氨酸的影响。
3 讨论
本文首先采用PB实验设计方法,筛选出了影响重组谷氨酸棒杆菌R102ΔmetX产苏氨酸发酵过程中的3个显著因素:葡萄糖、硫酸铵和酶解酪素。通过最陡爬坡接近最大响应区域后,建立了以苏氨酸浓度为响应值的二次回归方程模型,最终得到R102ΔmetX产苏氨酸的最优发酵条件为:葡萄糖50.78g/L,酵母粉6g/L,酶解酪素0.99g/L,生物素80μg/L,VB12 mg/L,CaCO320g/L,(NH4)2SO415.15g/L,MgSO4·7H2O 0.5g/L,KH2PO40.5g/L,K2HPO40.5g/L,FeSO4·7H2O 0.02g/L,MnSO4·7H2O 0.02g/L,接种量8%。在此条件下,实测苏氨酸浓度为3.35g/L,与预测值3.38g/L接近,说明预测模型可靠性较高,表明PB试验和响应面相结合的试验方法用于优化R102ΔmetX产苏氨酸发酵条件,不仅科学合理而且准确有效。
目前国内外利用谷氨酸棒杆菌发酵生产苏氨酸的产量普遍较低,2009年解晓鹏等通过诱变得到一株产苏氨酸的谷氨酸棒杆菌,其发酵产量为0.31g/L[9],Ramon等通过基因工程增强了1株谷氨酸棒杆菌产苏氨酸的能力,达到6g/L左右[10]。本试验仅仅对发酵培养基进行了优化,要进一步提高重组谷氨酸棒杆菌产苏氨酸的能力,还需还可以优化发酵条件,并通过基因工程方法进一步对该重组菌加以改造获得高产菌株。
[1]Vladimir G Debabov.The threonine story [J].Adv Biochem Eng Biotechnol,2003,79:113-l36.
[2]贾冬舒.苏氨酸市场现状及发展前景[J].饲料广角,2006(1):28-29.
[3]Jorn Kalinowski,Brigitte Bathe,Daniela Bartels,et al.The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production on of L-aspartate-derived amino acids and vitamins[J].J Biotechnol,2003,104:5-25.
[4]Bastian Blombach,Mark E.Schreiner,Matthias Moch,et al.Effect of pyruvate dehydrogenase complex deficiency on L-lysine production with Corynebacterium glutamicum[J].Appl Microbiol Biotechnol,2007,76:615-623.
[5]A Miller,R R Sitter.Using the folded-over 12-run Plachett-Burman design to consider interactions[J].Technometrics,2001,43(1):44-55.
[6]王普,孙立明,何军邀.响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基[J].生物工程学报,2009,25(6):863-868.
[7]赵世光,王诗然,薛正莲,等.Ganoderma lucidum UIM2281产漆酶发酵条件的筛选及响应面优化[J].食品与发酵工业,2009,35(11)72-77.
[8]解晓鹏,张力,杨晓志,等.L-苏氨酸产生菌的选育[J].安徽农业科学,2009,37(22):10 417-10 419.
[9]Ramon Diesveld,Nadine Tietze,Oliver Fürst,et al.Activity of Exporters of Escherichia coli in Corynebacterium glutamicum,and their Use to Increase L-Threonine Production[J].J Mol Microbiol Biotechnol,2009,16(34):198-207.
Medium Optimization Studies for Threonine Production by Recombinant Corynebacterium glutamicum Using Response Surface Methodology
Lv Yang-yong,Wu Zhan-hong,Zheng Sui-ping
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
The recombinant Corynebacterium glutamicum R102ΔmetX(R102 with deletion in the metX gene)was constructed.Fractional factorial design was used to evaluate the effects of medium components on the production of threonine.Glucose,yeast extract and enzymatic casein were the most important factors among twelve tested variables that influence the production of threonine.Based on the experimental results,the path of steepest ascent was undertaken to approach the optimal region of these factors.Central composite design and response surface analysis were subsequently employed for further optimization.The optimal medium for threonine synthesis was composed of:glucose 50.78g/L,yeast extract 6g/L,enzymatic casein 0.99g/L,biotin 80μg/L,VB12mg/L,CaCO320g/L,(NH4)2SO415.15g/L,MgSO4·7H2O 0.5g/L,KH2PO40.5g/L,K2HPO40.5g/L,FeSO4·7H2O 0.02g/L,MnSO4·7H2O 0.02g/L,inoculation quantity 8%。Under the optimum conditions,the threonine yield of the recombinant strain was 3.35g/L,which was 30%higher than the original medium components.
Corynebacterium glutamicum,L-threonine,response surface methodology,medium optimization
硕士研究生(郑穗平副教授为通讯作者)。
*国家科技支撑计划(2007BAK36B03),我国优势传统食品制造业关键技术研究与应用(谷氨酸发酵过程代谢流分析及菌种选育)项目资助。
2010-05-17,改回日期:2010-09-24

