酸法脱酰胺大米蛋白/葡聚糖体系微结构性质研究
刘永乐李向红易翠平华欲飞周素梅
(长沙理工大学食品科学省级重点学科预备学科1,长沙 410114)
(江南大学食品学院食品科学与技术国家重点实验室2,无锡 214122)
(中国农业科学院农产品加工研究所3,北京 100094)
酸法脱酰胺大米蛋白/葡聚糖体系微结构性质研究
刘永乐1李向红1易翠平1华欲飞2周素梅3
(长沙理工大学食品科学省级重点学科预备学科1,长沙 410114)
(江南大学食品学院食品科学与技术国家重点实验室2,无锡 214122)
(中国农业科学院农产品加工研究所3,北京 100094)
研究了酸法脱酰胺大米蛋白(ADRP)/葡聚糖混合体系的微观结构及流变性质。采用共聚焦激光扫描显微镜观察了ADRP/葡聚糖混合体系的微观结构,结果显示出ADRP之间产生了有效的交联,并且在蛋白质质量分数较高的混合体系中形成了蛋白质网状结构。流变仪观察了混合体系的动力学性质,黏度 -剪切速率曲线表明蛋白质交联程度较高的体系黏度增加明显,频率扫描结果进一步证实蛋白质质量分数较高的体系凝胶网络结构的形成;质构仪测试了此凝胶体系的强度,证实混合体系凝胶比单一ADRP的蛋白凝胶具有更高的破裂强度。ADRP和葡聚糖的相分离是混合体系中蛋白质网络结构形成的可能原因。
大米蛋白 酸法脱酰胺 微观结构 流变性质
目前,对相对廉价蛋白质资源的开发并提升其产品附加值的需求逐渐上升,越来越多的研究围绕着对不同植物蛋白资源的提取、表征及应用[1-3]。大米是世界上最重要的粮食资源之一,世界上 50%以上的人口以大米为主食,是大部分人口的能量及蛋白质来源[4]。大米中含蛋白质为 8%~13%[5],研究发现大米蛋白是谷物蛋白中营养价值较高的一种,具有无色、味道温和、必需氨基酸含量丰富、低过敏性及低胆固醇等特点[6],因此对大米蛋白的提取,特别是对碎米及大米淀粉副产物中大米蛋白的提取,可以显著提高其产品附加值;如果得到的蛋白产品具有较好的功能性质则更有利于其在食品加工中的应用。
大多数关于大米蛋白的文献都集中于研究大米蛋白的分离及表征[7-9],而对其应用的研究则很少。由于大米蛋白的低溶解度导致其在液态食品及饮料中的应用受到限制,低溶解度也会影响到蛋白的其他功能性质例如起泡性、乳化性及凝胶性等[10]。造成其低溶解度的主要原因是蛋白质中高含量的谷氨酰胺及天冬酰胺之间通过氢键等结合使蛋白质聚集沉淀,研究表明通过对蛋白质脱酰胺能改善其溶解度及其他功能性质[11],即使较低的脱酰胺度也可以导致蛋白质功能性质的显著改善[12]。已有研究发现(酸法和酶法)脱酰胺能显著改善小麦面筋蛋白、玉米醇溶蛋白等的溶解性[12-14]。易翠平等[15]采用酸法对大米蛋白脱酰胺也显著改善了其溶解度。
限制大米蛋白应用的另一方面原因是其凝胶后不能形成黏弹性网络结构[16],而黏弹性网络结构的形成对凝胶状食品及焙烤食品 (例如无面筋蛋白产品)的稳定性具有极其关键的作用[17]。一些食品科学家利用蛋白质和多糖的相互作用获得这种网络状结构,因为这两种生物分子间的相互作用对产品的宏观性质例如流动性、稳定性、质构及口感具有重要影响[18],通过合适的控制其相互作用可以设计出具有良好结构和质构的产品[19]。
本研究构造了酸法脱酰胺大米蛋白(ADRP)/葡聚糖的混合体系,表征了ADRP的分子结构,观察了混合体系的微观结构和动力学性质,以期改善大米蛋白的性质并拓宽其应用范围。
1 材料与方法
1.1 材料与仪器
碎米样品 (精白米副产物)由湖南金健米业提供,其含蛋白质为 7.8%(N×5.95,干基);葡聚糖、异硫氰酸酯(FITC)和氨试剂盒:Sigma公司。所有其他化学试剂均为分析纯。
TGL-16B高速台式离心机:上海安亭科学仪器厂;0.45μm醋酸纤维膜:德国Merck公司;ZETA-SIZER2000型 zeta电位仪:英国 Malvern公司;Agi2 lent1100高效液相色谱仪:美国安捷伦公司;TSK gel2000 S WXL柱:日本 TOSOH公司;Shodex K W804蛋白柱:日本 Shodex公司;Leica TCS 4D共聚焦激光扫描显微镜:德国 Leica Lasertechnik GmbH公司; AR1000流变仪:美国 TA公司;TA-XT Plus质构仪:英国 StableMicro Systems公司。
1.2 试验方法
1.2.1 大米粉的脱脂
大米粉采用正己烷在常温下 (25℃)浸提搅拌1 h,料液比为 1∶5,浆液真空过滤后滤饼在室温下自然干燥 48 h。干燥后的原料经碾磨后过 200目筛, 4℃下保藏。
1.2.2 酸法脱酰胺大米蛋白(ADRP)的制备
大米蛋白的提取工艺是在 Agboola等[20]的基础上进行了适当的改进。脱脂米粉按1∶5的料液比加入 0.05 mmol/L的NaOH溶液浸提,室温下搅拌 1 h,以10 000 r/min离心 30 min,弃去沉淀。上清液用2 mol/L的HCl溶液调节 pH值至 4.1~4.8,以10 000 r/min离心 30 min,弃去上清液,得到的蛋白质凝乳经水洗后冷冻干燥并在 4℃条件下保存。部分蛋白样品采用 0.38 mol/L的 HCl在 88.5℃反应3.5 h后迅速用冰浴冷却,冷却后的溶液用 2 mol/L的NaOH溶液调节至 pH 7.0,4℃透析 24 h后冷冻干燥。样品的脱酰胺度为脱酰胺之后释放的氨含量除以样品中总的酰胺氮含量,其中脱酰胺之后样品释放的氨含量用氨试剂盒检测,总酰胺氮含量是通过检测初始大米蛋白样品用 3 mol/L的 HCl在 110℃处理 3 h后释放的氨含量获得[15]。
采用本试验中的脱酰胺条件获得的ADRP其脱酰胺度达到 49.76%,溶解度增加至81.24%,而蛋白质水解度仅为 9.12%(甲醛滴定法测得)。
1.2.3 混合体系的制备
ADRP粉末分散于去离子水中使其质量分数为20%并磁力搅拌 1 h,分散溶液在 10 000 r/min离心15 min后上清液过 0.45μm的醋酸纤维素膜以除去任何不溶性物质,采用 zeta电位仪和体积排阻色谱(SEC-HPLC)表征 ADRP和初始大米蛋白的分子结构。
制备葡聚糖溶液时直接将葡聚糖粉末(Mw 2000 ku)分散于去离子水中,在室温下搅拌 1 h,pH值调至 7.0后过 0.45μm的醋酸纤维素膜以除去任何不溶性物质。
ADRP/葡聚糖混合体系的制备是将不同质量分数配比的ADRP/葡聚糖混合体系 (蛋白质质量分数1%~6%,多糖质量分数 1%~3%,离子浓度 0.5 mol/L)充分搅拌 1 h后置于具塞试管中,加入叠氮钠以防止微生物的生长,将具塞试管密封后放置在25℃的水浴中 24 h。凝胶的形成是通过直接观察混合体系得到,一种混合体系转变成固态时被认为形成了凝胶[21]。
1.2.4 Zeta电位及分子质量分布分析
ADRP及初始大米蛋白样品的 zeta电位由 zeta电位仪测得,5次测定的平均值报告为 zeta电位。
蛋白样品的分子质量分布由 SEC-HPLC测得, ADRP使用 TSK gel2000S WXL柱,流动相为50 mmol/L的磷酸盐缓冲液 (pH 7.0);由于初始大米蛋白样品的分子质量较大,因此采用 Shodex K W-804蛋白柱分析初始大米蛋白样品的分子质量分布,流动相为 3.5%的 SDS,因为初始大米蛋白不溶于50 mmol/L的磷酸盐缓冲液 (pH 7.0)中,检测中洗脱速率均为 1 mL/min,洗脱液在 220 nm处检测,柱温为25℃。
1.2.5 混合体系微观结构观察
在显微观察前,先用溶于二甲基亚砜中的 2%的FITC对蛋白质进行标记,标记量是每 100 mL蛋白溶液加入 25μL的 FITC并用磁力搅拌器搅拌90 min[22]。混合物的配制是将 ADRP与葡聚糖混合,配制成蛋白质质量分数 1%、4.5%和 6%、多糖质量分数 3%的混合物。取少量混合物滴在载玻片上,并用盖玻片小心密封,以防气泡产生。制好的玻片用CLS M观察,Ar/Kr激光发生器发射波长确定为485 nm。
1.2.6 体系流变性质的测定
将配制好的样品加于流变仪底部平板上,选择直径 40 mm、0°的平板并设定狭缝距离为 1 mm,让板间完全充满样品,平板顶部涂上一薄层硅油以防止样品水分蒸发,测定温度恒定为(25±0.1)℃。
黏度 -剪切速率:固定应变 1%,剪切速率为0到100 s-1,测定整个过程样品的黏度随频率的变化曲线。将单一葡聚糖溶液(3%)、单一的ADRP溶液(6%,离子浓度 0.5 mol/L)及混合物(蛋白质质量分数1%、4.5%、6%,多糖质量分数 3%,离子浓度 0.5 mol/L)搅拌均匀后以 1 000 r/min离心 5 min去除存在的气泡后进行分析。
应变扫描:固定频率 1 Hz,应变从 0.1%到10%,测定随着应变的变化,混合物 (蛋白质质量分数1%、4.5%、6%,多糖质量分数 3%以及离子浓度0.5 mol/L)动态模量 (G′,储能模量;G″,损耗模量)等参数的变化获得各体系的线性黏弹性范围。
频率扫描:固定应变 0.5%,扫描频率从 0.1到100 Hz,测定体系中 G′和 G″的变化。
1.2.7 混合体系质构性质的测定
用质构仪测定混合物凝胶 (蛋白质质量分数6%,多糖质量分数 3%,离子浓度 0.5 mol/L)及单一ADRP凝胶(蛋白质质量分数 18.5%,离子浓度 0.5 mol/L)的强度,选用直径为 10 mm的圆柱状平头探头,设定前进速度:2 mm/s,冲压速度:1 mm/s;后撤速度:2 mm/s,冲压深度:10 mm;制备 3个平行样品,重复测定过程取平均值得到凝胶质构参数。
2 结果与分析
2.1 ADRP的表征结果
Wu等[13]及 Chan等[23]分别研究发现酸溶解的小麦面筋蛋白及酸法脱酰胺的大豆蛋白的分子质量和表面电位与其功能性质相关,同时也影响到蛋白质和多糖混合体系的性质。
初始大米蛋白样品的 zeta电位是 (-29.5±2.5) mV,本研究条件下获得的ADRP(脱酰胺度49.76%)其zeta电位增加至 (-43.8±1.6)mV,溶解度增加至81.24%。脱酰胺使得谷氨酰胺和天冬酰胺中的酰胺基转变成羧基,这种羧化作用减少了分子内氢键,分子上负电荷增加,静电排斥作用增强,从而导致了脱酰胺蛋白质溶解度的增加[12]。
初始大米蛋白样品及ADRP在220 nm下的分子质量分布曲线见图 1。初始大米蛋白样品的 SECHPLC曲线(图 1a)表明样品中有大约 71.23%的蛋白质分子其分子质量大于 1 000 ku,这一部分对应于谷蛋白中高分子质量聚集体部分;另外超过 20%的部分分子质量约为 19.8 ku,由低分子质量部分组成,包括清蛋白、球蛋白及醇溶蛋白[9]。ADRP的结果 (图 1b)表明样品中主要由分子质量为 20.14和 10.882 ku的分子组成,其总含量达到 91.58%。从 SEC-HPLC的分析结果可知,大米蛋白的酸法脱酰胺以及肽键的轻度水解导致了蛋白质分子的解聚,溶解度增加。
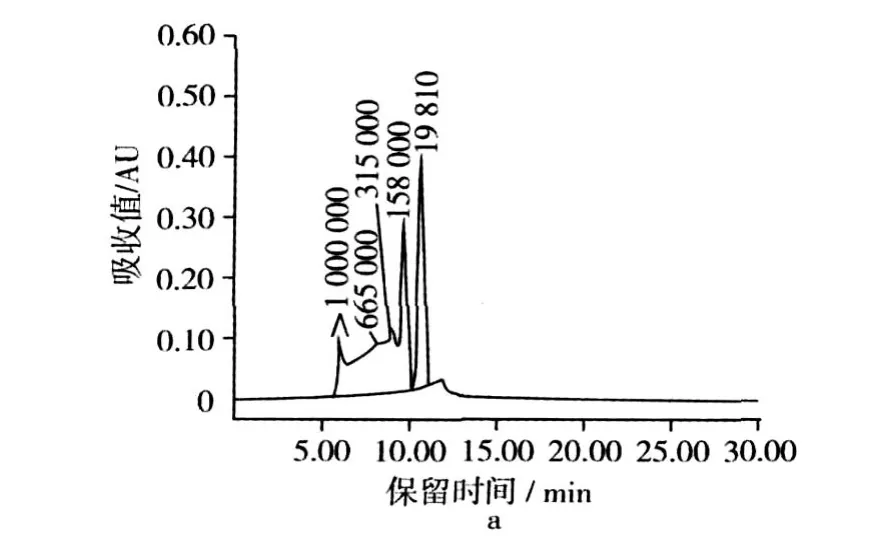

图1 初始大米蛋白及ADRP的分子质量分布
2.2 混合体系的微观结构
ADRP/葡聚糖混合体系的 CLS M图见图 2。图2a为蛋白质质量分数 1%与葡聚糖质量分数 3%混合后形成的均相体系的微观结构,图中白色区域代表 FITC标记的区域,荧光区域均匀的分布在整个体系中;而蛋白质量分数为 4.5%及 6%,多糖质量分数为 3%的混合体系的 CLS M图 (图 2b和图 2c)中,蛋白富集区域在图中清晰可见,黑色区域即为多糖所在的区域,两种生物大分子组分分布在分开的两相中。其 CLS M图也揭示了混合体系中蛋白质组分的相互交联,蛋白质质量分数增加,交联程度更加显著,在蛋白质质量分数为 6%的混合体系中,蛋白质组分相互交联形成了网络状结构,在宏观下观察时,此混合物在如此低的蛋白质质量分数下转变成了均匀黏稠的凝胶。由于葡聚糖不能形成凝胶,大米蛋白不能构成黏弹性网状结构,因此可能的原因是系统中葡聚糖的存在使得葡聚糖相截留了大量的水分,导致蛋白质相的浓缩;同时伴随着凝胶的形成,聚合物构象的改变使得溶剂在两相间重新分配[24]。Morris等[25]及 Mounsey等[26]认为是一种排除效应导致了每一组分的有效质量分数增加,以致多维结构的凝胶形成;他们同时指出这是一种被“捕获”了的相分离,即达到宏观相分离之前,整个体系已经转变成微相分离的凝胶,而这种微相分离的结构也是构成食品质构的基础。在实际食品结构的构造中,例如色拉调味料的生产时,可以利用这种机理生产出具有独特连续性质构的产品[27]。

图 2 ADRP/葡聚糖混合体系(离子浓度 0.5 mol/L)的CLS M图像
2.3 流变性质
2.3.1 剪切速率 -黏度曲线
图 3是ADRP、葡聚糖及其混合体系的黏度/剪切速率变化曲线,混合体系包含了均相区域的体系及相分离体系。所有的体系在较大的剪切速率范围内,显示剪切变稀的性质,即假塑性流体。体系之所以呈现假塑性是因为分子定向排列(在外力作用下,分子从无序到有序移动);葡聚糖溶液这种高分子溶液也属于假塑性流体。对混合体系来说,随着 ADRP质量分数的增加,流变行为虽然相似,但是,体系的黏度值增加;由于 1%ADRP/3%葡聚糖混合物是均相体系,因此呈现出较小的黏度值,而其他两种混合物其黏度值明显增加,这是因为组成混合物连续相的生物大分子组分受到相分离的影响而使得黏度值增加,相分离表现出对黏度值的增效性[28]。
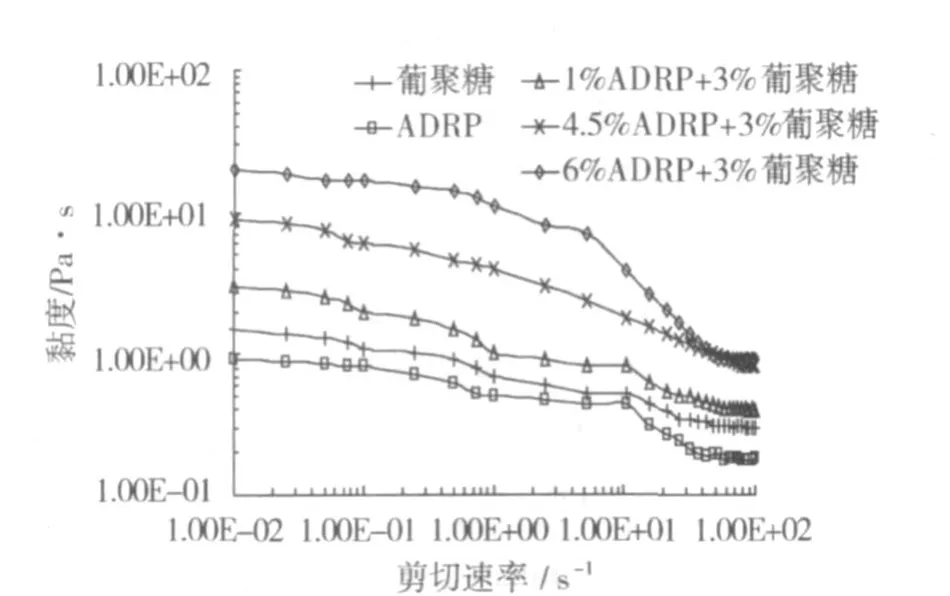
图 3 单一ADRP(6%、离子浓度 0.5 mol/L)、葡聚糖(3%)及ADRP/葡聚糖混合体系的剪切速率 -黏度曲线
2.3.2 应变扫描
图 4a和图 4b是流变仪测得的 ADRP/葡聚糖混合物(蛋白质质量分数分别为 1%、4.5%和 6%,多糖质量分数 3%,离子浓度 0.5 mol/L)随着应变的变化,动态模量 (G′,G″)的变化情况。从图 4中可以看出,应变小于 1%时,三种混合物的 G′和 G″值均基本保持恒定,表现出与应变无关;随着应变值进一步增加时,两者逐渐降低。因此,对所有混合体系来说,其线性黏弹性区域为应变值小于 1%的范围内,在本研究后续的频率扫描时设定应变值为0.5%。
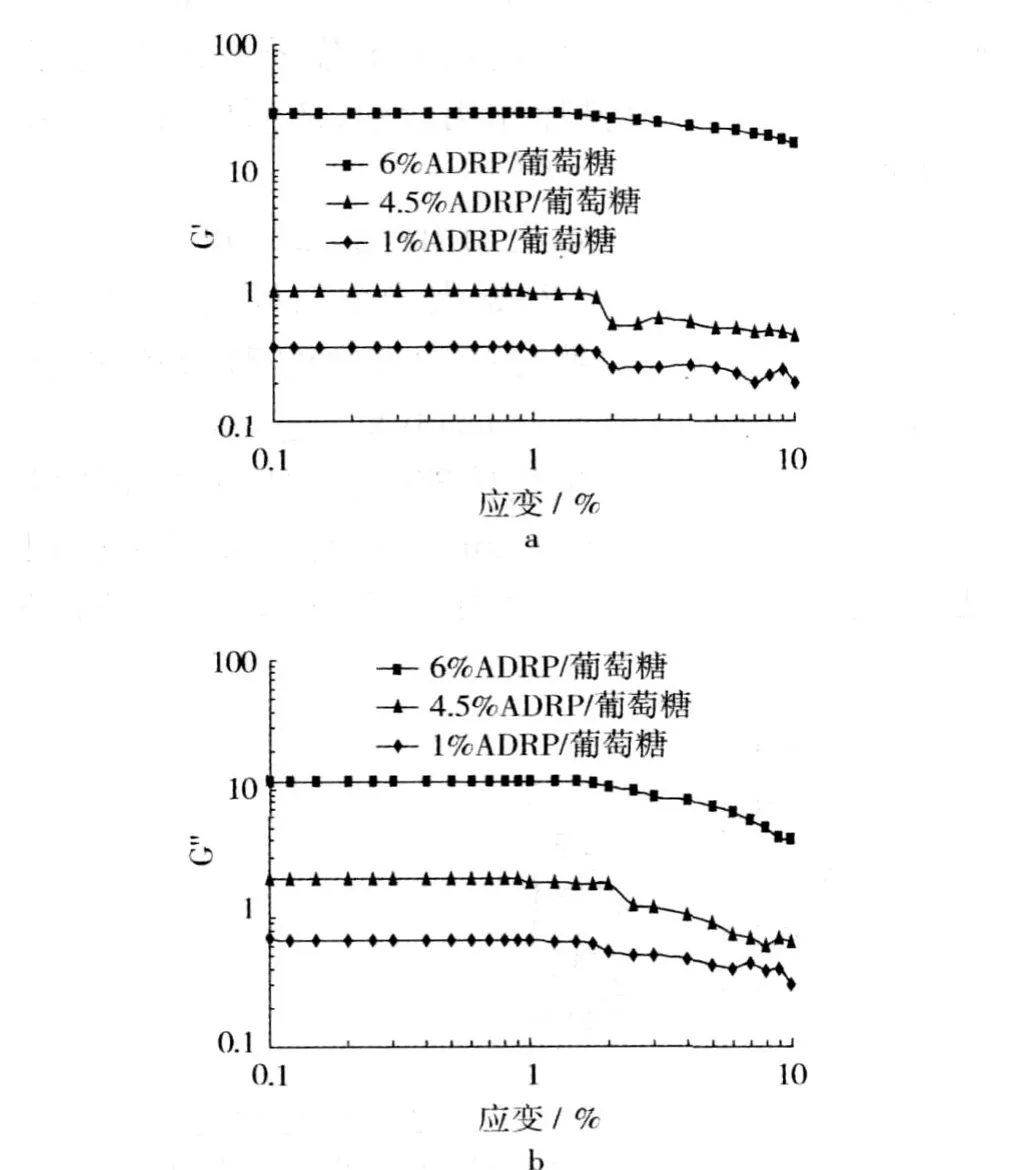
图 4 ADRP/葡聚糖混合体系(离子浓度 0.5 mol/L)的应变扫描结果
2.3.3 频率扫描
采用频率扫描来进一步表征混合体系是否形成凝胶(图 5)。对于一种典型的凝胶来说,在整个频率范围内,G′和 G″值表现出与频率无关,且 G′值始终大于 G″[28]。从图 5可以看出,6%ADRP/葡聚糖混合体系的 G′和 G″曲线相互平行且 G′>G″,在频率从0.1变化到 100 Hz时,G′和 G″的值基本上不随频率的变化而变化,进一步说明体系形成了凝胶;而 1%ADRP/葡聚糖混合体系,其 G′值始终小于 G″,体系表现出流体性质;4.5%ADRP/葡聚糖混合体系的 G′和 G″的曲线发生交叉,表明该样品中蛋白质的交联很弱,处于半流体状态,当振荡频率低时可以响应而流动,呈现液体性质,而振荡频率高时,由于蛋白质体系的迟滞阻力表现出抗力,呈现固体性质,与 CLS M观察结果一致。
研究中发现,对于单一的ADRP来说,pH值 6.5~8.0的范围内,蛋白质质量分数需要达到 16.5%~20%体系才能形成凝胶。而构造的ADRP/葡聚糖混合体系在如此低的蛋白质质量分数下就可以形成凝胶,对拓宽其在实际食品中的应用具有一定的意义。

图 5 ADRP/葡聚糖混合体系(离子浓度 0.5 mol/L)的频率扫描结果
2.4 质构性质
表1列出了ADRP凝胶(蛋白质质量分数18.5%,离子浓度0.5 mol/L)和 6%ADRP/葡聚糖混合体系的质构性质,尽管后者的蛋白质质量分数远低于前者,其凝胶硬度和黏着性反而更高,其质构性质的差异也表明了体系微观结构的差异,前者没有形成蛋白质的网络结构是其硬度和黏着性更低的原因。

表1 ADRP和ADRP/葡聚糖凝胶体系的质构性质分析
3 结论
研究了ADRP和葡聚糖混合体系的微观结构和流变性质,大米蛋白的脱酰胺使得蛋白分子 zeta电位的增加和分子质量的下降,导致蛋白质溶解度的增加。CLS M观察到混合体系中 ADRP之间的有效交联,蛋白质质量分数较高时形成了蛋白质的网络结构;黏度 -剪切速率曲线表明蛋白质交联程度较高的体系黏度增加明显,频率扫描结果进一步证实此体系凝胶结构的形成;质构仪测试了此凝胶体系的强度,证实混合体系凝胶比单一ADRP的蛋白凝胶具有更高的破裂强度。ADRP和葡聚糖的相分离和/或溶剂在两相间的重新分布是混合体系中蛋白质粘弹性网络结构形成的可能原因。
[1]Gorinstein S,Pawelzlk E,Licon E D,et al.Characterization of pseudo cereal and cereal proteins by protein and amino acid analyses[J].Journal of the Science of Food and Agri2 culture,2002,82:886-891
[2]RangelA,Domont GB,Pedrosa C,et al.Functionalproper2 ties of purified vicilins from cowpea(Vigna unguiculata)and Pea(Pisum sativum)and cowpea protein isolate[J].Journal ofAgricultural and Food Chemistry,2003,51:5792-5797 [3]Tomotake H,Shimaoka I,Kayashita J,et al.Physicochemi2 cal and functional properties of buckwheat protein product [J].Journal ofAgricultural and Food Chemistry,2002,50: 2125-2129
[4]Kato T,Katayama E,Matsubara S,et al.Release of aller2 genic proteins from rice grains induced by high hydrostatic pressure[J].Journal of Agricultural Food Chemistry,2000, 48:3124-3129
[5]Nakase M,Hotta H,Adachi T,et al.Cloning of the rice seed alpha-globulin encoding gene:sequence similarity of the 5 flanking region to those of the genes encoding wheat high molecular weight glutenin and barley D hordein[J]. Gene,1996,170:223-226
[6]Chrastil J.Correlations between the physicochemical and functional properties of rice[J].Journal of Agricultural and Food Chemistry,1992,40:1683-1686
[7]Ellepola SW,Choi SM,PhillipsD L,et al.Raman spectro2 scopic study of rice globulin[J].Journal of Cereal Science, 2006,43:85-93
[8]Juliano B O.Polysaccharides,proteins,and lipids of rice [M]//Juliano B O.Rice:Chemistry and Technology,sec2 ond.St.Paul:American Association of Cereal Chemists, 1985:59-174
[9]Van DerBorght A,Vandeputte G E,Derycke V,et al.Ex2 tractability and chromatographic separation of rice endosperm proteins[J].Journal of Cereal Science,2006,44:68-74
[10]Vojdani F.Solubility[M]//Hall G M.Methods of Testing Protein Functionality.London:Blackie Academic and Pro2 fessional,1996:11-60
[11]Hamada J S.Effects of heat and proteolysis on deamidation of food proteins using peptidoglutaminase[J].Journal of Agricultural and Food Chemistry,1992,40:719-723
[12]Matsudomi N,Sasaki T,Kato A,et al.Conformational changes and functionalproperties of acid-modified soy pro2 tein[J].Agricultural&Biological Chemistry,1985,49: 1251-1256
[13]Wu C H,Nakai S,PowrieW D.Preparation and properties of acid-solubilized gluten[J].Journal of Agriculture and Food Chemistry,1976,24:504-510
[14]Yong Y H,Yamaguchi S,Matsumura Y.Effectsof enzymat2 ic deamidation by protein-glutaminase on structure and functionalpropertiesofwheat gluten[J].JournalofAgricul2 tural and Food Chemistry,2006,54:6034-6040
[15]易翠平.大米高纯度蛋白和淀粉联产工艺与蛋白改性研究 [D].无锡:江南大学,2005
[16]Marco C,Rosell CM.Effectof different protein isolates and transglutaminase on rice flour properties[J].Journal of Food Engineering,2008,84:132-139
[17]MooreM,Schobber T,Dockery P,et al.Textural compari2 sons of gluten free and wheat based dough batters and breads[J].Cereal Chemistry,2004,81:567-575
[18]Ravindra P,GenoveseD B,Foegeding EA,et al.Rheology of heated whey protein isolate/cross-linked starch disper2 sions[J].Food Hydrocolloids,2004,18:775-781
[19]Norton I T,Frith W J.Microstructure design in mixed bio2 polymer composites[J].Food Hydrocolloids,2001,15: 543-553
[20]Agboola S,Ng D,Mills D.Characterization and functional properties ofAustralian rice protein isolates[J].Journal of Cereal Science,2005,41:283-290
[21]Zhang G Y,Foegeding E A.Heat-induced phase behavior ofβ -lactoglobulin/polysaccharide mixtures[J].Food Hydrocolloids,2003,17:785-792
[22]Donato L,Garnier C,NovalesB,et al.Gelation of globular protein in presence of low methoxyl pectin:effect of Na+and/or Ca2+ions on rheology and microstructure of the sys2 tems[J].Food Hydrocolloids,2005,19:549-556
[23]Chan W M,Ma C Y.Acid modification of proteins from soymilk(okara)[J].Food Research International,1999, 32:119-127
[24]Dickinson E,McClements D J.Protein-polysaccharide in2 teractions[M]//Dickinson E,McClements D J.Advances in food colloids.London:Blackie Academic&Professional, 1995:81-101
[25]Morris E R.Mixed polymer gels[M]//Harris P.Food gels. London:ElsevierApplied Science,1991:291-359
[26]Mounsey J S,OπRiordan E D.Influence of pre-gelatinized maize starch on the rheology,microstructure and processing of imitation cheese[J].Journalof Food Engineering,2008, 84:57-64
[27]De Kruif,C G,Tuinier R.Polysaccharide protein interac2 tions[J].Food Hydrocolloids,2001,15:555-563
[28]Musampa R M,Alves M M,Maia J M.Phase separation, rheology and microstructure of pea protein-kappa-carrag2 eenan mixtures[J].Food Hydrocolloids,2007,21:92-99.
Microstructure Properties ofMixtures of Acid-Deamidated Rice Protein and Dextran
Liu Yongle1Li Xianghong1Yi Cuiping1Hua Yufei2Zhou Sumei3
(Pre-Key Subject of Food Science,Changsha University of Science&Technology1,Changsha 410114)
(State KeyLaboratory of Food Science and Technology,School of Food Science and Technology, Jiangnan University2,Wuxi 214122)
(Institute ofAgro-Food Science and technology,The Chinese Academy ofAgricultural Sciences3,Beijing 100094)
The microstructure and rheological properties ofmixtures of acid-deamidated rice protein(ADRP) and dextran were studied.The microstructuresofwere described using confocal laser scanningmicroscopy(CLS M).It is revealed in results that effective association occurs between ADRPs and a protein net work-like structure is formed in the mixture with higher protein concentration.Mechanical properties of the mixtures were observed by rheometer.The steady shearmeasurements show a correlation of the CLS M results via a marked increase in the viscosity of the mixtureswith protein association.Frequency sweeps furtherprove the build-up of the gelled network-like structure. The differences in fracture forces observed by texturalmeasurements between mixture and single ADRP gel also sug2 gest the difference in microstructures.The for mation of the network-like structure appears to have occurred through a phase separation ofADRP and dextran.
rice protein,acid-deamidation,microstructure,rheology
TS201.2+1 文献标识码:A 文章编号:1003-0174(2010)10-0001-07
863计划(2008AA100801)
2009-10-20
刘永乐,男,1962年出生,教授,博士,农产品深加工及食品生物技术

