盐对甲醇微观结构的影响
余小春 林 珂 胡乃银 周晓国 刘世林
(中国科学技术大学化学物理系,合肥微尺度物质科学国家实验室(筹),合肥 230026)
盐对甲醇微观结构的影响
余小春 林 珂 胡乃银 周晓国 刘世林*
(中国科学技术大学化学物理系,合肥微尺度物质科学国家实验室(筹),合肥 230026)
利用拉曼光谱研究盐对甲醇微观结构的影响.比较了不同盐/甲醇体系的O—H伸缩谱段和C—O伸缩谱段的超额拉曼光谱,对比给出了阴、阳离子与甲醇的相互作用.O—H伸缩谱段的超额拉曼光谱明显地显示了阴离子与甲醇形成弱氢键,氢键强度排序为CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH,在这个波段内,基本观察不到阳离子与甲醇的相互作用.在C—O伸缩谱段内,阴阳离子均有显著的体现,且与它们作用的甲醇C—O伸缩振动频率有如下的关系:CH3—OH(阴离子)<CH3—OH(体相)<CH3—OH(阳离子).根据C—O伸缩谱段的超额拉曼光谱,拟合了该谱段的拉曼光谱,由分解的谱峰强度得到阴、阳离子第一溶剂化层中甲醇分子的数目,结果显示在该浓度(~0.005)下离子对第一溶剂化层以外的甲醇氢键网络结构没有明显影响.
拉曼光谱; 阴离子; 阳离子; 甲醇; 第一溶剂化层
盐溶液在科学和技术领域有着重要的作用[1-2],其中非水介质的溶液由于在电池等领域有着很好的应用前景,它们的溶剂化结构和性质引起了化学家广泛的兴趣.理解盐溶液的微观结构可以帮助理解其宏观性质,也可以帮助合理地利用盐溶液.对于各种非水溶液中的宏观性质、微观相互作用、微观结构及它们的联系,前人有大量的研究.在非水溶剂中,醇由于其独特的氢键网络结构,备受人们关注[3-9].
有大量的技术被用于研究盐溶液结构,例如红外/拉曼光谱、X射线衍射、中子衍射、分子模拟、从头计算等方法.其中很多的工作都是利用拉曼光谱,因拉曼光谱可以研究阴离子对醇氢键网络结构的影响[3-8],例如Yamauchi等测量了LiCl/乙醇溶液[3]和LiX(X=Cl-、Br-、I-)/甲醇溶液的拉曼光谱[4],认为Cl-与乙醇形成氢键时,其O—H伸缩频率为3373 cm-1, Cl-与甲醇形成氢键时其 O—H伸缩频率为3385 cm-1,该甲醇分子同时与Li+结合时其O—H伸缩频率为3300 cm-1.Kanno等[5]利用LiX/甲醇的拉曼光谱提出卤代锂破坏甲醇氢键结构程度的顺序为: LiCl<LiBr<LiI.Honshoh等[6]研究了Cl-与一系列醇的相互作用,他们发现与Cl-形成氢键的醇的O—H伸缩频率会随着醇的烷基基团增大而向低波数移动,并认为这种移动是由烷基的质量而不是氢键强度引起的.除了这些卤素阴离子,还有其它的阴离子也有讨论,例如Kanno等[7]提到了ClO-4能破坏醇的氢键网络结构,同时在ClO-4离子周边形成新的氢键网络结构.Hidaka等[8]进一步利用拉曼光谱比较了几种阴离子对甲醇、乙醇微观结构的破坏程度,认为该破坏程度的顺序为:CH3COO-<Cl-<Br-<I-<ClO-4.他们都没有利用拉曼光谱给出这些阴离子第一溶剂化层中醇分子的数目,而这个数目是大家尤为关心的内容.
相对阴离子而言,阳离子对氢键网络结构的影响很难使用拉曼光谱研究,所以常利用其它技术讨论阳离子与醇的相互作用.例如Symons等[10]通过红外(IR)和核磁共振(NMR)的关系提出Li+、Na+、Mg2+周围结合甲醇分子的数目分别为4、(5±1)、6. Mochizuki等[11]通过飞行时间(TOF)质谱提出Li+周围结合1-3个甲醇分子,并认为当加入相反电荷的离子时,Li+周围的甲醇分子数会减少.除了这些实验方法,理论计算也被用于讨论阳离子与醇的相互作用.Jorgensen等[12]利用蒙特卡罗模拟提出每个Na+结合6个甲醇分子.ImPey[13]和Pagliai[14]等利用分子动力学模拟方法确定了Li+周围结合甲醇分子的数目是4.Torii[15]利用从头量子化学计算的方法也认为Li+结合甲醇分子的数目是4.
拉曼光谱作为无破坏性的技术手段,被广泛用于讨论各种液体的微观结构.最近我们组[16]利用拉曼光谱研究了甲醇的微观结构,认为3-5个甲醇分子通过氢键缔合形成链状或者环状结构构成液体甲醇.在本文中,我们同样利用拉曼光谱来研究阴、阳离子对甲醇微观结构的影响.由于甲醇O—H伸缩谱段的拉曼光谱主要反映阴离子与甲醇的相互作用[3-4],因此我们还利用甲醇的C—O伸缩谱段来讨论阳离子与甲醇的相互作用,这段光谱同样也被广泛地用于讨论甲醇的氢键结构[17-19].这里我们主要关心离子与甲醇的相互作用,所以必须排除溶液中离子与离子的相互作用,在较高浓度的溶液中才有各种离子对[20-21],如溶剂分隔的离子对,直接接触的离子对,离子对的多聚体,所以溶液的浓度必须足够小,但是浓度很低时,测得的信号主要反映的是体相甲醇,较少体现离子与甲醇的相互作用,这样就很难通过直接分析拉曼光谱来了解离子对甲醇微观结构的影响.这里采用了超额光谱[22-25]这一手段来分析测量的拉曼光谱.通过超额光谱分析了离子与甲醇的相互作用,并利用C—O伸缩谱段的拉曼光谱得到了阴、阳离子第一溶剂化层中甲醇分子的数目.
1 实验方法
甲醇(>99.8%,上海振兴化学公司)没有进一步纯化直接使用.无水LiClO4(>99%,Sigma Aldrich)、NaClO4(>98%,Sigma Aldrich)、Mg(ClO4)2·6H2O(>99%,SigmaAldrich)、LiNO3(>98%,上海恒信化工厂)、LiCl(>97%,嘉善巨枫化工厂)、NaCl(>99.5%,国药集团化学试剂有限公司),这些盐在使用前(除了LiClO4),均在真空干燥箱内加热24 h,温度恒定为373.15-393.15 K,以去除盐中少量的水分,而后储存在干燥箱中备用.
研究的盐溶液是 LiClO4、NaClO4、Mg(ClO4)2、LiCl、NaCl、LiNO3的甲醇溶液.为了避免溶液中形成离子对,盐的摩尔分数均约为0.005.对于Mg(ClO4)2的甲醇溶液,为了保持其阴离子浓度与其它盐溶液一致,其摩尔分数约为0.0025.
拉曼光谱测量采用背向散射,实验具体细节详见文献[16,26-27],以半导体固体激光器(Coherent, VerdI-5W,USA)产生的532 nm连续激光为光源,其偏振方向由格兰棱镜和λ/2波片调整为垂直于散射平面,并由焦距f=5 cm的石英透镜聚焦于比色皿内的样品.拉曼散射光经由焦距f=5 cm和f=20 cm的石英透镜组收集、退偏器退偏并成像会聚于三级联动单色仪(Princeton Instruments,Acton TriplePro,USA),最后由液氮冷却的电荷耦合元件(CCD)(PrincetonInstruments,Spec-10:100B,USA)记录数据.拉曼光谱位移均经汞原子的标准线校准.比色皿置于恒温槽中,且保持温度为25(±1)℃.我们测量了这些溶液的O—H伸缩谱段(3000-3700 cm-1)和C—O伸缩谱段(980-1100 cm-1)的拉曼光谱.
2 结果与讨论
2.1 实验光谱
我们测量了纯甲醇和盐/甲醇溶液的O—H和C—O伸缩谱段的拉曼光谱.图1给出了纯甲醇及LiClO4/甲醇溶液的拉曼光谱.由于盐的浓度非常小,所以盐/甲醇溶液的光谱和纯甲醇的光谱非常相似,但是也可以看出一些差别,例如LiClO4/甲醇溶液的O—H伸缩振动谱峰在低波数(~3300 cm-1)的强度比纯甲醇的要略弱(图1(a)),这意味着由于离子与甲醇的相互作用,使得LiClO4/甲醇溶液中体相甲醇会减少,而在高波数(~3540 cm-1)LiClO4/甲醇溶液的光谱强度比纯甲醇的要略强,这表明了LiClO4/甲醇溶液中有某些成分增加,体现了离子与甲醇的相互作用.在C—O伸缩谱段的拉曼光谱(图1(b))中,主要体现了甲醇信号的减弱,这也是由于离子与甲醇的相互作用使得体相甲醇减少.这些谱图的差别都很小,所以很难从谱图中直接看出与离子直接相互作用的甲醇信号.之前,利用拉曼光谱讨论离子与醇的相互作用时其盐/醇溶液的浓度都比较高[3-8],所以他们测量的光谱信号中体现了大量的离子与醇的相互作用,可以直接使用测量的谱图来讨论相互作用,但是浓度较高时会出现各种离子对,这会对研究离子与醇的相互作用带来影响,所以我们这里采用的浓度非常小(~0.005),此时不能直接利用测量的拉曼光谱来讨论离子与甲醇的相互作用,下面我们将使用超额拉曼光谱的分析手段来讨论离子与甲醇的相互作用.
2.2 超额拉曼光谱
图1表明很难直接使用拉曼光谱来讨论离子对甲醇结构的影响,所以必须使用特殊的方法来处理实验谱图.Yu等[22-25]首次提出了超额光谱来处理他们的红外光谱,并且指出超额光谱有着很多的优点,例如超额光谱能有效地提高光谱分辨率.这里我们将类似地使用超额光谱处理我们的拉曼光谱.超额拉曼光谱是指实际测量所得的拉曼光谱与把混合物当作理想混合时应该具有的理想拉曼光谱的差别:

其中IE(ν)是超额拉曼光谱强度,Ireal(ν)是直接测量所得的拉曼光谱强度,Iideal(ν)是把溶液当成理想混合时的拉曼光谱强度,即:

其中An是溶液中成分n的系数,In,pure是成分n为纯净物时的拉曼光谱强度.
由于拉曼光谱强度正比于物质的量(Nn)和其相应振动的拉曼散射截面(σn):

其中k是比例系数,与物质无关.
所以理想混溶时的拉曼光谱强度可以表达为:
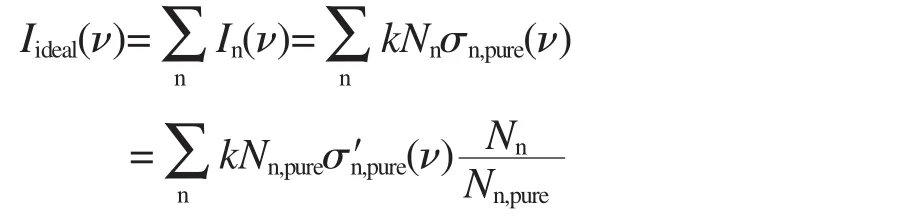

图1 甲醇和盐/甲醇溶液的拉曼光谱Fig.1 Raman spectra of pure methanol and salt/methanol solution(a)Raman spectra in the O—H stretching region of pure methanol(solid line)and LiClO4/CH3OH(dashed line);(b)Raman spectra in the C—O stretching region of pure methanol(solid line)and LiClO4/CH3OH(dashed line).The mole fraction of LiClO4is~0.005.

这里的Nn和Nn,pure是在相同体积下物质的量.故计算理想混溶时的拉曼光谱的系数An为:

由溶液的摩尔分数(χn)和密度(ρ)可以计算出Nn:
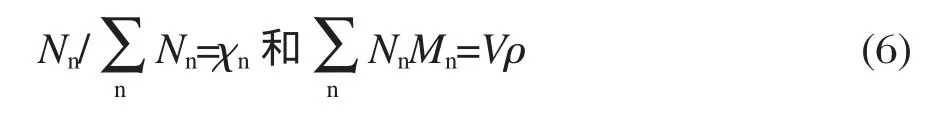
其中V是溶液的体积,M是物质的摩尔质量,χ是物质的摩尔分数 由式(5)和(6)可以计算得到理想拉曼光谱的系数,对于两物质组成的混合溶液的理想拉曼光谱为:
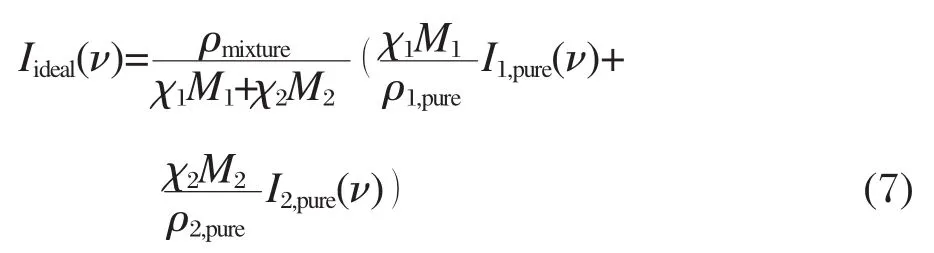
在本实验中,由于盐在甲醇的C—O伸缩谱段和O—H伸缩谱段都没有贡献,故超额拉曼光谱可以表示为:

这里ρmixture是盐/甲醇溶液的密度,我们使用的密度取自于文献[28-32].超额拉曼光谱中会出现正峰和负峰,正峰表示实际体系相对理想体系增加的成分,在这里代表与离子相互作用的甲醇,而负峰则是实际体系相对理想体系减少的成分,在这里表示由于离子和甲醇相互作用而减少的体相甲醇.
2.3 阴、阳离子对甲醇O—H伸缩振动的影响
对于氢键体系,最常利用的振动谱段是O—H伸缩振动谱段,这里我们先讨论这个区间的拉曼光谱.图2展示了NaCl、NaClO4、LiNO3、LiClO4甲醇溶液(χ~0.005)的O—H伸缩谱段的超额拉曼光谱,其中有着明显的正峰和负峰.负峰表示减少的体相甲醇,因为在这些盐的甲醇溶液中存在离子与甲醇的相互作用,这些相互作用会使得体相甲醇减少,而正峰表示与离子相互作用的甲醇.为了判断正峰是阳离子还是阴离子周围的甲醇,我们做了下面的对比实验.首先保证溶液中的阳离子都是Na+,而阴离子分别是Cl-和ClO-4(图2(a)),很自然的,在超额拉曼光谱中它们不一样的地方就表示了阴离子周围甲醇的贡献,由图2(a)可以看出正峰的面积和位置明显不一样,所以我们可以判定正峰是与阴离子相互作用的甲醇,阴离子与甲醇通过氢键结合在一起,并且它们的氢键强度要弱于体相甲醇之间的氢键强度,这就导致了阴离子周围的甲醇O—H伸缩振动位于高波数.通过超额拉曼光谱我们可以给出阴离子周围甲醇的O—H伸缩振动频率,例如与Cl-相互作用的甲醇O—H伸缩振动位于~3400 cm-1(图2(a)),这与Yamauchi等[4]的结果是相似的,他们认为甲醇与Cl-形成氢键时O—H伸缩振动频率为3385 cm-1,这里的超额拉曼光谱指出与ClO-4形成氢键的甲醇O—H伸缩振动位于~3540 cm-1,这和Kanno等[7]的结果是一致的,他们在研究LiClO4/甲醇玻璃态的拉曼光谱时提到ClO-4与甲醇形成氢键时O—H伸缩振动频率是~3530 cm-1.我们还对比了LiClO4和LiNO3甲醇溶液的超额拉曼光谱(图2(b)),很明显地看出与NO-3相互作用的甲醇O—H伸缩振动位于~3480 cm-1.由这些甲醇的O—H振动频率可以看出阴离子与甲醇的相互作用强度有下面的顺序: CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH,这与Hidaka等[8]的结论是一致的,他们同样观察到了类似的频率关系,他们认为与ClO-4相互作用的甲醇O—H伸缩振动偏离体相甲醇的O—H伸缩振动最远,所以他们提出了ClO-4破坏甲醇氢键结构的程度最大.
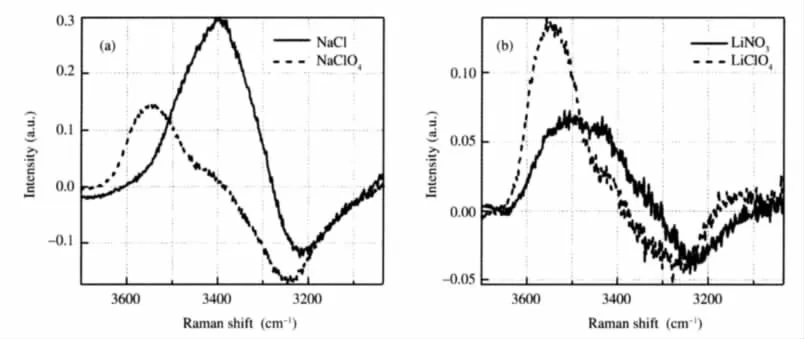
图2 不同盐/甲醇溶液O—H伸缩谱段的超额拉曼光谱Fig.2 Excess Raman spectra in the O—H stretching region of different salt/CH3OH solutions(a)comparison between the spectra of NaCl/CH3OH(solid line)and NaClO4/CH3OH(dashed line);(b)comparison between the spectra of LiNO3/CH3OH(solid line)and LiClO4/CH3OH(dashed line).The mole fraction of salt is~0.005.

图3 LiClO4/甲醇(实线)和NaClO4/甲醇(虚线)的O—H伸缩谱段超额拉曼光谱的对比Fig.3 Comparison between the excess Raman spectra in the O—H stretching region of LiClO4/ CH3OH(solid line)and NaClO4/CH3OH(dashed line)The mole fraction of salts is~0.005.
我们也试图利用O—H伸缩谱段的光谱来了解阳离子与甲醇的相互作用,固定阴离子为ClO-4,改变阳离子分别为Li+和Na+(图3),这里正峰完全重合,也就是说这个正峰完全代表与ClO-4相互作用的甲醇,而我们知道溶液中一定存在阳离子与甲醇的相互作用,也就是说应当还有一个表示阳离子附近甲醇的正峰,但是在超额拉曼光谱中并没有看到这样的正峰,所以这个谱段的光谱并不利于研究阳离子与甲醇的相互作用.我们没有观察到不同的正峰,相反观察到负峰的强度有很大的差异,负峰体现了体相甲醇的减少,这里之所以不同,我们认为是与阳离子相互作用的甲醇的正峰也位于负峰的位置附近,正、负谱峰叠加非常严重,这就导致了没有观察到代表阳离子附近甲醇的正峰,而是强度不一致的负峰.
由上面的超额拉曼光谱可以明显地看出,利用O—H伸缩谱段可以很直接地了解阴离子与甲醇的相互作用,这是因为阴离子和甲醇可以通过氢键直接结合起来(图4(a)),所以O—H伸缩振动受到阴离子的影响很大,但是阳离子和甲醇的相互作用则与之不同,该相互作用主要是电荷与偶极间的作用(图4(b)),对O—H键的极化作用影响很小,不足以改变O—H的伸缩振动频率,而与阳离子作用的甲醇又通过OH和别的甲醇分子相互作用,这就导致了与阳离子相互作用的甲醇O—H伸缩振动不能明显地和体相甲醇O—H伸缩振动区分开来,所以阳离子与甲醇的相互作用不能直接利用这段光谱来研究.这与Stygar等[33]的结果不一致,他们在讨论碱金属阳离子溶解在聚乙二醇单甲醚中时,提出阳离子使得O—H伸缩谱峰的最大值向低波数移动,且阳离子的半径越大往低波数移动得越大.而一些不含氢键的有机溶剂的盐溶液中,有机溶剂主要与阳离子相互作用,所以在拉曼光谱中常常体现了阳离子与有机溶剂的相互作用.例如Wang等[34]在LiClO4/二甲基亚砜(DMSO)体系中,指出ClO-4与DMSO的相互作用太弱,以致观察不到;Markarian等[35]利用红外和拉曼光谱研究了LiClO4/二乙基亚砜(DESO),从S═O伸缩的拉曼光谱中分析得到Li+与DESO存在相互作用,且这种作用破坏了部分DESO自我缔合的结构.
2.4 阴、阳离子对甲醇C—O伸缩振动的影响

图4 离子与甲醇分子的相互作用示意图Fig.4 Schematic diagram for the interactions between ions and methanol molecules(a)anionsinteractwithmethanolmoleculesthroughhydrogenbond,(b)cationsinteractwithmethanolmoleculesthroughcharge-dipoleinteraction
由于很难利用O—H伸缩谱段的拉曼光谱讨论阳离子与甲醇的相互作用,所以需要在其它谱段寻找阳离子与甲醇相互作用的证据.C—O伸缩振动和O—H伸缩振动一样对氢键网络结构敏感[17-19],因此为了解阳离子与甲醇的相互作用,我们也测量了甲醇C—O伸缩谱段的拉曼光谱(图1b).和O—H伸缩谱段的光谱类似,由于浓度很小,很难直接利用C—O伸缩谱段的拉曼光谱讨论盐与甲醇的相互作用,所以这里也通过超额拉曼光谱的手段来分析在甲醇中加入盐后C—O伸缩振动的变化.这里比较了LiClO4、LiCl、Mg(ClO4)2、NaClO4的甲醇溶液,其超额拉曼光谱见图5.这个谱段的超额拉曼光谱和O—H伸缩谱段的不一致,在O—H伸缩谱段中只有一个负峰和一个正峰(图2,3),而在C—O伸缩谱段的超额拉曼光谱中除了一个负峰外还有两个正峰,这两个正峰必然代表了与阴、阳离子相互作用的甲醇分子,也就是说我们可以利用C—O伸缩振动区分开阴、阳离子附近的甲醇分子.为了进一步区别这两个正峰,我们对比了LiClO4和LiCl甲醇溶液的超额拉曼光谱(图5(a)),其中高波数(~1048 cm-1)的正峰基本一致,但低波数(~1020 cm-1)的正峰有很大的差别,因此我们可以判定低波数的正峰是与阴离子相互作用的甲醇C—O伸缩振动,高波数的正峰是与阳离子相互作用的甲醇C—O伸缩振动,并且可以明显地看出LiCl溶液中低波数的正峰强度要小于LiClO4溶液中低波数的正峰强度,也就是说相对ClO-4而言,Cl-附近的甲醇比较少.
为了进一步确定高波数的正峰是与阳离子相互作用的甲醇C—O伸缩振动,测量了LiClO4、NaClO4、 Mg(ClO4)2的甲醇溶液,其超额光谱见图5(b).同样的,所有溶液的超额光谱均有两个正峰,一个负峰.从图中可以看到所有溶液的正峰都基本一致,反而观察到负峰不一致.没有观察到高波数的正峰不一致,这可能是因为不同阳离子周围的甲醇C—O伸缩振动频率都大致一样,而与之相互作用的甲醇数目略有差异,这就导致了减少的纯甲醇不一致,即负峰不一致.阳离子附近的甲醇越多,高波数的正峰和负峰应该越大,这两个谱峰的叠加导致了高波数的正峰没有明显变化,而负峰有明显的差别.由超额光谱可以知道与阴、阳离子相互作用的甲醇C—O伸缩振动频率顺序为:CH3—OH(阴离子)<CH3—OH(体相)<CH3—OH(阳离子).这和O—H伸缩谱段有明显区别,在C—O伸缩谱段阴、阳离子与甲醇的相互作用可以区分开来,下面利用这个区分开的C—O伸缩振动去讨论阴、阳离子是如何影响纯甲醇的微观结构.
2.5 阴、阳离子第一溶剂化层中的甲醇数目
我们可以通过拟合C—O振动的拉曼谱峰分解出与阴、阳离子相互作用的甲醇和体相甲醇这三个拉曼光谱成分,利用分解出的拉曼光谱谱峰强度就可以得到它们大致的数目比例.但是在溶液浓度很小时,与阴、阳离子相互作用的甲醇在溶液中的总含量很少,所以相应的拉曼光谱很弱,实验测得的光谱主要是体相甲醇的贡献,这样一来直接拟合C—O振动的拉曼谱峰会带入很大的误差,但是如果我们能够先确定三个成分的谱峰位置和宽度,那么拟合光谱所得的谱峰强度可信度就会提高.

图5 不同盐/甲醇溶液C—O伸缩谱段的超额拉曼光谱Fig.5 Excess Raman spectra in the C—O stretching region of different salt/CH3OH solutions(a)comparison between the spectra of LiClO4/CH3OH(solid line)and LiCl/CH3OH(dashed line);(b)comparison among the spectra of LiClO4/ CH3OH(solid line),Mg(ClO4)2/CH3OH(dashed line)and NaClO4/CH3OH(dotted line).The mole fraction of Mg(ClO4)2is~0.0025,and the mole fraction of all the other salts is~0.005.
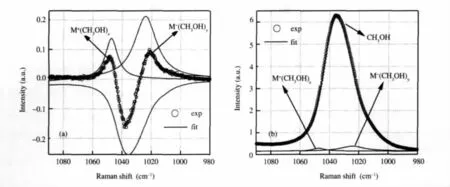
图6 C—O伸缩谱段的超额拉曼光谱和拉曼光谱的谱峰分解Fig.6 Decomposition of excess Raman spectra and Raman spectra in the C—O stretching region(a)excess Raman spectra of LiClO4/CH3OH(cycle)and decomposed peaks(solid line);(b)Raman spectra of LiClO4/CH3OH(cycle)and decomposed peaks(solid line).
根据图5的超额光谱,可以先确定与阴、阳离子相互作用的甲醇C—O伸缩振动谱峰的位置和宽度.在拟合时首先固定负峰的位置、宽度为纯甲醇C—O伸缩振动拉曼谱峰的位置和宽度,这样就能非常准确地确定与阴、阳离子相互作用的甲醇C—O伸缩振动的拉曼光谱(图6(a)),拟合结果见表1.在拟合超额拉曼光谱时,分解得到的谱峰强度要比超额拉曼光谱的强度要大,这是因为正、负谱峰互相叠加的缘故.利用拟合超额拉曼光谱得到的结果进一步拟合C—O伸缩振动的拉曼光谱就可以较为准确地得到三个谱峰的强度信息,见图6(b).我们知道谱峰强度正比于拉曼散射截面和分子数目的乘积,为了了解分子数目,这里我们近似认为所有的甲醇C—O伸缩振动散射截面都一致,那么谱峰强度就正比于甲醇的分子数目.利用该分子数目就可以知道和每个离子相互作用的甲醇数目,n±=r±/χ±,其中n±是与阳、阴离子相互作用的甲醇分子平均数目,r±是阴、阳离子相应谱峰的强度在总强度中的比例,χ±是阳、阴离子的摩尔分数.也就是说通过拟合超额拉曼光谱和原始的拉曼光谱就可以得到与阴、阳离子相互作用的平均甲醇分子数目.
我们的结果显示每个Li+、Na+、Mg2+分别与(2.0± 0.3)-(2.8±0.3)、3.4±0.3、2.8±0.3个甲醇分子相互作用,每个Cl-、ClO-4分别与2.9±0.5、(4.9±0.6)-(6.0±0.6)个甲醇分子相互作用(表2).与各种阴、阳离子相互作用的甲醇分子数目都非常少,所以我们认为这里得到的甲醇数目主要反映第一溶剂化层中甲醇分子数目,这是因为只有在第一溶剂化层中甲醇才与阴、阳离子直接结合,而第一溶剂化层之外的甲醇主要还是通过甲醇分子间的氢键缔合在一起,它们的C—O伸缩振动和体相甲醇的C—O伸缩振动没有显著的差异,其拉曼光谱几乎还是体相甲醇的拉曼光谱,所以这里通过光谱拟合得到的结果反映了第一溶剂化层中甲醇分子的平均数目.也就是阴阳离子几乎不影响第一溶剂化层以外的甲醇微观结构,这与前人得到阴、阳离子几乎不影响水的氢键网络结构的结论是相似的;例如,Soper[39]和Smith[40]等研究盐对水的结构影响时,也提出阴、阳离子对水结构的扰动大部分是在第一水合层;Omta等[41]通过飞秒泵浦探测光谱得到阴离子降低了第一水合层的水分子振动和转动时间,而对第一水合层以外的水的结构没有影响,因此认为阴、阳离子既没有增强也没有减弱水的氢键网络结构.我们获得的第一溶剂化层中甲醇的数目与其它的结果略有不同(表2),这可能是我们忽略了拉曼散射截面的原因.

表1 阴、阳离子周围甲醇C—O伸缩振动谱峰的位置和半高全宽Table 1 Position and full width at the half maximum(FWHM)of C—O stretching band of methanol around cations and anions

表2 阴、阳离子第一溶剂化层中甲醇分子的数目Table 2 Number of methanol molecules in the first solvation shell of cations and anions
3 结 论
通过比较不同盐/甲醇溶液的超额拉曼光谱来研究阴、阳离子对甲醇微观结构的影响.利用O—H伸缩谱段的超额拉曼光谱,可以了解阴离子与甲醇的相互作用,超额拉曼光谱显示了阴离子与甲醇的相互作用要弱于甲醇间的相互作用,且有下面的关系: CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH,但是这段光谱不能明显地反映阳离子与甲醇的相互作用.超额拉曼光谱表明C—O伸缩谱段的拉曼光谱可以同时反映阴、阳离子与甲醇的相互作用,且与阴、阳离子相互作用的甲醇C—O伸缩振动频率有如下的关系:CH3—OH(阴离子)<CH3—OH (体相)<CH3—OH(阳离子).通过拟合C—O伸缩谱段的超额拉曼光谱和原始拉曼光谱,确定了阴、阳离子第一溶剂化层中甲醇分子的平均数目,结果显示Li+、Na+、Mg2+第一溶剂化层中分别含有(2.0±0.3)-(2.8±0.3)、3.4±0.3、2.8±0.3个甲醇分子,Cl-、ClO-4第一溶剂化层中分别含有2.9±0.5、(4.9±0.6)-(6.0±0.6)个甲醇分子,这些离子几乎不会影响第一溶剂化层之外的甲醇微观结构.
1 Smedley,S.I.Interpretation of ionic conductivity in liquids.New York:Plenum,1980
2 Marcus,Y.Ion solvation.Chichester,U.K.:Wiley,1986
3 Yamauchi,S.;Kanno,H.Chem.Phys.Lett.,1989,154(3):248
4 Yamauchi,S.;Kanno,H.J.Phys.Chem.,1990,94(17):6594
5 Kanno,H.;Yamauchi,S.J.Raman Spectrosc.,1993,24(7):403
6 Honshoh,M.;Kanno,H.;Ueda,T.J.Raman Spectrosc.,1995,26 (4):289
7 Kanno,H.;Honsho,M.;Yamauchi,S.Z.Naturforsch.,1995,50a: 257
8 Hidaka,F.;Yoshimura,Y.;Kanno,H.J.Solution Chem.,2003,32 (3):239
9 Abe,N.;Ito,M.J.Raman Spectrosc.,1978,7(3):161
10 Symons,M.C.R.J.Chem.Soc.Faraday Trans.,1983,79:1273
11 Mochizuki,S.;Wakisaka,A.J.Phys.Chem.A,2002,106(20): 5095
12 Jorgensen,W.L.;Bigot,B.;Chandrasekhar,J.J.Am.Chem.Soc., 1982,104(17):4584
13 Impey,R.W.;Sprik,M.;Klein,M.L.J.Am.Chem.Soc.,1987, 109(20):5900
14 Pagliai,M.;Cardini,G.;Schettino,V.J.Phys.Chem.B,2005,109 (15):7475
15 Torii,H.J.Phys.Chem.A,1999,103(15):2843
16 Lin,K.;Zhou,X.G.;Luo,Y.;Liu,S.L.J.Phys.Chem.B,2010, 114(10):3567
17 Dixit,S.;Poon,W.C.K.;Crain,J.J.Phys.-Condes.Matter,2000, 12(21):L323
18 Musso,M.;Torii,H.;Ottaviani,P.;Asenbaum,A.;Giorgini,M.G. J.Phys.Chem.A,2002,106(43):10152
19 Max,J.J.;Chapados,C.J.Chem.Phys.,2009,130(12):124513
20 Miller,A.G.;MacKlin,J.W.J.Phys.Chem.,1985,89(7):1193
21 Marcus,Y.;Hefter,G.Chem.Rev.,2006,106(11):4585
22 Li,Q.Z.;Wu,G.S.;Yu,Z.W.J.Am.Chem.Soc.,2006,128(5): 1438
23 Li,Q.Z.;Wang,N.N.;Zhou,Q.;Sun,S.Q.;Yu,Z.W.Appl. Spectrosc.,2008,62(2):166
24 Wang,N.N.;Jia,Q.;Li,Q.Z.;Yu,Z.W.J.Mol.Struct.,2008, 883-884:55
25 Zhang,Q.G.;Wang,N.N.;Yu,Z.W.J.Phys.Chem.B,2010, 114(14):4747
26 Yu,Y.Q.;Lin,K.;Zhou,X.G.;Wang,H.;Liu,S.L.;Ma,X.X. J.Raman Spectrosc.,2007,38(9):1206
27 Yu,Y.Q.;Lin,K.;Zhou,X.G.;Wang,H.;Liu,S.L.;Ma,X.X. J.Phys.Chem.C,2007,111(25):8971
28 Barthel,J.;Neueder,R.;Poepke,H.;Wittmann,H.J.Solution Chem.,1998,27(12):1055
29 Wahab,A.;Mahiuddin,S.Can.J.Chem.,2002,80(2):175
30 Ihmels,E.C.;Safarov,J.T.J.Chem.Thermodyn.,2006,38(11): 1443
31 Wawer,J.;Krakowiak,J.;Grzybkowski,W.J.Chem.Thermodyn., 2008,40(8):1193
32 Wahab,A.;Mahiuddin,S.J.Chem.Eng.Data,2009,54(2):436
33 Stygar,J.;Zukowska,G.;Wieczorek,W.Solid State Ionics,2005, 176(35-36):2645
34 Wang,Z.X.;Huang,B.Y.;Wang,S.M.;Xue,R.J.;Huang,X.J.; Chen,L.Q.Electrochim.Acta,1997,42(17):2611
35 Markarian,S.A.;Gabrielian,L.S.;Zatikyan,A.L.;Bonora,S.; Trinchero,A.Vib.Spectro.,2005,39(2):220
36 Ozutsumi,K.;Ohtaki,H.Pure Appl.Chem.,2004,76(1):91
37 Yamagami,M.;Wakita,H.;Yamaguchi,T.J.Chem.Phys.,1995, 103(18):8174
38 Megyes,T.;Grosz,T.;Radnai,T.;Bako,I.;Palinkas,G.J.Phys. Chem.A,2004,108(35):7261
39 Soper,A.K.;Weckström,K.Biophys.Chem.,2006,124(3):180
40 Smith,J.D.;Saykally,R.J.;Geissler,P.L.J.Am.Chem.Soc., 2007,129(45):13847
41 Omta,A.W.;Kropman,M.F.;Woutersen,S.;Bakker,H.J. J.Chem.Phys.,2003,119(23):12457
Effects of Salts on the Microstructure of Methanol
YU Xiao-Chun LIN Ke HU Nai-Yin ZHOU Xiao-Guo LIU Shi-Lin*
(Hefei National Laboratory for Physical Sciences at the Microscale,Department of Chemical Physics, University of Science and Technology of China,Hefei 230026,P.R.China)
We studied the effects of salts on the microstructure of liquid methanol using the Raman spectra.We compared the excess Raman spectra of different methanolic salt solutions in the O—H and C—O stretching regions. These regions reflect the interactions between anions(cations)and methanol molecules.In the O—H stretching region, the excess spectra show that the anions interact with methanol molecules by weak hydrogen bonding and the strength of the hydrogen bonds decrease according to the order:CH3OH-CH3OH>Cl--CH3OH>NO-3-CH3OH>ClO-4-CH3OH. Additionally,no interactions between cations and methanol molecules are apparent,as determined after analysis of this region.In the C—O stretching region,the excess Raman spectra show the interactions between anions(cations)and methanol molecules.The C—O stretching vibration frequencies of methanol that interact with the anions and cations increase according to the order:CH3—OH(anions)<CH3—OH(bulk)<CH3—OH(cations).According to the excess Raman spectra in the C—O stretching region,we fitted the Raman spectra and used the fitting results to determine the solvation numbers in the first solvation shell of the ions.The Raman spectra show that the ions do not affect the microstructure of liquid methanol beyond the first solvation shell at this concentration(~0.005).
Raman spectrum;Anion;Cation;Methanol;First solvation shell
O645
Received:May 25,2010;Revised:June 8,2010;Published on Web:July 15,2010.
*Corresponding author.Email:slliu@ustc.edu.cn;Tel:+86-551-3602323.
The project was supported by the National Natural Science Foundation of China(20873131,20928002)and National Key Basic Research Program of China(973)(2007CB815204).
国家自然科学基金(20873131,20928002)和国家重点基础研究发展规划项目(973)(2007CB815204)资助
ⒸEditorial office of Acta Physico-Chimica Sinica
—— 世界观测-3卫星