普洱茶(熟茶)中主要霉菌的分离与鉴定
许靖逸,邵宛芳,*,张 俊,王文光,袁 唯
(1.云南农业大学龙润普洱茶学院,云南昆明650201;2.云南省农业科学院,云南昆明650000;3.云南农业大学食品科技学院,云南昆明650201)
普洱茶(熟茶)中主要霉菌的分离与鉴定
许靖逸1,邵宛芳1,*,张 俊2,王文光3,袁 唯3
(1.云南农业大学龙润普洱茶学院,云南昆明650201;2.云南省农业科学院,云南昆明650000;3.云南农业大学食品科技学院,云南昆明650201)
“渥堆”过程和贮藏工艺是普洱茶具有独特品质的主要原因,而“渥堆”过程中微生物发挥了重要作用。本实验对云南省普洱茶主产区的普洱熟茶中的主要霉菌进行分离鉴定,旨在探讨普洱熟茶中主要的霉菌种类。
普洱茶,霉菌,分离,鉴定
根据GB/T 22111规定,普洱茶是指以地理标志保护范围内的云南大叶种晒青茶为原料,并在地理标志保护范围内采用特定的加工工艺制成,具有独特品质特征的茶叶。按其加工工艺及品质特征,普洱茶分为普洱茶(生茶)和普洱茶(熟茶)两种类型。在普洱茶(熟茶)的加工过程中,要以云南大叶种制成的晒青毛茶作为原料,经过潮水、后发酵、陈化及干燥工序。普洱茶品质形成是原料、加工工艺、加工环境条件等综合作用的结果,其中渥堆是一道最为关键的工序,根据陈宗道[1]研究发现,普洱茶渥堆过程中存在黑曲霉、青霉、根霉、灰绿曲霉、酵母等微生物,黑曲霉约占微生物总数的80%左右。胡建程[2-3]等先后在各种再加工茶中分离鉴定出青霉(Penicllium)、曲霉(Aspergillius)、毛霉(Mucor)、根霉(Rhizopus)、蜡中枝孢霉(Cladosprium)等。研究发现即使在普洱成品茶中这些微生物还存在,对普洱茶品质的形成始终都起到了相当重要的作用。本研究以云南普洱茶主产区生产的普洱熟茶为材料,对其中的霉菌进行分离鉴定,旨在探讨普洱熟茶中主要的霉菌种类,为消费者放心饮用普洱茶提供参考依据。
1 材料与方法
1.1 材料与仪器
以云南普洱茶主产区中主要厂家生产的普洱熟茶(散茶和饼茶)为供试材料 所选样品均具有普洱茶(熟茶)正常的品质特征。具体情况见表1;培养基分离曲霉类(PDA培养基)、黑曲霉属纯化培养基。

表1 供试材料表
SW-CJ-IA型超净工作台,BII.500-S型电热恒温培养箱,S.C.101-1型鼓风电热干燥箱,A13204-N型电子分析天平,JLQ-SI型菌落计数器,HZQ-QX型全温振荡器,OLYMPUS型显微镜,Motic-AE31型显微摄影用倒置显微镜,高压湿热蒸汽灭菌锅,粉碎机组织捣碎机,显微镜SONY数码照相机,细菌生化微量鉴定管,冰箱,微波炉等。
1.2 实验方法
霉菌的分离与计数选用孟加拉红培养基;样品稀释液的制备[4];接种[5];选菌及纯化[6];载片培养;显微观察及显微摄影;霉菌的鉴定主要通过菌落特征、显微形态观察和显微测微尺法进行测量鉴定,结合《真菌鉴定手册》[6]。
2 结果与分析
2.1 普洱茶样中霉菌及其优势菌的数量差异
普洱茶后发酵过程中,霉菌对其品质的形成起到很大作用。普洱茶产品特别是压制茶,经过筛分和高温蒸压后,残留在其中的霉菌数量很少。本实验采用25℃无菌水进行处理,用孟加拉红培养基对普洱茶产品中残留的霉菌及其优势菌进行分离计数,其结果见图1、图2。
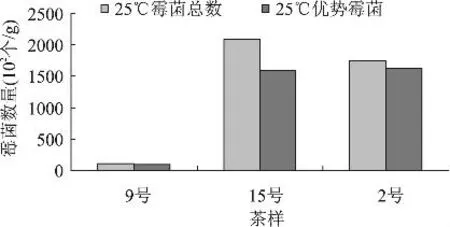
图1 25℃水温处理普洱饼茶中霉菌数量
图1和图2表示经室温水处理的饼茶散茶中霉菌及其优势霉菌的数量差异,由图1和图2可知,普洱茶中霉菌数量较少,仅达102个/g,饼茶中霉菌的数量极少,且以6号茶和7号茶即思茅地区生产的普洱茶中霉菌的数量居多;散茶中的霉菌可达104个/g,其数量是饼茶中的100倍左右,可能是由于加工工艺或生产环境的不同造成普洱茶中微生物数量的差异。散茶中,尤其是9号茶中霉菌的数量较少。
2.2 普洱茶样中霉菌的鉴定
在16份普洱茶样品中,共分离纯化得到5株霉菌类菌株,经形态及培养特征、生理生化反应观察,依据《真菌鉴定手册》[6]、《中国真菌志》[7],并经真菌学专家刘云龙验证,鉴定结果如下:
2.2.1 青霉属(Penicillium) 按照《真菌鉴定手册》[6]和《中国真菌志》[7]的方法对该菌进行初步鉴定,结果如图3~图5所示。
菌落形态:生长速度一般,绒状,菌落近似圆形,初为白色,随着不断的生长逐渐变成浅蓝色,后变为蓝绿色至灰绿色,边缘为白色环状,有浅黄色液滴,背面变为无色至浅黄色,有皱褶。
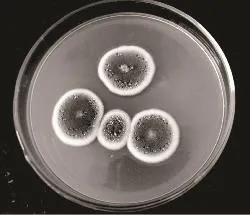
图3 单菌落

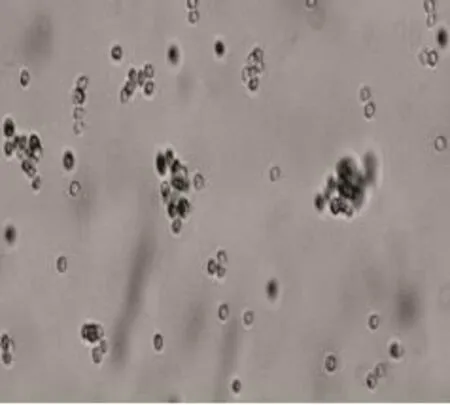
图5 分生孢子(×600)
个体形态:帚状枝有分枝1~2次,不对称,小梗不作批针状,不分散,分枝紧凑,分枝与间枝近似于平行排列,孢子链分开,小梗顶端骤然变细削,分生孢子有球形、圆柱形、椭圆形等多种形态。
该菌的分类地位为真菌门(Fungi),半知菌类(Fungi Imperfect),从梗孢目(Moniliales),从梗孢科(Moniliaceae),从梗孢科单孢亚科(Amerosporoideae of Monilliaceae),曲 霉 族( Aspergilleae),青 霉 属(Penicillium LK.ex Fries)[8]。该种青霉能产生柠檬酸霉素[9-11],对普洱茶醇和品质的形成具有一定的作用[12]。
2.2.2 曲霉属(Aspergillus)
2.2.2.1 Aspergillus 01 按照《真菌鉴定手册》[6]和《中国真菌志》[7]的方法对Aspergillus 01进行初步鉴定,结果如图6~图8所示。

图6 单菌落
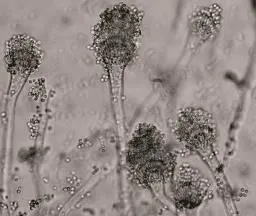
图7 产孢结构(×600)

图8 分生孢子(×600)
菌落形态:该菌在PDA培养基上生长旺盛,菌落初生为乳白色,后中心变为浅蓝色,最后变成青绿色,似青霉。菌落表面呈绒毛状,边缘为白色,背面变为浅黄色。在28~30℃下培养3~4d,直径可长到3.0~4.0cm左右大小。
个体形态:分生孢子梗顶端膨大呈烧瓶形或近圆形的囊状,其梗径5~8μm,其上着生有双层小梗,孢子穗为圆球形,直径100~150μm,分生孢子为球形,直径2.5~3.5μm。
该霉菌的分类地位为真菌门(Fungi),半知菌类(Fungi Imperfect),丛梗孢目(Moniliales),从梗孢科(Moniliaceae),从梗孢科单胞亚科(Amerosporoideae of Monilliaceae),曲 霉 族( Aspergilleae),曲 霉 属(Aspergillus Micheli ex Fr),萨氏曲霉组(A.sydowi)。该菌对普洱茶呈香起重要作用。
2.2.2.2 Aspergillus02 按照《真菌鉴定手册》[6]和《中国真菌志》[7]的方法对该菌进行初步鉴定,结果如图9~图13所示。

图9 产孢结构(×600)
菌落形态:菌落在PDA培养基上生长迅速,在28~30℃下培养7d,菌落铺满整个平板;菌落平坦或中心稍凸起,有规则或不规则的辐射状沟纹,质地丝绒状或稍呈絮状,有的偶有过度生长,表面呈暗褐色至炭黑色,渗出液有或无,具或不具霉味;在平面培养基上生于中央,在斜面培养基上生于基部,菌落反面无色、黄色、黄褐色或带微黄色。
个体形态:分生孢子结构大,呈黑褐色至炭褐色,分生孢子头初为球形至辐射状,直径 150~470mm,老后分裂成几个圆柱形,可达780mm左右,有的菌株产生菌核。孢梗茎1500μm×9~20μm,壁光滑,老时带黄色或黄褐色;顶囊球形或近球形,老时暗褐色。

图10 分生孢子梗(×150)

图11 分生孢子(×600)

图12 俯视分生孢子头(×150)
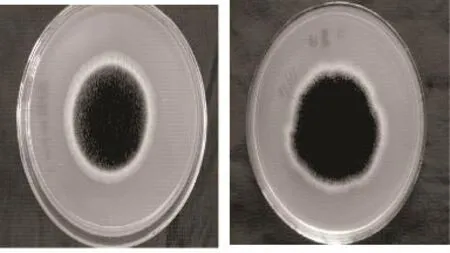
图13 单菌落
该霉菌的分类地位为真菌门(Fungi),半知菌类(Fungi Imperfect),丛梗孢目(Moniliales),从梗孢科(Moniliaceae),从梗孢科单胞亚科(Amerosporoideae of Monilliaceae),曲 霉 族( Aspergilleae),曲 霉 属(Aspergillus Micheli ex Fr),黑曲霉组(A.niger)[8]。
该菌是一种食品工业生产中的安全性菌群,是参与普洱茶品质形成的主要菌种,在生产中具有重要经济意义[13]。黑曲霉能产生20种左右的水解酶,其中糖苷酶、果酸酶、葡萄糖淀粉酶、纤维素酶、柚苷酶、乳酸酶、葡萄糖氧化酶等许多酶类,还可以分解包括多糖、脂肪、蛋白质、果胶、天然纤维和不可溶性化合物等有机物;并且它的异变菌可产生草酸、柠檬酸、葡萄糖酸、抗坏血酸等。在普洱茶渥堆发酵陈化中,黑曲霉代谢产生的有机酸和酶等对普洱茶品质的形成起着重要的作用。
其产生的葡萄糖淀粉酶、纤维素酶和果胶酶等可以分解包括多糖、脂肪、蛋白质、天然纤维、果胶和不可溶性水化合物等有机物,水解的产物大多为单糖、氨基酸、水化果胶和可溶性碳水化合物,使茶叶内所含有效成分易于渗出、扩散,为增强茶汤的滋味和形成普洱茶甘滑、醇厚的品质特色奠定了坚实的物质基础。所以说,在普洱茶发酵渥堆过程中黑曲霉代谢产生的有机酸和酶对普洱茶品质的形成有着重要作用。
2.2.2.3 Aspergillus03 从成品普洱茶中分离出的菌体显微照相见图14~图17所示。

图14 幼时菌落
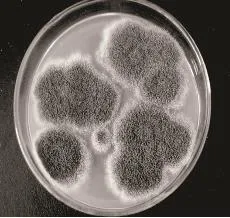
图15 成熟菌落

图16 产孢结构(×600)
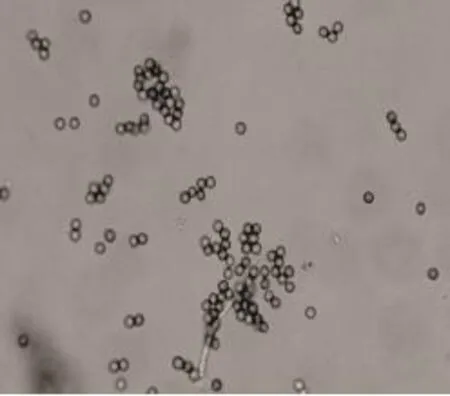
图17 分生孢子(×600)
菌落形态:菌落初呈黄色或淡黄绿色,后变黄褐色;在PDA培养基上生长速度一般,质地粉粒状或绒状;培养基背面无色至淡黄色,无渗出液,有或无霉味。
个体形态:分生孢子圆形或洋梨形,直径4~10μm,粗糙;分生孢子梗长达 2mm,直径20~25μm,壁薄粗糙;顶囊直径50~70μm,小梗单层或双层。
该霉菌属于真菌门(Fungi),半知菌类(Fungi Imperfect),丛 梗 孢 目(Moniliales),从 梗 孢 科(Moniliaceae),从梗孢科单胞亚科(Amerosporoideae of Monilliaceae),曲 霉 族( Aspergilleae),曲 霉 属(Aspergillus Micheli ex Fr),黄-米曲霉组(A.flavusoryze)[14]。
本种在工业上用途很广,主要是酿造酒精、味精和酱油;也可用于生产α-乳酸和糊化淀粉,对普洱茶回甘及陈香风味有一定影响。
2.2.3 毛霉目(Mucoraceae) 从成品普洱茶中共分离到2株毛霉目霉菌菌株,其鉴定结果如下:
2.2.3.1 根霉(Rhizopus) 按照《真菌鉴定手册》[6]和《中国真菌志》[7]的方法进行初步鉴定,结果如图18~图20所示。

图18 黑根霉菌丛

图19 黑根霉形态(×150)

图20 黑根霉假根(×600)
菌落形态:该菌在PDA培养基上生长时,初呈白色,绒毛状,匍匐菌丝弯曲状,在与培养基表面相接触处产生假根,假根发达,分枝多,两接间距离大约为1~2μm。
个体形态:孢梗直立不分枝,孢子囊球形或椭圆形,褐色或黑色,囊轴球形、椭圆形,直径约为55μm,高约70μm。
经鉴定,该菌属于接合菌亚门(Zygomycotina);接合菌纲(Zygomycetes);毛霉目(Mucorales);毛霉科(Mucoraceae),根霉属(Rhizopus Ehrenberg),黑根霉(Rhizopus nigricans)。
除了细菌以外,黑根霉是迄今为止丝状菌中产L-乳酸的另一重要菌种[15-16],黑根霉淀粉酶的活力很高,能产生有机酸,如反丁烯二酸、乳酸、琥珀酸等,还能产生芳香的酯类物质,也是转化甾醇族化合物的重要菌类,在普洱茶加工储放过程中生成一定数量的根霉,有利于普洱茶甜醇品质的形成。
2.2.3.2 毛霉(Mucor) 按照《真菌鉴定手册》[6]和《中国真菌志》[7]的方法对该菌进行初步鉴定,结果如图21~图23所示。

图21 毛霉菌丛

图22 毛霉孢子囊的着生(×600)

图23 毛霉形态(×600)
菌落形态:通常菌丝体发达,分枝成蛛网状,多核、无隔,气生菌丝体往往生长繁茂,呈毛状,毛霉的菌丝体在基质上或基质内能广泛蔓延,无假根和匍匐枝,生长速度很快,28~30℃下2d,菌落可以扩展整个平板。
个体形态:孢囊梗直接由菌丝体生出,一般单生,分枝较少或不分枝。分枝顶端都有膨大的孢子囊,囊轴与孢囊梗相连处无囊托。孢囊孢子成熟后,孢子囊壁破裂,孢囊孢子分散开来。毛霉菌丝初期为白色,后为灰白色至黑色,这说明孢子囊大量成熟。
该菌的分类地位为接合菌亚门(Zygomycotina);接合菌纲(Zygomycetes);毛霉目(Mucorales);毛霉科(Mucoraceae);毛霉属(Mucor Micheli ex Fries);总状枝毛霉组(Racemosus)[17]。该菌分布很广,是制造豆鼓的发酵菌之一,也是普洱茶发酵菌株之一。
3 结论
3.1 普洱茶中微生物含量很少,尤其是霉菌含量较少,仅达102个/g,饼茶中霉菌的数量更少。
3.2 本实验从普洱茶样中分离到3株曲霉,其中一株是黑曲霉、青霉、根霉和毛霉各1株,这些均为食品发酵工业常用的菌种。
综上所述,普洱茶中所存在霉菌主要是一些青霉、曲霉等有益菌群,没有发现对人体产生危害作用的微生物,本研究结果将对消费者放心饮用普洱茶提供理论依据。
[1]陈宗道,刘勤晋,周才琼.微生物与普洱茶发酵[J].中国茶叶,1988(4):4-7.
[2]胡建程.四种边茶中微生物分离和鉴定[J].茶叶,1957(2):20-22.
[3]胡建程.茶叶中霉菌的研究[J].茶叶,1979(1):8-9.
[4]谭自立.茶和普洱茶的保健作用[J].云南茶叶,1994(3):4-6.
[5]邓时海.普洱茶作为人体健康食疗的探讨(四)[J].云南茶叶,1996(1):19-21.
[6]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:1-649.
[7]齐祖同.中国真菌志[M].第一版,第五卷.北京:科学出版社,1997:1-178.
[8]C J阿历索保罗,C W明斯.真菌学概论[M].北京:农业出版社,1981:1-2,247-256.
[9]谢舜珍,张树正.局限青霉生淀粉水解酶的产生条件及酶一般性质的研究[J].微生物学报,1994,34(3):263-238.
[10]Fierro F,Laich F,Garcia-Rico RO,et al.High efficiency transformation of Peniculium nalgiovense with integrative and autonomously replicating plasmids[J].Int J Food Microbiol,2004,90(2):237-248.
[11]Alberto Martin,Juan J Cordoba,Maria J Benito.Effect of Penicillium chryso-genum and Debaryomyces hansenii on the volatile compounds during controlled ripening of pork loins[J]. International Journal of Food Microbiolo,2003,841:327-338.
[12]周树红.成品普洱茶陈化机理及提质技术研究[D].优秀硕博论文,2001:1-2.
[13]余永华.真菌与人[M].北京:科学普及出版社,1979:84-94.
[14]苏世彦.食品微生物检验手册[M].第一版.北京:中国轻工业出版社,1998.
[15]曹本昌,徐建林,匡群.根霉发酵L-乳酸[J].食品与发酵工业,1991(1):37-41.
[16]Catter V M.Nuclear behavior in the Mucorales I.The Mucor pattem[J].Bull Torry Bot,Club,1942,69:480-508.
[17]张纪忠.微生物分类学[M].上海:复旦大学出版社,380-384.
Isolation and identification of the main fungus from pu-erh tea
XU Jing-yi1,SHAO Wan-fang1,*,ZHANG Jun2,WANG Wen-guang3,YUAN Wei3
(1.College of Long Run Pu-erh Tea,Yunnan Agricultural University,Kunming 650201,China;2.Yunnan Academy of Agricultural Science,Kunming 650000,China;3.College of Food Science and Technology,Yunnan Agricultural University,Kunming 650201,China)
The main reasons of forming unique quality are pile-fermentation process and storage technology in puerh tea.Moreover,microbes play a very important role during the pile-fermentation.The isolation and identification of fungus from pu-erh tea which had been picked from main pu-erh tea producing areas in Yunnan province were carried out to confer which fungus were in pu-erh tea.
pu-erh tea;fungus;isolation;identification
TS272.5+9
A
1002-0306(2010)12-0110-05
2009-02-04 *通讯联系人
许靖逸(1980-),女,博士,主要从事茶叶生物技术与资源利用研究。
农业部公益性行业科研专项(nyhyzx3-35-14);现代农业(茶叶)产业技术体系建设专项资金资助。

