重组人p53腺病毒联合顺铂对肺腺癌A549细胞基因表达的影响
汪进良,焦顺昌,胡 毅,李瑾昱
解放军总医院肿瘤内科,北京100853
肺癌是当前人类最常见的恶性肿瘤之一,为肿瘤死亡的首要病因。肺癌的治疗除少数早期患者可手术切除外,绝大多数的晚期患者仍是以化疗和放疗为主,但总的5年生存率不到15%。由于60%以上的肺癌组织中存在p53基因突变,因而针对p53突变的基因治疗成为了研究热点。基础及临床研究表明,以腺病毒为载体,与人野生型p53cDNA重组构建的重组人p53腺病毒 (recombinant human adenovirus p53,rAd-p53)可有效抑制肿瘤生长,同时,rAd-p53可与化疗药物联合使用,增加肿瘤细胞对化疗药物敏感性[1]。另有研究表明,当rAd-p53与顺铂 (cisplatin,DDP)联合时,可明显增加DDP对肺腺癌A549细胞的抑制作用,其机制与细胞周期阻滞有关[2]。本研究通过基因芯片的方法,从基因水平探讨rAd-p53提高DDP对肺腺癌A549细胞抑制作用的机制,以期为rAd-p53和化疗的联合应用提供依据。
材料和方法
材料人肺腺癌A549细胞由我科胡毅博士取自中国医学科学院肿瘤研究所。重组人p53腺病毒注射液 (今又生)由深圳市赛百诺基因技术有限公司提供,批号:20070501。顺铂注射液由江苏豪森药液股份有限公司提供,批号:070203。胰蛋白酶-EDTA消化液为美国Amresco公司产品,胎牛血清为美国Hyclone公司产品,RPMI-1640培养基为美国invitrogen公司产品。人肿瘤相关基因芯片由北京博奥生物公司提供。RNA Clean-up试剂盒和PCR Nucleo-Spin ExtractⅡ试剂盒为德国MACHEREY-NAGEL公司产品;dNTPs和 RQ1 RNase-Free DNase为美国 Promega公司产品;Cy5-dCTP和Cy3-dCTP购自美国 GE Healthcare集团;DL2000 marker为日本TaKaRa公司产品。所有引物均由Invitrogen公司合成。
样品制备肺腺癌A549细胞按25×104细胞/孔接种于6孔培养板,培养24 h,待完全贴壁后,所有6孔细胞均给予0.1 mg/ml DDP,100 μl/孔。另外,其中3孔细胞给予LacZ空载病毒,标记为A1、A2、A3;另3孔给予感染强度为125 PFU/细胞的rAd-p53,标记为B1、B2、B3。加药2 h后换液,继续培养46 h后抽提细胞总RNA,具体操作步骤严格按Trizol试剂说明书进行。紫外吸收法测定样品RNA浓度和纯度,变性琼脂糖凝胶电泳检测总RNA质量。提取的总RNA样品A1、A2、A3合并为对照组A,样品B1、B2、B3合并为实验组B。
样品RNA荧光标记以总RNA起始,含有T7启动子序列的T7 Oligo(dT)Primer为引物,使用CbcScript酶合成1st-strand cDNA;再用RNA酶H将杂合链中的RNA切成短片段,DNA多聚酶以RNA短片段为引物延伸,合成2nd-strand cDNA,并纯化双链cDNA;以cDNA为模板,利用T7 Enzyme Mix合成cRNA,然后用RNA Clean-up试剂盒纯化;取2 μg cRNA,用CbcScriptⅡ酶,随机引物进行反转录,反转录产物用PCR NucleoSpin ExtractⅡ试剂盒纯化;以随机引物对反转录产物进行KLENOW酶标记,标记产物用PCR NucleoSpin ExtractⅡ试剂盒纯化,纯化后抽干。
杂交、清洗、芯片扫描和数据分析标记的DNA溶于80 μl杂交液中 (3×SSC,0.2%SDS,5×Denhart's,25%甲酰胺),于42℃杂交过夜。杂交结束后,先在42℃含0.2%SDS,2×SSC的液体中洗5 min,然后在0.2×SSC中室温洗5 min。玻片甩干后用LuxScan 10KA双通道激光扫描仪进行扫描。对照组样品A以cy5用红色表示,实验组样品B以cy3用绿色表示。对于某一点的信号来讲,如果cy3信号较强,该点多显绿色;如果cy5信号较强,该点多显红色;如果强度相似,即显黄色。采用LuxScan 3.0图像分析软件对芯片图像进行分析,以灰度值比值相差2倍以上作为差异具有统计学意义。采用SAM软件对结果进行分析。
实时荧光定量PCR对基因芯片结果的验证为验证芯片结果,挑选2个表达上调基因TP53和TNFRSF6以及1个表达下调基因ABCC4做实时荧光定量PCR,以GAPDH作为内参。各基因的引物序列为:TP53:上游引物ACCACCATCCACTACAACTACAT,下游引物 ACAAACACGCACCTCAAAGC;TNFRSF6:上游引物 CGAAAATGTTCAATAATGTCCC,下游引物TTCTTTAGGTGGTTCCAGGTAT;ABCC4:上游引物 GCCAAACCTCTAACCGACAT,下游引物TTCAATACAGCCCAAACCAA;GAPDH:上游引物TGTTGCCATCAATGACCCCTT,下 游 引 物 CTCCACGACGTACTCAGCG。按试剂说明和仪器操作规程将样品总RNA逆转录为cDNA,再进行实时PCR反应,利用仪器所配的软件计算各张PCR芯片中的每个基因的Ct(C代表循环数、t代表域值,指荧光信号到达设定的域值时所经历的循环数)值。最后,采用△△Ct方法比较相应基因的表达量变化,并与基因芯片结果进行对比。
结 果
细胞总RNA提取质量鉴定结果经紫外分光光度计检测,DDP处理的对照组A549细胞提取的3份样品A1、A2、A3总RNA和DDP联合rAd-p53作用后提取的3份样品 B1、B2、B3总 RNA的 A260/280值为1.8~1.9,A260/230值为1.5~1.9,即总RNA的纯度较高,无明显蛋白质及其他盐分掺杂。琼脂糖凝胶电泳检测可见RNA电泳条带清晰,28S与18S rRNA条带亮度接近2:1。因此,总RNA可用于进一步实验。
基因芯片扫描结果rAd-p53联合DDP与单独DDP处理的A549细胞的基因表达情况进行比较,43个基因表达差异2倍以上,其中15个基因表达显著上调,28个基因表达显著下调 (图1,表1、2)。
实时荧光定量PCR验证结果对照组A和实验组B样品的TP53、TNRSF6、ABCC4基因和作为内参的GAPDH基因分别进行实时PCR反应。实时荧光定量PCR时各样品上样量均为10μl,由于受RNA浓度定量误差和RNA逆转录效率误差等的影响,每个样品的10μl体积的cDNA含量并不完全相同,为校正此差异,使用GAPDH基因作为内参,以各基因的差异比除内参值,对各基因的差异比进行归一化。计算得到TP53、TNRSF6、ABCC4基因归一化后的差异比分别为13.26、2.20和0.64,基因芯片各基因的差异比分别为6.89、2.35和0.66。两个结果完全一致,TP53和TNRSF6基因表达上调而ABCC4基因表达下调。
讨 论
p53基因是重要的肿瘤抑制基因,编码的P53蛋白在细胞周期调控、DNA修复和诱导细胞凋亡等方面均具有关键性作用,因而被誉为“基因组保护神”。许多研究表明,P53能够影响多种细胞内信号传导通路,从而诱导细胞凋亡、抑制生长、激活或抑制某些信号通路和抑制血管新生等[3]。既往研究证实rAd-p53联合DDP显著提高对肿瘤细胞的抑制率[2],本研究采用功能分类基因芯片的方法进一步明确该作用的机制,本研究选用的人肿瘤相关基因芯片为寡核苷酸芯片,包含2 747个肿瘤相关基因的4 854个转录本,芯片上以4个人的看家基因GAPDH、ACTB、LDHA、RPS9作为阳性对照,点样溶液作为阴性对照。除了在芯片设计中采取质控措施外,还采用实时PCR的方法验证了基因芯片数据的可靠性。
本研究将rAd-p53联合DDP与单独DDP处理的A549细胞的基因表达情况进行比较,结果显示43个基因的表达差异具有统计学意义,包括CDKN1A(即p21)、 CCND1、 FAS、 TNFSF14、 BAK1、 TP53I3、MAD2L1、BTG2、EMP1、EDNRB、MDM2基因等。这些基因的功能涉及到细胞周期、细胞凋亡以及细胞增殖等细胞生命活动的各个方面。

表1 表达上调基因Table 1 Up-regulation genes
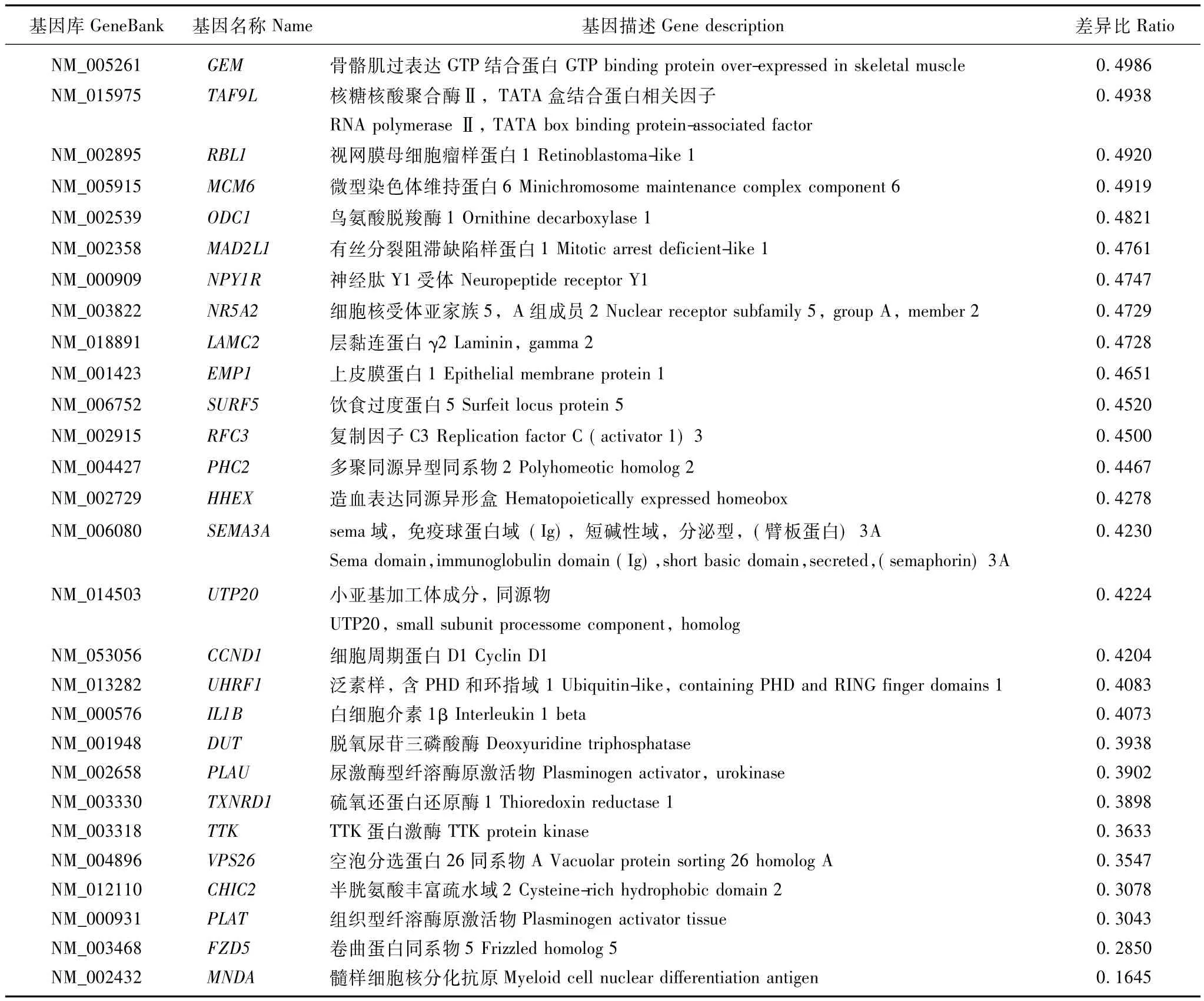
表2 表达下调基因Table 2 Down-regulation genes
rAd-p53干预后CDKN1A即p21基因表达上调。p21基因是p53的下游基因之一,一方面p21与细胞周期蛋白E/CDK2复合物结合,导致细胞的G1期阻滞,还与细胞周期蛋白A/CDK2结合而阻滞细胞于G2/M期;另一方面,p21还可与细胞增殖的速发早期基因增殖细胞核抗原、c-fos等结合阻断DNA复制,抑制细胞增殖[4]。CCND1基因编码的细胞周期蛋白D1蛋白过度表达可使细胞G1期缩短,细胞分裂速度加快而出现过度增殖。文献报道人体多种恶性肿瘤都有细胞周期蛋白Dl过表达,包括头颈部鳞癌、肝细胞癌及非小细胞肺癌等[5-6]。本研究CCND1基因表达下调可能与P53调控细胞周期、抑制细胞增殖有关。
细胞DNA损伤后,p53首先诱导细胞周期阻滞和DNA修复。如果损伤不能被修复,p53基因就通过下调抑制凋亡基因和上调促凋亡基因表达,诱导细胞凋亡。本研究rAd-p53导入后上调了FAS、TNFSF14、BAK1和TP53I3基因的表达,可能与p53诱导细胞凋亡有关。FAS基因即TNFRSF6,属于TNF受体超家族成员。Fas与它的天然配体FasL结合是Fas在体内发挥作用的唯一途径,也是细胞凋亡中最主要的途径之一[7]。Fas与FasL结合可激活天冬氨酸特异性半胱氨酸蛋白酶半胱天冬酶家族的一系列酶联反应,引起DNA降解和镜下可见的细胞及细胞核的凋亡形态学改变。TNFSF14基因编码的蛋白是TNF超家族 (TNFSF)第14个成员,具有促进细胞生长、分化或死亡的功能。Fan等[8]研究表明,NK细胞表面可表达TNFSF14的受体HVEM,TNFSF14与HVEM结合可促进NK细胞的激活、分化和IFN-γ的分泌。而NFSF14和IFN-γ协同可将Bcl-2从抗凋亡转为亲凋亡的形式,促进凋亡[9]。BAK1基因编码的蛋白质属于BCL-2蛋白家族,参与细胞凋亡的调变,是凋亡过程中一种重要的调节因子。TP53I3被p53诱导,参与p53介导的细胞死亡,编码的蛋白质是醌氧化还原酶的同源类似物,与细胞对氧化和照射应激有关,参与细胞活性氧物质的代谢,可能通过调控活性氧参与细胞凋亡。
P53引起的MAD2L1和BTG2基因表达下调也可抑制细胞增殖。MAD2L1基因编码的蛋白是细胞内的着丝粒相关蛋白—检查点蛋白的重要组成成分,在细胞分裂监控中具有关键作用[10-11]。MAD2基因的正常表达是保证细胞染色体正常分离的重要物质基础[12]。MAD2基因表达下降,可能导致部分染色体分离迟滞,甚至可能导致细胞分裂减缓或停止,使细胞增殖抑制[13-14]。BTG2基因是抗增殖基因家族中的一个新成员,是细胞生长的“监控器”。BTG2既可抑制周期素D1转录而降低其表达的蛋白水平,阻止细胞由G1期进入S期[15],还可阻止周期素B1和CDC2的结合抑制CDC2激酶活性发挥作用,诱导细胞 G2 期的停滞[16]。
rAd-p53导入肿瘤细胞后,p53基因表达显著上调,MDM2基因表达也显著增加。MDM2是p53基因的靶基因,编码核磷酸蛋白,主要通过与p53结合,形成p53-MDM2反馈环。p53基因表达上调后,诱导MDM2基因转录增强致使细胞中MDM2水平升高,并与p53结合形成复合物,从而抑制p53的转录激活。由于MDM2对p53的诱导凋亡和肿瘤抑制具有负反馈调节作用,提示可以在导入p53基因的同时,对MDM2的表达给予抑制,可能会进一步提高p53的抑瘤效果。
综上,rAd-p53作为基因治疗药物,导入并上调p53基因表达后,通过改变包括细胞周期、细胞增殖、细胞凋亡等一系列基因的表达,引起细胞周期阻滞、增殖抑制和凋亡增加,从而提高DDP对肿瘤的敏感性和杀伤效率。如果导入多个基因 (如p53协同基因)或抑制部分基因表达 (如MDM2基因),可能进一步增加抑瘤效率。另外,p53基因表达上调后,还有一些基因的表达变化是肿瘤细胞生长抑制后造成,还是p53基因直接作用的结果,尚不十分清楚。同时,由于本研究只是在基因水平通过寡核苷酸芯片的方法对rAd-p53作用后肿瘤细胞中相关基因表达变化进行初步筛选,缺少重复和蛋白质水平的进一步验证,因此,尚需要结合其他方法以及体内研究进一步证实。
[1]Osaki S,Nakanishi Y,Takayama K,et al.Alteration of drug chemosensitivity caused by the adenovirous-mediated transfer of the wild-type p53 gene in human lung cancer cells[J].Cancer Gene Ther,2000,7(2):300-307.
[2]汪进良,焦顺昌,叶平.rAd-p53联合顺铂体外抑制肺腺癌细胞增殖的最佳作用时序研究 [J].现代肿瘤医学,2008,16(3):339-341.
[3]Vousden KH,Lu X.Live or let die:the cells'response to p53 [J].Nat Rev Cancer,2002,2(8):594-604.
[4]Cazzalini O,Perucca P,Savio M,et al.Interaction of p21(CDKN1A)with PCNA regulates the histone acetyltransferase activity of p300 in nucleotide excision repair [J].Nucleic Acids Res,2008,36(5):1713-1722.
[5]Belaud-Rotureau MA,Parrens M,Dubus P,et al.A comparative analysis of FISH,RT-PCR,PCR,and immunohistochemistry for the diagnosis of mantle cell lymphomas [J].Mod Pathol,2002,15(5):517-525.
[6]Holley SL,Parkes G,Matthias C,et al.Cyclin D1 polymorphism and expression in patients with squamous cell carcinoma of the head and neck [J].Am J Pathol,2001,159(5):1917-1924.
[7]江中勇,杨凌,陈清勇,等.Fas/FasL与肺癌关系的研究进展 [J].国外医学·呼吸系统分册,2005,25(2):115-117.
[8]Fan Z,Yu P,Wang Y,et al.NK-cell activation by LIGHT triggers tumor-specific CD8+T-cell immunity to reject established tumors [J].Blood,2006,107(4):1342-1351.
[9]Zhang MC,Liu HP,Demchik LL,et al.LIGHT sensitizes IFN-gamma-mediated apoptosis of HT-29 human carcinoma cells through both death receptor and mitochondria pathways[J].Cell Res,2004,14(2):117-124.
[10]Rieder CL,Cole RW,Khodjakov A,et al.The checkpoint delaying anaphase in response to chromosome monoorientation is mediated by an inhibitory signal produced by unattached kinetochores [J].J Cell Biol,1995,130(4):941-948.
[11]Steuerwald N,Cohen J,Herrera RJ,et al.Association between spindle assembly checkpoint expression and maternal age in human oocytes [J].Mol Hum Reprod,2001,7(1):49-55.
[12]Nicklas RB,Campbell MS,Ward SC,et al.Tension-sensitive kinetochore phosphorylation in vitro [J].J Cell Sci,1998,111(Pt 21):3189-3196.
[13]Meraldi P,Draviam VM,Sorger PK.Timing and checkpoints in the regulation of mitotic progression [J].Dev Cell,2004,7(1):45-60.
[14]Vigneron S,Prieto S,Bernis C,et al.Kinetochore localization of spindle checkpoint proteins:who controls whom [J].Mol Biol Cell,2004,15(10):4584-4596.
[15]Guardavaccaro D,Corrente G,Covone F,et al.Arrest of G(1)-S progression by the p53-inducible gene PC3 is Rb dependent and relies on the inhibition of cyclin D1 transcription[J].Mol Cell Biol,2000,20(5):1797-1815.
[16]Ryu MS,Lee MS,Hong JW,et al.TIS21/BTG2/PC3 is expressed through PKC-delta pathway and inhibits binding of cyclin B1-Cdc2 and its activity,independent of p53 expression [J].Exp Cell Res,2004,299(1):159-170.
图1 芯片杂交的伪色图Fig 1 Pseudo-color map of gene chip hybridization

