拟南芥PIN2介导的生长素极性运输调控植物根向地性*
潘建伟, 叶晓帆, 王 超, 涂世伟
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
拟南芥PIN2介导的生长素极性运输调控植物根向地性*
潘建伟, 叶晓帆, 王 超, 涂世伟
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
主要观察了拟南芥生长素输出载体PIN2及其介导的极性运输、生长素诱导合成对根尖生长素不对称分布和根向地性反应的影响.结果表明:拟南芥PIN2基因突变、诱导内源生长素IAA及用抑制剂NPA或TIBA抑制生长素极性运输都严重影响了根尖生长素不对称分布的形成,最终抑制植物根向地性反应,暗示PIN2介导的生长素极性运输和生长素不对称分布在根向地性反应中起着关键性调控作用.从这些研究结果可进一步理解生长素调控植物根向地性的分子机理.
拟南芥;生长素;PIN2;极性运输;根向地性
生长素极性运输(polar auxin transport,PAT)在植物胚胎、侧生器官的发生与发育、向性生长(tropism)中起了关键性的调控作用,已成为植物发育生物学领域中的研究热点之一.生长素极性运输由定位于细胞膜上的输入载体AUX1/LAX家属(auxin resistant 1/like AUX1 family)[1]和输出载体PIN家属(pin-formed family)[2]协同完成,其中PIN蛋白在细胞膜上的极性定位决定了生长素的极性流向[3-5].生长素不对称分布在植物胚胎发生、器官发育、向性生长过程中起着重要作用[6-9].
在拟南芥基因组中,PIN基因共有8个同源基因(PIN1-PIN8),其中PIN1,PIN2,PIN3,PIN4,PIN5和PIN7的功能已被鉴定[3,6,7,10-13].尽管各种PIN蛋白在细胞水平上的生物学功能相同,即将生长素从胞内运到胞外或某种细胞器内,但这种功能却具有组织和器官特异性.PIN1主要在器官发生和维管组织分化中起作用[3],PIN2主要在植物根向地性(gravitropism)生长中起作用[10],PIN3主要在茎和根的向性生长中起作用[6],PIN4主要在根尖分生组织中起作用[11],PIN5主要在维持胞内生长素稳态中起作用[13],PIN7主要在早期胚胎发育中起作用[7].
植物根系向地性是决定根系空间生长趋势的主要因素之一,对于植物养分吸收(尤其是磷的吸收)具有重要影响[14].因此,深入研究植物根系向地性的分子机理对作物根系遗传改良具有理论和实验指导意义.本研究主要观察了拟南芥野生型根尖受到重力刺激后,PIN2和生长素在根尖的分布;pin2突变对根尖生长素分布及向地性的影响;根尖内源生长素诱导对生长素的分布及向地性反应的影响;抑制生长素极性运输对生长素的分布及向地性的影响.弄清这些问题对进一步理解生长素调控植物根向地性的分子机理具有重要意义.
1 材料与方法
1.1实验材料与生长条件
本研究中所用拟南芥(Arabidopsisthaliana)生态型为Col-0(Columbia-0),表达载体PIN2∶∶PIN2∶GFP[15],WOX5∶∶IAAH[16],DR5∶∶GFP[12]分别由Ben Scheres和Jiri Friml等实验室提供,pin2突变体(T-DNA插入突变体)购自美国俄亥俄州立大学拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC).生长素极性运输抑制剂NPA(N-1-naphthylphthalamic acid),TIBA(2,3,5-triiodobenzoic acid)和生长素前体物质IAM(indole-3-acetamide)均购自Sigma公司,配制方法参考文献[17].
拟南芥种子经表面消毒后,在4 ℃黑暗处理3 d,然后在含1.5%琼脂的1/2 MS培养基(Sigma公司)表面上萌发,培养皿竖直放置,生长条件为:24 ℃ 16 h光照/22 ℃ 8 h黑暗,70%~80%相对湿度和6 000 lx光照强度.萌发5 d后的根用于本研究的所有实验.
1.2激光共聚焦分析
本研究中使用的激光共聚焦显微镜型号为Leica TCS SP5 AOBS,激发光波长为488 nm,发射光波长为510 nm,所有实验均在相同设置下完成,并独立重复3次.用Image J软件对质膜上极性定位的PIN2-GFP进行定量分析.
1.3根尖向地性测定
将长有20株5 d幼苗的培养皿旋转90°,进行重力刺激2 h,然后用数码相机拍照,再用Image J软件测量根尖向重力方向弯曲的角度.所有实验均独立重复3次.对于化学试剂处理实验,在重力刺激前,小心地将幼苗转移到分别含有1 μmol/L IAM,10 μmol/L NPA,10 μmol/L TIBA的1/2 MS培养基表面上,先竖直预处理2 h,然后再旋转90°重力刺激2 h,再进行拍照与测量.
2 结 果
2.1根尖PIN2极性定位与不对称分布诱导植物根向地性反应
拟南芥PIN2基因突变使根失去向地性反应(见图1中A和B),暗示PIN2在根向地性反应中具有重要功能.利用PIN2∶∶PIN2∶GFP表达载体[15]可进一步分析PIN2基因的表达区域、PIN2蛋白亚细胞定位及重力刺激对PIN2蛋白的影响.如图1中C和D所示,拟南芥PIN2基因主要在根尖表皮细胞和皮层细胞中表达,PIN2∶GFP融合蛋白极性定位于表皮细胞顶端质膜上、幼嫩皮层细胞下端质膜上、成熟皮层细胞顶端质膜上(图1中未显示成熟皮层细胞).当重力刺激(即根处于水平方向)2 h,PIN2∶GFP融合蛋白在根尖上、下两侧呈不对称分布(上少下多)(见图2中A和B).进一步的定量分析表明,在无重力刺激下(即根处于竖直向下的方向),根尖左、右两侧的PIN2∶GFP水平无显著性差异(t-检验,Pgt;0.05),而在2 h的重力刺激下,根尖上、下两侧的PIN2∶GFP水平存在极显著性差异(t-检验,Plt;0.01)(见图2中C).这一结果暗示根尖PIN2不对称分布很可能诱导了根向地性反应.

A—萌发5 d的野生型Col-0;B—萌发5 d的pin2突变体;C—PIN2∶∶PIN2∶GFP Col-0根尖结构及其PIN2∶GFP亚细胞定位 D—图C中虚线框内的放大图.表示重力方向;▽表示PIN2∶GFP融合蛋白在表皮细胞和皮层细胞中的极性定位1—根尖侧根冠细胞;2—表皮细胞;3—皮层细胞;4—内皮层细胞;5—中柱细胞;6—根冠细胞;7—静止中心;8—分生组织图1 拟南芥根向地性反应与根尖PIN2极性定位
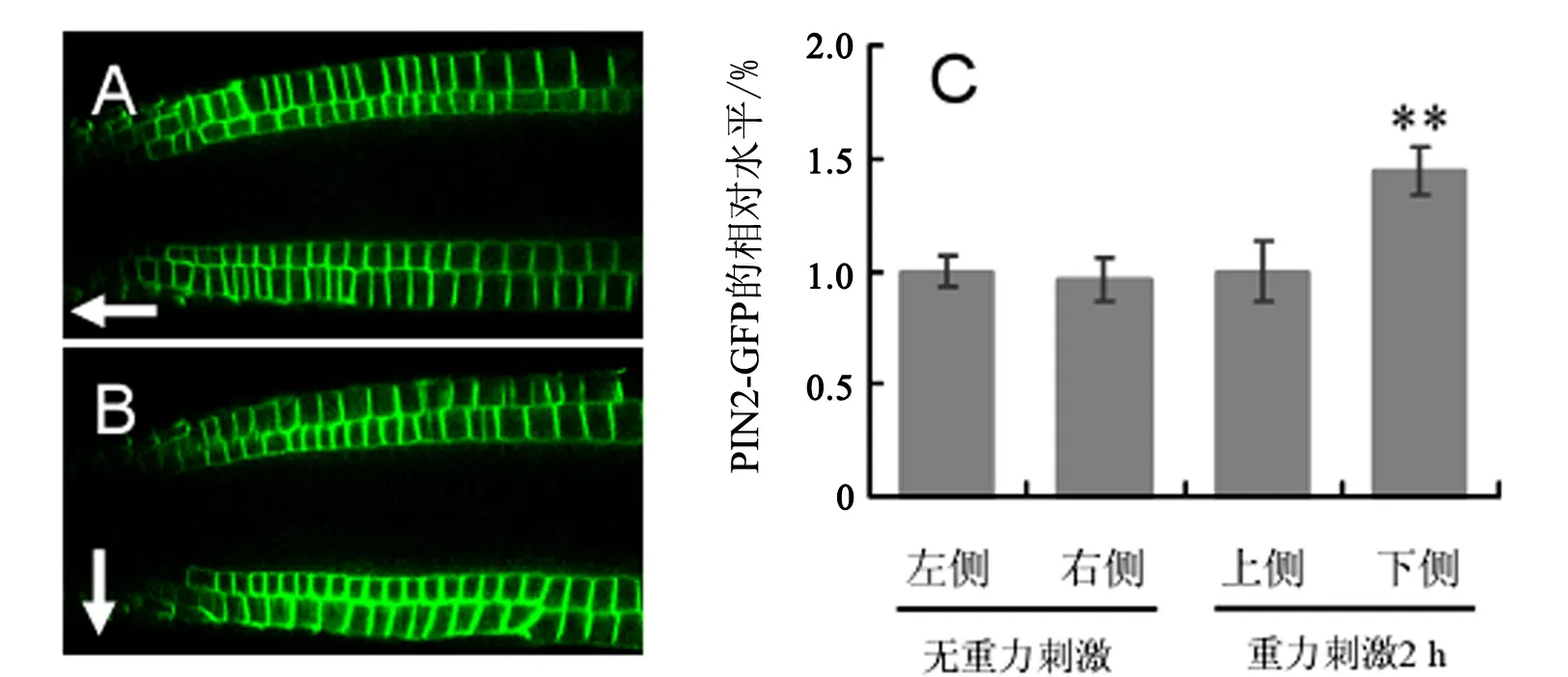
A—在无重力刺激下,PIN2∶GFP在根尖左、右的分布;B—重力刺激2 h,PIN2∶GFP在根尖上、下的不对称分布 C—图A和B中PIN2∶GFP在根尖左、右或上、下的相对水平.表示重力方向;**表示有极显著性差异(t-检验,Plt;0.01)图2 重力刺激对根尖PIN2分布的影响
2.2PIN2介导根尖生长素不对称分布
为进一步揭示PIN2诱导根向地性反应的机理,对根尖生长素分布进行了测定.由于DR5是一个生长素反应的强启动子,利用DR5∶∶GFP表达载体可间接反映生长素在某一组织或器官中的水平与分布[12].如图3中A和B所示,在无重力刺激下,GFP在根冠细胞、侧根冠细胞、静止中心、根尖分生组织、中柱细胞等均有较强的表达,但在根尖左、右两侧的表皮细胞中并没有明显的表达,表明:根尖在竖直生长过程中,生长素在前述组织中均有大量积累,而在根尖表皮细胞中没有明显的积累.在2 h重力刺激下,GFP除了在上述提到的区域表达外,在根尖下侧表皮细胞中也有较强的表达,而在根尖上侧没有明显的表达,这反映了生长素在根尖下侧比上侧多.这一结果表明:在根尖向地性反应过程中,生长素在根尖上、下两侧的分布是不对称的.
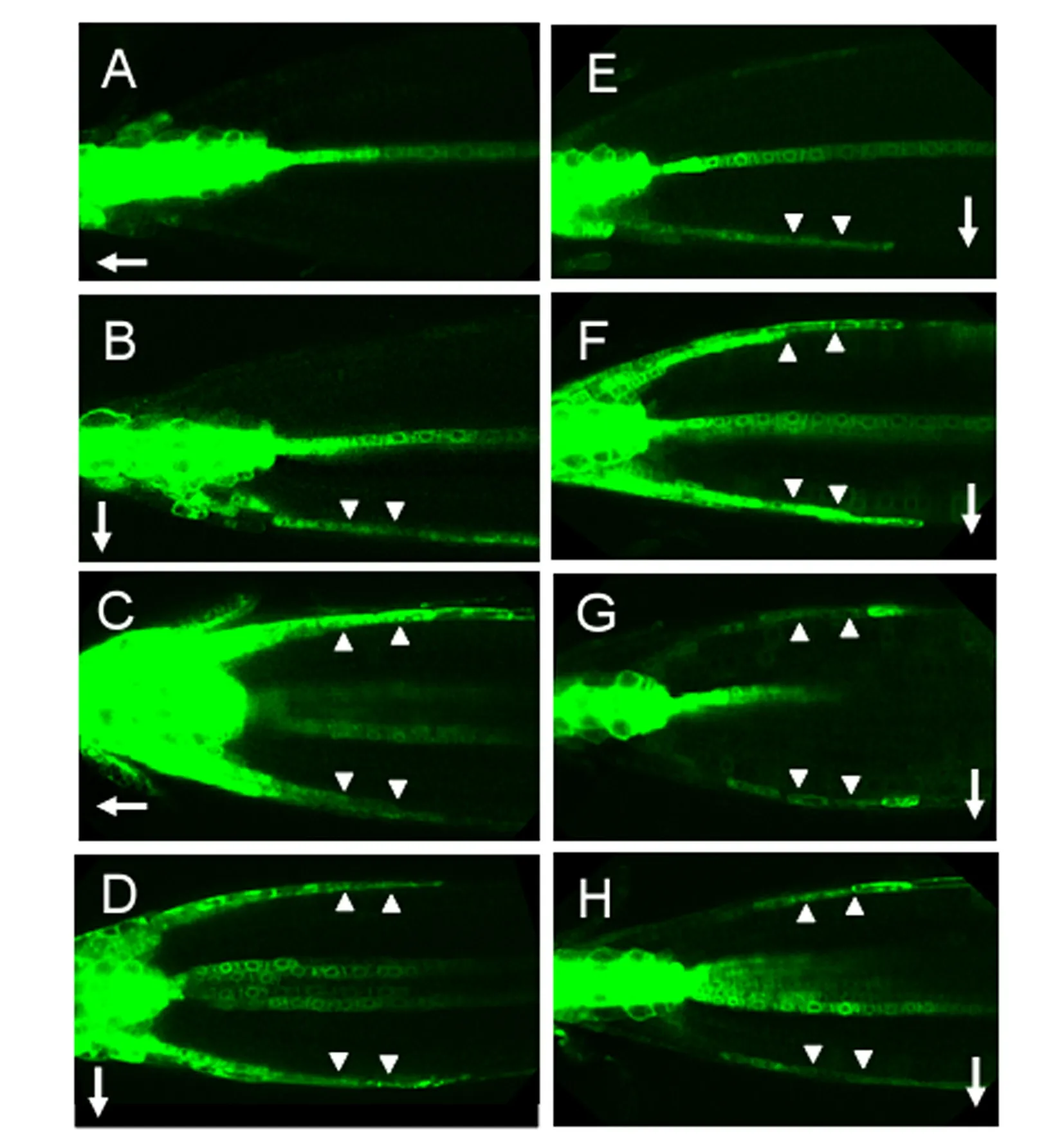
A—DR5∶∶GFP Col-0,无重力刺激;B—DR5∶∶GFP Col-0,重力刺激2 h;C—DR5∶∶GFP pin2,无重力刺激D—DR5∶∶GFP pin2,重力刺激2 h;E—DR5∶∶GFP WOX5∶∶IAAH,无IAM处理但重力刺激2 hF—DR5∶∶GFP WOX5∶∶IAAH,先1 μmol/L IAM处理2 h,再重力刺激2 hG—DR5∶∶GFP Col-0,先10 μmol/L NPA处理2 h,再重力刺激2 hH—DR5∶∶GFP Col-0,先10 μmol/L TIBA处理2 h,再重力刺激2 h表示重力方向;▽表示生长素在根尖两侧的分布图3 pin2,生长素合成及其运输对根尖生长素不对称分布的影响
为弄清PIN2在诱导生长素不对称分布中是否起调控作用,进一步观察了pin2突变体根尖生长素的分布情况.如图3中C和D所示,不管有无重力刺激,GFP在根尖上、下两侧均有较强的表达,说明pin2突变后根尖生长素的不对称分布消失.这些证据充分表明:PIN2对根尖生长素不对称分布具有重要调控作用.
2.3诱导内源生长素和抑制极性运输对根尖生长素分布的影响
在根尖重力刺激前,外源生长素的处理将使根尖生长素失去不对称分布(图略).然而,内源生长素过量合成是否也同样会导致根尖生长素不对称的消失?利用WOX5∶∶IAAH[16]和DR5∶∶GFP[12]2个表达载体可回答这一问题.WOX5是一个根尖静止中心特异性表达启动子,IAAH是吲哚乙酰胺水解酶(indole-3-acetamide hydrolase,IAAH)基因,IAAH能水解IAA前体吲哚乙酰胺(indole-3-acetamide,IAM)而释放出吲哚乙酸IAA.因此,IAM处理后,WOX5∶∶IAAH能在根尖静止中心源源不断地释放出游离的IAA,以模拟根尖内源生长素流.如图3中E和F所示,无IAM处理但重力刺激2 h后,GFP表达与图3中B完全一致,均在根尖下侧表达;而先用IAM处理、再重力刺激2 h后,GFP在根尖上、下两侧均有表达,与图3中D相似.这一结果表明内源生长素过量诱导将导致根尖生长素不对称分布的消失,同时也暗示内源生长素生物合成途径的精确调控对生长素介导的根向地性具有重要意义.
已有的研究暗示PIN2的主要功能是介导根尖生长素的极性运输[10,18],但仍然不清楚抑制或破坏生长素的极性运输是否会影响生长素不对称分布.利用已知生长素极性运输抑制剂NPA(N-1-naphthylphthalamic acid)和TIBA(2,3,5-triiodobenzoic acid)能证实这一点.如图3中G和H所示,先用NPA或TIBA预处理,再用重力刺激2 h后,GFP在根尖上、下两侧均有表达,表明抑制极性运输将导致根尖生长素不对称分布的消失.因此,以上证据进一步支持PIN2的不对称分布及其介导的生长素极性运输是根尖生长素不对称分布的主要原因.
2.4PIN2介导的生长素不对称分布诱导植物根向地性反应
为证实PIN2介导的生长素极性运输、根尖生长素的不对称分布是否在根向地性反应中起作用,在上述相同实验条件下进一步测定了根向地性反应.如图4所示,与正常对照相比,pin2突变、内源生长素的过量诱导、生长素极性运输抑制剂NPA和TIBA均显著性地抑制了根向地性的反应(t-检验,Plt;0.05或0.01).以上结果充分证实PIN2介导的极性运输通过生长素的不对称分布来调控植物根向地性反应,暗示PIN2介导的生长素不对称分布是诱导植物根向地性反应的必要条件.
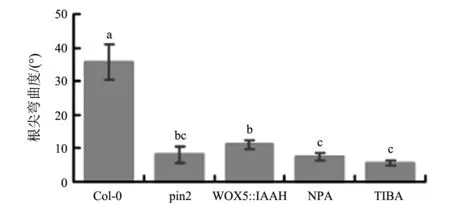
不同字母之间表示有显著或极显著性差异(t-检验,Plt;0.05或0.01)图4 pin2,生长素合成及其运输对植物根向地性反应的影响
3 讨 论
本研究结果表明:在根向地性反应过程中,PIN2蛋白在根尖上、下两侧呈不对称分布,从而诱导了生长素的不对称分布.然而,重力如何诱导PIN2在根尖上、下两侧呈不对称分布?近几年的研究表明:当根受到重力刺激后,在根冠细胞表达的PIN3亚细胞定位由原先无极性分布快速(几min内)转变成极性分布(靠重力方向的细胞膜),导致更多的生长素流向根尖下侧面[6].笔者最近的研究表明:更多的生长素流向根尖下侧细胞将诱导更多的PIN2表达并极性定位于细胞顶端质膜上[17],而根尖上侧面由于生长素的减少使质膜上极性定位的PIN2随之减少[19],最终导致根尖上、下两侧PIN2呈不对称分布(上少、下多).文献[17]利用遗传学、细胞学等方法进一步发现了在生长素受体突变背景下(即生长素信号传导途径受阻),生长素未能诱导PIN2在根尖上、下两侧的不对称分布,表明生长素通过其信号传导途径调控PIN2的不对称分布.
从上述分析与本研究结果可以得出:对于根向地性反应来说,生长素生物合成、生长素极性运输和生长素信号传导三者之间缺一不可,并通过相互之间的正、反调控来精确地控制根向地性反应,只要其中一个过程受到影响,必将影响根尖向地性的正常反应.生长素在幼嫩组织中合成后,由PIN蛋白将其运输到发挥作用的特定位点,然后通过其信号传导途径对相应的组织或器官的发育或向性生长进行调控.具体地说,当PIN2将生长素运输到根尖下侧伸长区时,生长素通过其信号传导途径抑制根尖下侧伸长区细胞的伸长,最终由于根尖上侧细胞伸长比下侧细胞快而引起根尖向下弯曲生长.
值得一提的是,本研究过程中发现pin2突变体根尖上、下两侧均有生长素的梯度分布,而Abas等[9]的观察表明eirl-4/pin2突变体根尖上、下两侧均没有生长素分布与积累,这可能起因于两家实验室的实验条件不一致,尤其是生长条件的不同将造成植物根尖生长素积累水平的不同,从而引起生长素分布模式不同.但有一点可以肯定,受重力刺激的pin2突变体中,根尖生长素分布不会出现明显的不对称分布.
[1]Swarup K,BenkovE,Swarup R,et al.The auxin influx carrier LAX3 promotes lateral root emergence[J].Nature Cell Biology,2008,10(8):946-954.
[3]Gälweiler L,Guan Changhui,Müller A,et al.Regulation of polar auxin transport by AtPIN1 inArabidopsisvascular tissue[J].Science,1998,282(5397):2226-2230.
[5]Grieneisen V A,Xu Jian,Maree A F,et al.Auxin transport is sufficient to generate a maximum and gradient guiding root growth[J].Nature,2007,449(7165):1008-1013.
[7]Friml J,Vieten A,Sauer M,et al.Efflux-dependent auxin gradients establish the apical-basal axis ofArabidopsis[J].Nature,2003,426(6963):147-153.
[8]Blilou I,Xu Jian,Wildwater M,et al.The PIN auxin efflux facilitator network controls growth and patterning inArabidopsisroots[J].Nature,2005,433(7021):39-44.
[9]Abas L,Benjamins R,Malenica N,et al.Intracellular trafficking and proteolysis of theArabidopsisauxin-efflux facilitator PIN2 are involved in root gravitropism[J].Nature Cell Biology,2006,8(3):249-256.
[10]Chen Rujin,Hilson P,Sedbrook J,et al.TheArabidopsisthaliana AGRAVITROPIC 1 gene encodes a component of the polar-auxin-transport efflux carrier[J].PNAS,1998,95(25):15112-15117.
[11]Friml J,BenkovE,Blilou I,et al.At PIN4 mediates sink-driven auxin gradients and root patterning inArabidopsis[J].Cell,2002,108(5):661-673.
[13]Mravec J,Skupa P,Bailly A,et al.Subcellular homeostasis of phytohormone auxin is mediated by the ER-localized PIN5 transporter[J].Nature,2009,459(7250):1136-1140.
[14]石江华,廖红,严小龙.植物根系向地性感应的分子机理与养分吸收[J].植物学通报,2005,22(5):523-531.
[15]Xu Jian,Scheres B.Dissection ofArabidopsisADP-RIBOSYLATION FACTOR 1 functions in epidermal cell polarity[J].Plant Cell,2005,17(2):525-536.
[16]Xu Jian,Hofhuis H,Heidstra R,et al.A molecular framework for plant regeneration[J].Science,2006,311(5759):385-388.
[17]Pan Jianwei,Fujioka S,Peng Jianling,et al.The E3 ubiquitin ligase SCFTIR1/AFBand membrane sterols play key roles in auxin regulation of endocytosis,recycling, and plasma membrane accumulation of the auxin efflux transporter PIN2 inArabidopsisthaliana[J].Plant Cell,2009,21(2):568-580.
[18]Shin H,Shin H S,Guo Zibiao,et al.Complex regulation ofArabidopsisAGR1/PIN2-mediated root gravitropic response and basipetal auxin transport by cantharidin-sensitive protein phosphatases[J].Plant J,2005,42(2):188-200.
[19]Kleine-Vehn J,Leitner J,Zwiewka M,et al.Differential degradation of PIN2 auxin efflux carrier by retromer-dependent vacuolar targeting[J].PNAS,2008,105(46):17812-17817.
(责任编辑 薛 荣)
PIN2-mediatedpolarauxintransportregulationofrootgravitropisminArabidopsisthaliana
PAN Jianwei, YE Xiaofan, WANG Chao, TU Shiwei
(CollegeofChemistryandLifeScience,ZhejiangNormalUniversity,JinhuaZhejiang321004,China)
Auxin efflux carrier PIN2, PIN2-mediated polar auxin transport (PAT) and induced auxin synthesis effects on auxin nonsymmetric distribution and gravity response were examined inArabidopsisroots. It was showed that mutatedpin2, endogenously induced IAA and inhibition of PAT with NPA or TIBA severely impaired auxin nonsymmetric distribution and in turn inhibited root gravity response, indicated that PIN2-mediated PAT could regulate root gravity response through modulating auxin nonsymmetric distribution in the root tip. These findings would be helpful to understand the molecular mechanisms underlying auxin regulation of root gravitropism in plants.
Arabidopsisthaliana; auxin; PIN2; polar auxin transport; root gravitropism
1001-5051(2010)01-0001-06
2009-12-23
国家自然科学基金资助项目(30970255);国家科技重大研究专项(2009ZX08009-076B)
潘建伟(1969-),男,浙江绍兴人,校特聘教授,博士.研究方向:植物发育遗传学.
Q945.7
A

