小麦矮腥黑粉菌及其近缘种的RPB2基因片段序列分析
高 飞, 高 利, 刘太国, 高继国, 陈万权*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
RNA聚合酶(DNA-dependent RNA polymerases)在基因表达的过程中扮演着很重要的角色。早在1984年以前,生物化学家就已经在真核生物中成功地分离出3种RNA聚合酶[1]。其中,RNA聚合酶II由12个亚基组成(RPB1~RPB12),负责转录生成hnRNA和 mRNA[2]。RPB2(the second largest RNA polymerase subunit)基因负责编码RNA聚合酶II的第2大亚基,具有单拷贝和进化速率慢的特点[3]。RPB2基因片段与其他不同基因片段如ITS(internal transcribed spacer)、RPB1 、EF(elongation factor)等相结合,目前已广泛地应用于真菌的分类和系统发育研究[4-6]。
小麦矮腥黑粉菌(Tilletia controversa Kühn,简称TCK)引起的小麦矮腥黑穗病是一种重要的国际检疫性病害,对小麦生产造成严重的危害[7-8],也是我国外来生物入侵研究的主要物种之一[9]。与其近缘的小麦网腥黑粉菌、小麦光腥黑粉菌也是引起小麦病害的重要病原菌。3种真菌在形态学上极为相似,难以区别。随着分子生物学的迅猛发展,从分子水平上寻找三者的差异成为植病学者研究的目标。
1 材料与方法
1.1 材料
1.1.1 供试菌株
小麦矮腥黑粉菌共12个菌株分别来源于美国(11个)、捷克(1个),小麦光腥黑粉菌(T.laevis Kühn,简称 TLK)共 6个菌株,除 1个来自捷克外,其余来自国内不同地区,均由中国农业科学院植物保护研究所麦病组收存;小麦网腥黑粉菌[T.caries(DC.)Tul.,简称 TCT]共8个菌株,除1个来自捷克外,其余由重庆大学王中康教授提供。此外,还选用了相近的其他6种真菌(见表1)。
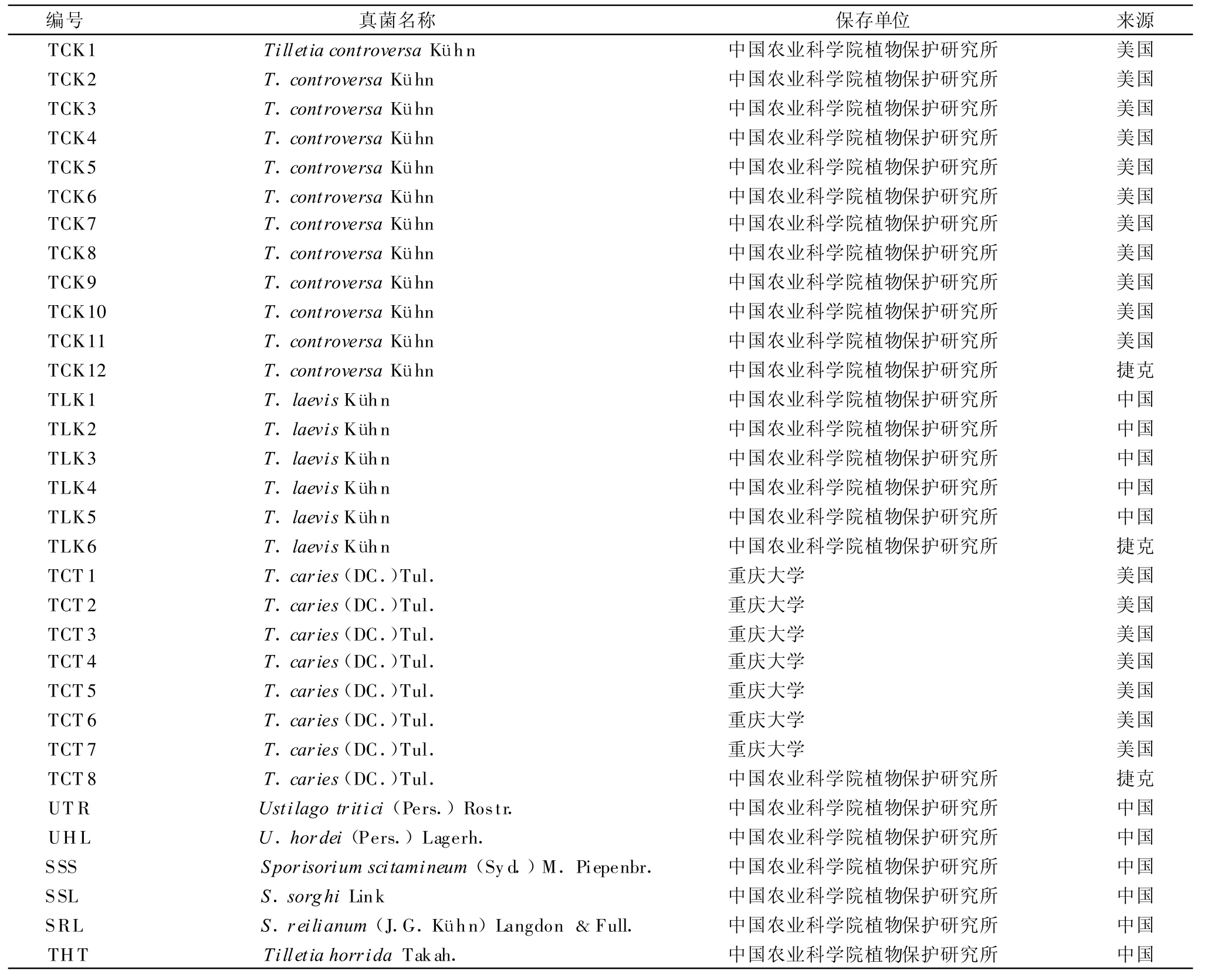
表1 供试菌株及来源
1.1.2 试剂与仪器
Taq DNA 聚合酶、dNTP、Mg2+、质粒提取试剂盒购于天根生化科技公司;克隆载体p MD18-T、IPTG、X-Gal购于宝生物工程有限公司;琼脂糖凝胶试剂盒购于Axygen公司;试验中涉及的引物及设计的特异引物由上海生物工程公司合成。高速冷冻离心机(Sigma)、紫外分光光度计(Nano Drop)、PCR仪(MJ Research)、凝胶成像系统(Bio-Rad)等仪器由中国农业科学院植物保护研究所麦病组配备。
1.2 基因组DNA的提取
采用改良的SDS法提取基因组DNA[10],DNA用0.8%的琼脂糖凝胶电泳检测,并用Nano Drop公司生产的紫外分光光度计检测各个菌系DNA浓度与纯度。
1.3 RPB2基因片段的扩增
扩增RPB2基因片段的引物为RPB2-740F/RPB2-1365R(RPB2-740F:GATGGACGCGGTTTGTAATG;RPB2-1365R:TCGAAGAGCYAACACTGAGACG)[6]。扩增程序为:94℃5 min;94℃30 s,55℃30 s,72℃1 min,30个循环;72℃10 min。
PCR反应体系为25μL,其中包含:10×PCR buffer 2.5 μL、Mg2+(25 mmol/L)2 μL 、dNTPs(10 mmol/L)0.3μL、Taq DNA 聚合酶(2.5 U/μL)0.3 μL、引物(10 μmol/L)各 1 μL 、DNA 模板(20 ng/μL)1μL、用灭菌双蒸水补足25μL。
1.4 PCR产物的克隆与测序
将PCR产物用1%的琼脂糖凝胶进行电泳,电泳后在紫外灯下将扩增的条带切下,用DNA回收试剂盒进行纯化(Axygen公司)。纯化后的产物连接到载体pMD18-T上(TaKaRa公司),转化到大肠杆菌DH5α感受态细胞中。通过蓝白斑筛选,挑取白色菌落经过菌液PCR及质粒酶切鉴定阳性克隆子后,交由上海生物工程公司测序。
1.5 序列分析及比对
将3种小麦腥黑粉菌的RPB2基因片段的序列用DNAMAN软件进行分析,比对它们之间的序列差异,并将3种小麦腥黑粉序列片段在GenBank上进行同源序列比较。
1.6 将RPB2通用引物作为TCK特异引物的内置对照引物扩增
以RPB2的通用引物作为小麦腥黑粉菌属的内置对照引物与小麦矮腥黑粉菌特异性引物CQUTCK2/CQUTCK3(CQUTCK2:TCTAACTTACCTCGCGGATGG;CQUTCK3:ACGCAGTGACGGGTGGATA)[11]相结合进行共同扩增。扩增程序为:94℃5 min;94℃30 s,55℃30 s,72℃1 min,30个循环;72℃10 min。
PCR反应体系为25μL,其中包含:10×PCR buffer 2.5 μL、Mg2+(25 mmol/L)2 μL 、d NTPs(10 mmol/L)0.3μL、Taq DNA 聚合酶(2.5 U/μL)0.3 μL、引物 CQUTCK2/CQUTCK3,RPB2-740F/RPB2-1365R(10 μmol/L)各 1 μL、DNA 模板(20 ng/μL)1μL、用灭菌双蒸水补足25μL。
2 结果
2.1 RPB2基因片段的扩增结果
对3种小麦腥黑粉菌的不同菌株及相近的3个属的6种真菌进行PCR扩增,小麦矮腥黑粉菌、小麦网腥黑粉菌和小麦光腥黑粉菌均能扩增出一条大约600 bp的条带,而与小麦腥黑粉菌相近的其他6种真菌均没有扩增产物(图1)。说明该通用引物可以作为小麦腥黑粉菌的特异性引物区分与其近似的其他黑粉菌。

图1 RPB2基因引物RPB2-740F/RPB2-1365R对不同真菌基因组DNA的PCR扩增
2.2 RPB2基因片段的测序结果
测序结果表明,小麦矮腥黑粉菌、小麦网腥黑粉菌和小麦光腥黑粉菌扩增的 RPB2基因片段大小均为617 bp,G+C含量差别很小,分别为59.6%、59.5%和 59.5%。说明三者的亲缘关系较近。
2.3 RPB2基因片段序列分析
通过BLAST将小麦矮腥黑粉菌、小麦网腥黑粉菌和小麦光腥黑粉菌所测序列分别与其对应的GenBank中已经公布的同源序列(EU257590、EU257596、EU257607)比 对,相 似 性 分 别 为97.96%、97.59%和97.27%,表明测序结果准确。再通过DNAMAN软件进行分析,3种小麦腥黑粉菌的RPB2基因片段相似性为99.08%,存在着17个碱基的差异(图2)。其中,小麦矮腥黑粉菌和小麦光腥黑粉菌亲缘关系更近。

图 2 TCK、TCT和TLK的RPB2基因序列测序结果
2.4 RPB2基因的通用引物作为内置对照引物的扩增结果
引物 CQUTCK2/CQUTCK3、RPB2-740F/RPB2-1365R分别能扩增出747 bp和617 bp的条带。将2对引物相结合进行PCR扩增,TCK可以扩增出747 bp和617 bp的2条带,3种小麦腥黑粉菌均能扩增出617 bp的条带,而其他6种真菌均不能扩增出任何条带(图3)。说明 RPB2基因的通用引物可以作为小麦腥黑粉菌的通用引物,与 TCK的特异性引物相结合可以避免PCR反应的假阳性及假阴性,提高 TCK分子检测的准确性。

图3 RPB2基因引物RPB2-740F/RPB2-1365R和TCK特异引物CQUTCK2/CQUTCK 3的PCR扩增
3 讨论
RPB2作为编码RNA聚合酶II的第2大亚基核的基因片段,主要负责蛋白质编码基因的转录[12]。到目前为止,通过对拟南芥、番茄和杜鹃的核酸杂交试验已经证实了 RPB2基因是单拷贝的[13]。研究发现,RPB2编码的氨基酸序列在人类、果蝇、真菌和植物间具有高度的保守性[14]。因此,RPB2基因在研究生物的系统发育方面具有很高的价值。目前,国外已 将 RPB2基因与 ITS[5]、RPB1[2,5]、EF[6]、β-tubulin[15]等基因片段结合对植物及真菌进行分类及系统发育研究,国内目前尚没有相关的研究报道。
根据1999年12月2日签署的《中美农业合作协议》,我国对等于或低于允许量(50 g小麦样品中3万个TCK孢子)的美国小麦应不采取任何特殊措施直接进入中国国内任何一个地区,入世后美国及其他国家TCK疫区的小麦会继续大量出口我国,随着TCK疫区输华小麦总量上升,随疫麦进口带入的TCK冬孢子必然呈总体上升趋势,这将对我国的小麦生产构成极大威胁。小麦矮腥黑粉菌与其近缘种小麦光腥黑粉菌、小麦网腥黑粉菌在孢子形态上极为相似,仅仅依靠形态学特征难以区分,准确性较差,而生化鉴定操作时间较长[11]。寻找小麦腥黑粉菌的特异性基因片段序列,并利用其进行系统分类是一种切实可行的方法。目前,一些学者对小麦矮腥黑粉菌、小麦光腥黑粉菌和小麦网腥黑粉菌的ITS[16]、IGS[17]基因片段进行了研究,并通过对IGS区的序列分析设计出小麦光腥黑粉菌的特异引物。陈万权等[18]采用AFLP引物对小麦腥黑粉菌基因组DNA进行扩增,发现了小麦矮腥黑粉菌的特异性分子标记。在其他基因片段的研究方面,目前尚没有相关的报道。本试验通过对3种小麦腥黑粉菌的RPB2基因片段的研究,分析了3种小麦腥黑粉菌在RPB2基因片段上的差异以及亲缘关系,这为后续的特异性引物开发以及黑粉菌的系统发育研究奠定了基础。利用RPB2基因片段引物结合小麦矮腥黑粉菌的特异引物做内置对照进行PCR扩增,可作为小麦矮腥黑粉菌PCR检测的辅助手段,以提高检测的准确性。
[1] Archambault J,Friesen J D.Genetics of eukary otic RNA polymerases I,II,and III[J].Microbiology and Molecular Biology Reviews,1993,57(3):703-724.
[2] Wei W,Dorjbal D,Lin Y,et al.Direct interaction between the subunit RAP30 of transcription factor IIF(TFIIF)and RNA polymerase subnit 5(RPB5)which contributes to the association between TFIIF and RNA polymeraseⅡ[J].J Biol Chem,2001,276(15):12266-12273.
[3] Murakami S.Hepatitis B virus X p rotein:structure,function and biology[J].Intervirology,1999,42(2-3):81-99.
[4] Reeb V,Lutzoni F,Roux C.Contribution of RPB2 to multilocusphylogenetic studiesof the euascomycetes(Pezizomycotina,Fung)with special emphasis on the lichen-forming Acarosp oraceae and evolution of polyspory[J].Molecular Phylogenetics and Evolution,2004,32:1036-1060.
[5] Frøslev T G,Matheny P B,Hibbett D S.Lower level relationships in the mushroom genus Cortinar ius(Basidiomycota,Agaricales):a comparison of RPB1,RPB2 and ITS phylogenies[J].Molecular Phylogenetics and Evolution,2005,37(2):602-618.
[6] Carris L M,Castlebury L A,Huang G,et a1.Tilletia vankyi,a new species of reticulate-spored bunt fungus with non-conjugating basidiospores infecting species of Festuca and Lolium[J].Mycological Research,2007,111:1386-1398.
[7] Hoffmann J A.Bunt of wheat[J].Plant Disease,1982,66:979-986.
[8] Trione E J.Dwarf bunt of wheat and its importancein international wheat trade[J].Plant Disease,1982,66(11):1083-1088.
[9] 万方浩.“973"项目“农林危险生物入侵机理与控制基础研究”简介[J].昆虫知识,2007,44(6):790-797.
[10]郑大勇,张敏,刘太国,等.小麦锈菌夏孢子DNA提取方法研究[M]∥植物保护科技创新与发展.北京:中国农业科学技术出版社,2008:507-514.
[11]年四季,殷幼平,袁青,等.小麦矮腥黑粉菌差异片段筛选与分子检测体系的建立[J].微生物学报,2007,47(4):725-728.
[12]Sawadogo M,Sentenac A.RNA polymerase B(II)and general transcription factors[J].Annu Rev Biochem,1990,59:711-754.
[13]Oxelman B,Bremer B.Discovery of paralogous nuclear gene sequences coding for the second-largest subunit of RNA Polymerase II(RPB2)and their phy logenetic utility in gentianales of the Asterid s[J].Molecular Biology and Evolution,2000,17(8):1131-1145.
[14]Warrilow D,Symons RH.Sequenceanalysis of the second largest subunit of tomato RNA polymerase II[J].Plant Mol Biol,1996,30:337-342.
[15]Tang A M C,Jeewon R,Hyde K D.Phylogenetic utility of protein(RPB2,β-tubulin)and ribosomal(LSU,SSU)gene sequences in the sy stematics of Sordariomycetes(Ascomycota,Fungi)[J].Antonie van Leeuwenhoek,2007,91:327-349.
[16]梁宏,张国珍,陈万权,等.小麦矮腥黑穗病菌与其近缘种的rDNA-ITS序列分析[J].植物病理学报,2005,35(增刊):181-183.
[17]梁宏,彭友良,陈万权,等.腥黑粉菌属3种检疫性真菌的rDNA-IGS区的扩增及其序列分析[J].植物病理学报,2006,36(5):407-412.
[18]Chen W Q,Liu T G,Liu JH,et al.DNA marker of Tilletia controversa Kühn,a causal agent of wheat dwarf bunt[J].Czech Journal of Genetics and Plant Breeding,2006,42(Special issue):13.

