Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜3种氧化还原酶活性的影响
张 鼐,李裕红,徐 佳
(厦门大学环境科学研究中心,福建 厦门 361005)
随着现代工农业的迅猛发展和矿产资源的大规模开发,生态环境特别是水体重金属污染越来越严重,水体中的重金属污染物通过食物链的积累和放大对生物产生更大的毒害作用。自然环境中的重金属污染常常是2种或2种以上重金属元素形成的复合污染,重金属元素之间除表现出毒害增强的协同作用外,还表现出独立、相加或拮抗作用。由于重金属复合污染机制复杂、对环境的危害程度严重,因此,对重金属复合污染的研究已成为近年来环境科学领域重要的研究热点[1]。
细胞质膜是植物抵抗环境污染的第1道屏障,质膜上的电子传递链通过质膜氧化还原酶的作用及电子载体的氧化和还原反应进行电子传递,因此,质膜氧化还原酶在植物的氧化还原系统中具有举足轻重的地位,对植物抵抗环境污染也具有重要作用。该系统以NAD(P)H为电子供体,还原、EDTA-Fe3+和O2等,同时释放 H+,此反应过程在能量传递、营养和代谢物的运输与吸收、生长发育、信息传导及抗性解毒等方面起着重要作用[2]。
凤眼莲〔Eichhorniacrassipes(Mart.)So lm s〕又名水葫芦,中文学名凤眼蓝,属于雨久花科(Pontederiaceae)凤眼蓝属(EichhorniaKunth)多年生水生草本植物,繁殖能力很强,条件适宜时扩散蔓延速度极快,致使许多河流、湖泊阻塞,被列入恶性入侵杂草之列。然而,大量的研究表明,凤眼莲能有效吸收富营养水体中的氮和磷等营养元素,并对水体中的各种重金属和有毒化合物等具有富集作用,是监测和净化水体污染的一种良好植物材料[3];凤眼莲对单一的 Cd2+或 Zn2+胁迫均有较强的耐性和积累能力,且在净化过程中其根部的作用最强[4-6]。目前,重金属污染对凤眼莲影响的研究多是在单一重金属胁迫条件下进行的,且研究内容大多集中于重金属对凤眼莲细胞结构[7]、形态和生长指标[8]、光合作用生理指标[9]、脂质过氧化以及抗氧化生理指标[9-10]等方面的影响。
作者采用水培法对凤眼莲幼苗进行20 h及20 d的 Cd2+、Zn2+单一及复合胁迫,通过提取高纯度质膜微囊研究 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜3种氧化还原酶〔包括 NADH氧化酶、还原酶和 EDTA-Fe3+还原酶〕活性的影响,以期为利用凤眼莲修复重金属复合污染水体提供理论基础。
1 材料和方法
1.1 材料
供试凤眼莲幼苗于2009年春季采自福建泉州洛阳江水域。选取同一区域生长均匀一致的凤眼莲幼苗〔单株鲜质量为(98.9±12.4)g〕,用曝气自来水在室内暂养5 d后进行单一及复合胁迫处理,暂养期间室内温度为12℃~25℃,在自然光照条件下进行暂养。
1.2 方法
1.2.1 胁迫处理方法 实验设置3组处理,其中, Cd2+单一胁迫处理浓度为0.05和0.50mmo l·L-1;Zn2+单一胁迫处理浓度为0.5和5.0mmol·L-1;Cd2+-Zn2+复合胁迫设置4个处理组:0.5mmo l· L-1Zn2+-0.05 mmo l·L-1Cd2+,0.5 mmo l·L-1Zn2+-0.50 mmo l·L-1Cd2+,5.0 mmo l·L-1Zn2+-0.05 mmol·L-1Cd2+以及5.0 mmol·L-1Zn2+-0.50mmo l·L-1Cd2+。
在高15 cm、直径35 cm的塑料盆中加入4 L培养水(为含0.5 g·L-1Ca2+的曝气自来水)[11],再分别一次性加入 CdC l2·2.5H2O和 ZnSO4·7H2O,使水中 Cd2+和 Zn2+的终浓度分别达到上述处理要求,对照组(CK)则为不添加 Cd2+和 Zn2+的培养水。每处理3盆,每盆4株凤眼莲幼苗,每盆视为1次重复。在各胁迫条件下培养20 h和20 d后,取凤眼莲幼苗的根系进行分析。
1.2.2 根质膜微囊的分离纯化 采用差速离心水双相分离法[12-13]提取凤眼莲根质膜微囊。每个实验组随机取约20 g新鲜凤眼莲根,经液氮研磨后,加入匀浆液(pH7.8)继续研磨,过滤,滤液用 ROTINA38R型冷冻离心机(德国Hettich公司生产)于10000g离心15m in;弃沉淀,上清液用 A van ti J-25型高速冷冻离心机(美国Beckm an公司生产)于50000g离心30m in;弃上清液,沉淀用5 mmo l·L-1磷酸缓冲液(含0.1mmo l·L-1DTT和1mmo l·L-1KC l,pH7.8)悬浮,得到粗膜制剂。将粗膜制剂用两相分配法进行纯化,先用 ROTINA38R型冷冻离心机于1500g离心15m in,上清液再用 Avanti J-30 I型超速冷冻离心机于100000g离心30m in,弃上清液,沉淀用纯膜悬浮液(含5mmol·L-1Tris-Mes、0.1mmo l·L-1DTT和0.25mmo l·L-1蔗糖)悬浮,得到纯化的根质膜微囊,即用或置于-70℃冰箱保存、待用。
1.2.3 质膜微囊蛋白质含量的测定 采用考马斯亮蓝 G-250法测定凤眼莲根质膜微囊的蛋白质含量。具体实验步骤按照Bradford蛋白浓度测定试剂盒(碧云天试剂公司生产)中的操作说明进行操作,使用Genios-DNA多功能酶标仪(瑞典 Tecan公司生产)测定凤眼莲根质膜微囊蛋白质含量,重复测定2次,结果取平均值。
1.2.4 质膜中3种氧化还原酶活性的测定 参照陈珈等[14]和焦新之等[15]的方法测定凤眼莲根质膜中的NADH氧化酶活性(以NADH的氧化速率表示)、Fe(CN)63-还原酶活性〔以还原速率表示〕和 EDTA-Fe3+还原酶活性(以 EDTA-Fe3+还原速率表示)。其中,以波长340 nm处测定液消光系数的变化代表NADH氧化酶活性的变化,并按1mmol·L-1NADH的消光系数为6.23换算被氧化的NADH量;以波长420 nm处测定液消光系数的变化代表还原酶活性的变化,并按1mmol·L-1的消光系数为1换算被还原的量;以波长535 nm处测定液消光系数的变化代表 EDTA-Fe3+还原酶活性的变化,并参照亚铁盐标准曲线计算 EDTA-Fe3+的还原速率。
1.3 数据处理
实验数据采用 Excel2003和 SPSS11.5软件进行分析处理,采用 Duncan’s新复极差法进行多重比较分析。
2 结果和分析
2.1 Cd2+、Zn2+单一及复合胁迫对凤眼莲幼苗根质膜NADH氧化酶活性的影响
植物细胞质膜中的NAD(P)H氧化酶是以胞质NAD(P)H为电子供体、氧为天然电子受体、催化胞外氧生成超氧阴离子的氧化还原酶。实验结果表明,凤眼莲幼苗的根质膜上存在NADH氧化酶,且其活性受 Cd2+、Zn2+单一及复合胁迫的影响,但酶活性变化随胁迫浓度和胁迫时间的不同而异,详细实验结果见表1。
表1 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 NADH氧化酶活性的影响(±SD)1)Table1 Effects of singleand com b ined stresses of Cd2+and Zn2+on NADH ox idase activ ity in root p lasm a lemm a of E ichho rn ia crassipes(Mar t.)Solm s(±SD)1)
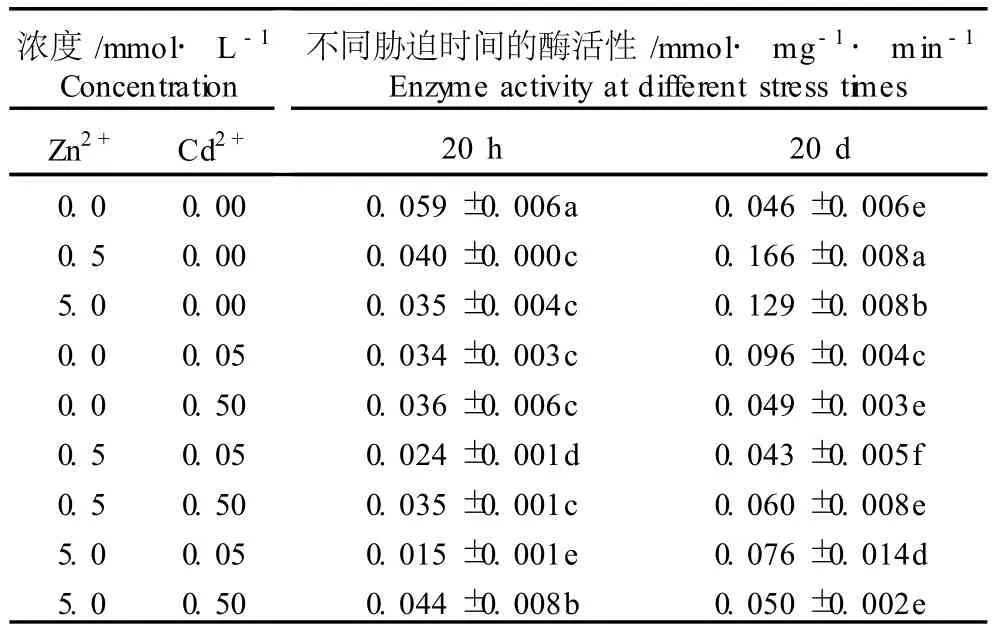
表1 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 NADH氧化酶活性的影响(±SD)1)Table1 Effects of singleand com b ined stresses of Cd2+and Zn2+on NADH ox idase activ ity in root p lasm a lemm a of E ichho rn ia crassipes(Mar t.)Solm s(±SD)1)
1)同列中不同的小写字母表示差异显著(P≤0.05)D ifferent sm all letters in same column indicate the significant difference(P≤0.05).
浓度/mmol·L-1 Concen tration Zn2+ Cd2+不同胁迫时间的酶活性/mmol·mg-1·m in-1 Enzyme activity atdifferent stress times20 h 20 d0.0 0.00 0.059±0.006a 0.046±0.006e0.5 0.00 0.040±0.000c 0.166±0.008a5.0 0.00 0.035±0.004c 0.129±0.008b0.0 0.05 0.034±0.003c 0.096±0.004c0.0 0.50 0.036±0.006c 0.049±0.003e0.5 0.05 0.024±0.001d 0.043±0.005f0.5 0.50 0.035±0.001c 0.060±0.008e5.0 0.05 0.015±0.001e 0.076±0.014d5.0 0.50 0.044±0.008b 0.050±0.002e
由表1可见,胁迫20 h,Cd2+、Zn2+单一胁迫各处理组的凤眼莲根质膜 NADH氧化酶活性均显著降低。用0.5和5.0mmol·L-1Zn2+单一胁迫处理20 h,凤眼莲幼苗根质膜NADH氧化酶活性分别较对照下降了32.2%和40.7%;用0.05和0.50 mmo l·L-1Cd2+单一胁迫处理20 h,凤眼莲幼苗根质膜 NADH氧化酶活性较对照分别下降了42.4%和39.0%。胁迫处理20 d,0.5 mmo l·L-1Zn2+、5.0 mmol·L-1Zn2+和0.05mmol·L-1Cd2+3个胁迫处理组中凤眼莲根质膜NADH氧化酶活性均显著高于对照组(P≤0.05),其中,0.5和5.0mmol·L-1Zn2+胁迫处理组中凤眼莲幼苗根质膜NADH氧化酶活性分别较对照组提高了260.9%和180.4%,0.05mmo l·L-1Cd2+胁迫处理组凤眼莲幼苗根质膜NADH氧化酶活性较对照组提高了108.7%。
由表1还可见,在 Cd2+-Zn2+复合胁迫条件下, Cd2+或 Zn2+的存在均会在一定程度上改变Cd2+或 Zn2+对凤眼莲根质膜NADH氧化酶活性的影响效应。胁迫处理20 h,0.05或0.50mmol·L-1Cd2+与0.5mmo l· L-1Zn2+复合胁迫对凤眼莲幼苗根质膜NADH氧化酶活性具有协同降低的作用,0.05mmol·L-1Cd2+与5.0 mmol·L-1Zn2+复合胁迫也对凤眼莲根质膜NADH氧化酶活性具有协同降低的作用,但0.50mmo l·L-1Cd2+与5.0mmol·L-1Zn2+复合胁迫则使凤眼莲幼苗根质膜NADH氧化酶活性的降幅减小,显示出一定的拮抗作用;在0.5或5.0mmol·L-1Zn2+与0.05mmol·L-1Cd2+复合胁迫条件下凤眼莲幼苗根质膜NADH氧化酶活性的降低幅度更大,也显示出协同降低的作用。可见,Cd2+-Zn2+复合胁迫20 h对凤眼莲幼苗根质膜NADH氧化酶活性的联合作用与Cd2+、Zn2+的胁迫浓度有关。在Cd2+-Zn2+复合胁迫条件下处理20 d,凤眼莲幼苗根质膜NADH氧化酶活性均小于 Zn2+单一胁迫处理组,表明 Cd2+的存在对0.5或5.0 mmo l·L-1Zn2+对凤眼莲幼苗根质膜 NADH氧化酶活性的影响效应有一定的拮抗作用;而 Zn2+的存在在一定程度上也会改变 Cd2+对凤眼莲幼苗根质膜NADH氧化酶活性的影响效应,其中,0.5或5.0mmo l·L-1Zn2+与0.05mmo l·L-1Cd2+复合胁迫条件下凤眼莲根质膜NADH氧化酶活性均小于0.05 mmo l·L-1Cd2+单一胁迫处理组,0.5或5.0mmo l·L-1Zn2+与0.50mmo l·L-1Cd2+复合胁迫条件下凤眼莲根质膜NADH氧化酶活性均大于0.50mmo l·L-1Cd2+单一胁迫处理组。
此外,表1的数据还显示,Cd2+-Zn2+复合胁迫20 h,凤眼莲根质膜 NADH氧化酶活性显著降低;随着胁迫时间的延长,NADH氧化酶活性有所提高,胁迫20 d后凤眼莲根质膜NADH氧化酶活性明显高于胁迫处理20 h,增加幅度最大的是5.0mmol·L-1Zn2+-0.05 mmo l·L-1Cd2+复合胁迫处理组,其根质膜NADH氧化酶活性比胁迫20 h时增加了406.7%。在实验浓度范围内,Cd2+、Zn2+单一胁迫20 h,Cd2+及较高浓度 Zn2+的单一胁迫均使凤眼莲根质膜 NADH氧化酶活性显著降低;而Cd2+、Zn2+单一胁迫处理20 d,凤眼莲幼苗根质膜NADH氧化酶活性则明显大于胁迫处理20 h。
2.2 Cd2+、Zn2+单一及复合胁迫对凤眼莲幼苗根质膜 还原酶活性的影响
表2 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 Fe(CN)6 3-还原酶活性的影响(±SD)1)Table2 Effects of sing leand com b ined stresses of Cd2+and Zn2+on Fe(CN)63-reductase activ ity in root p lasm a lemm a of E ichho rn ia crassipes(Mar t.)Solm s(±SD)1)
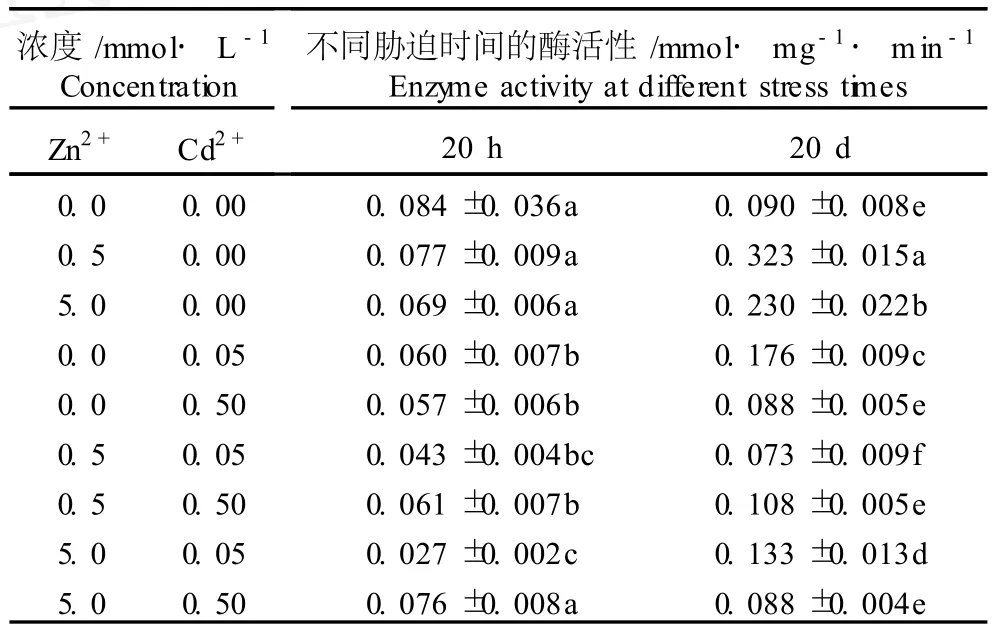
表2 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 Fe(CN)6 3-还原酶活性的影响(±SD)1)Table2 Effects of sing leand com b ined stresses of Cd2+and Zn2+on Fe(CN)63-reductase activ ity in root p lasm a lemm a of E ichho rn ia crassipes(Mar t.)Solm s(±SD)1)
1)同列中不同的小写字母表示差异显著(P≤0.05)D ifferent small letters in sam e co lum n ind icate the significan t d ifference(P≤0.05).
浓度/mmol·L-1 Concentration Zn2+ Cd2+不同胁迫时间的酶活性/mmol·mg-1·m in-1 Enzym e activity at different stress tim es20 h 20 d0.0 0.00 0.084±0.036a 0.090±0.008e0.5 0.00 0.077±0.009a 0.323±0.015a5.0 0.00 0.069±0.006a 0.230±0.022b0.0 0.05 0.060±0.007b 0.176±0.009c0.0 0.50 0.057±0.006b 0.088±0.005e0.5 0.05 0.043±0.004bc 0.073±0.009f0.5 0.50 0.061±0.007b 0.108±0.005e5.0 0.05 0.027±0.002c 0.133±0.013d5.0 0.50 0.076±0.008a 0.088±0.004e
由表2数据可见,单一胁迫20 h,0.5和5.0mmol· L-1Zn2+胁迫处理组凤眼莲根质膜还原酶活性较对照组变化不显著,而0.05和0.50mmol·L-1Cd2+胁迫处理组凤眼莲根质膜还原酶活性均较对照组显著降低。随胁迫时间的延长,凤眼莲根质膜还原酶活性提高,胁迫20 d后各单一胁迫处理组根质膜还原酶活性明显高于胁迫20 h,除0.50mmo l·L-1Cd2+胁迫处理组与对照组无显著差异外,其他单一胁迫处理组的 Fe(CN)63-还原酶活性均显著高于对照组,其中,0.5 mmo l·L-1Zn2+胁迫处理组的 Fe(CN)63-还原酶活性增加幅度最大,比胁迫20 h时提高了319.5%。
由表2还可见,在 Cd2+-Zn2+复合胁迫条件下, Cd2+或 Zn2+的存在均会在一定程度上改变 Zn2+或Cd2+对凤眼莲幼苗根质膜 Fe(CN)63-还原酶活性的影响效应。与0.5mmol·L-1Zn2+单一胁迫处理组相比,胁迫20 d时0.05或0.50mmo l·L-1Cd2+与0.5mmol·L-1Zn2+复合胁迫处理组凤眼莲幼苗根质膜 Fe(CN)63-还原酶活性分别下降了77.4%和66.6%,因而,胁迫20 d时0.05或0.50 mmo l·L-1Cd2+与0.5mmol·L-1Zn2+复合胁迫对 Fe(CN)63-还原酶活性具有明显的拮抗作用;0.05 mmo l·L-1Cd2+与5.0 mmo l·L-1Zn2+复合胁迫20 h对 Fe(CN)63-还原酶活性具有明显的协同降低作用,导致Fe(CN)63-还原酶活性降幅更大,但胁迫处理20 d后,该复合胁迫处理组凤眼莲根质膜还原酶的活性尽管较对照组有所提高,但低于5.0 mmo l ·L-1Zn2+单一胁迫处理组,表明经过较长时间的复合胁迫处理后,Cd2+对 Zn2+的影响效应具有一定的拮抗作用。与0.05mmo l·L-1Cd2+单一胁迫处理组相比,胁迫20 h时 Zn2+与0.05mmo l·L-1Cd2+复合胁迫处理组凤眼莲根质膜 Fe(CN)63-还原酶活性较对照组的下降幅度更大,表现为协同降低作用;但随着胁迫时间延长,至胁迫20 d时,0.05 mmo l·L-1Cd2+单一胁迫处理组 Fe(CN)63-还原酶活性高于对照组,而 Zn2+与0.05mmo l·L-1Cd2+复合胁迫处理组则有所降低,显示 Zn2+的存在对 Cd2+的影响效应有一定的拮抗作用。
研究结果表明,在 Cd2+、Zn2+单一胁迫20 h时,由于急性毒性的原因,凤眼莲根质膜 Fe(CN)63-还原酶活性低于对照,但随胁迫时间的延长,凤眼莲根质膜 Fe(CN)6
3-还原酶活性因受到胁迫刺激而增强。对凤眼莲根质膜 Fe(CN)63-还原酶活性而言,Cd2+与 Zn2+的相互作用关系并非固定不变,而是随胁迫浓度和胁迫时间不同呈协同或拮抗作用。
2.3 Cd2+、Zn2+单一及复合胁迫对凤眼莲幼苗根质膜 EDTA-Fe3+还原酶活性的影响
植物不能直接利用 Fe3+,只有当 Fe3+被还原成Fe2+或结合成螯合物时才能通过质膜被细胞吸收[17]。实验结果(表3)显示,在凤眼莲根质膜上存在 EDTA-Fe3+还原系统,Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 EDTA-Fe3+还原酶活性有影响。
表3数据表明,胁迫20 h,0.5和5.0mmo l·L-1Zn2+以及0.05和0.50mmo l·L-1Cd2+单一胁迫处理组凤眼莲根质膜 EDTA-Fe3+还原酶活性均显著低于对照组,但随胁迫时间延长其活性增加,至胁迫20 d时4个单一胁迫处理组凤眼莲根质膜 EDTAFe3+还原酶活性比对照组分别提高了242.9%、209.1%、134.5%和29.0%。在实验条件下,较高浓度Zn2+单一胁迫对凤眼莲根质膜 EDTA-Fe3+还原酶的激活作用更大。胁迫处理20 h,0.05或0.50mmol·L-1Cd2+单一胁迫处理组凤眼莲根质膜 EDTA-Fe3+还原酶活性均显著降低,分别较对照组降低了61.6%和62.0%;随着胁迫处理时间的延长,凤眼莲根质膜EDTA-Fe3+还原酶活性提高,胁迫20 d后0.05或0.50mmo l·L-1Cd2+单一胁迫处理组凤眼莲根质膜 EDTA-Fe3+还原酶活性分别比胁迫20 h时提高了3.71和1.62倍,并显著高于对照组。Cd2+-Zn2+复合胁迫对凤眼莲根质膜 EDTAFe3+还原酶活性的影响效应与单一胁迫处理完全不同。表3结果表明,0.5或5.0mmo l·L-1Zn2+无论是与0.05mmol·L-1Cd2+、还是与0.50mmo l·L-1Cd2+复合胁迫处理20 h,凤眼莲幼苗根质膜 EDTAFe3+还原酶活性都显著低于 Zn2+单一胁迫处理组,并显著低于对照组;其中,0.05mmo l·L-1Cd2+与不同浓度 Zn2+复合胁迫导致 EDTA-Fe3+还原酶活性降低的幅度大于0.50 mmo l·L-1Cd2+与不同浓度Zn2+复合胁迫处理组;胁迫处理20 d时0.5或5.0 mmo l·L-1Zn2+单一胁迫导致凤眼莲根质膜 EDTA-Fe3+还原酶活性显著高于对照,而 Cd2+-Zn2+复合胁迫处理则使 EDTA-Fe3+还原酶活性降低并接近对照水平,表明 Cd2+的存在对 Zn2+的影响效应具有一定的拮抗作用。胁迫处理20 d时,Zn2+对 Cd2+所起的影响效应有较明显的作用,0.05 mmo l·L-1Cd2+单一胁迫导致凤眼莲根质膜 EDTA-Fe3+还原酶活性较对照组提高了134.5%,而0.5或5.0mmol ·L-1Zn2+与不同浓度 Cd2+复合胁迫可使 EDTAFe3+还原酶活性明显降低,表明 Zn2+对 Cd2+的影响效应具有一定的拮抗性。
表3 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 EDTA-Fe3+还原酶活性的影响(±SD)1)Table3 Effects of singleand com b ined stresses of Cd2+and Zn2+on EDTA-Fe3+reductase activ ity in root p lasm a lemm a of E ichho rn ia crassipes(Mar t.)Solm s(±SD)1)
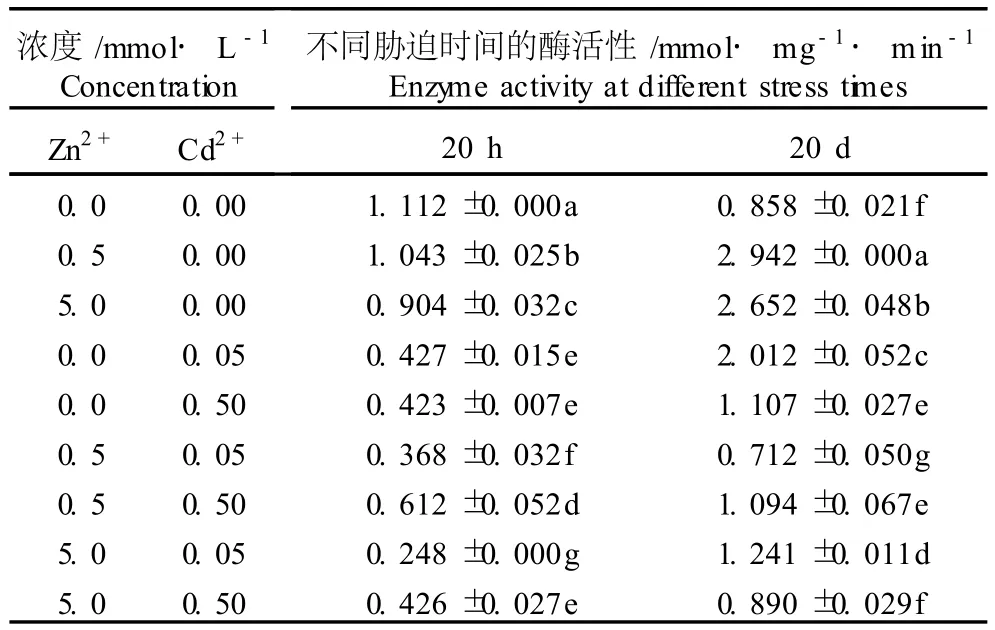
表3 Cd2+、Zn2+单一及复合胁迫对凤眼莲根质膜 EDTA-Fe3+还原酶活性的影响(±SD)1)Table3 Effects of singleand com b ined stresses of Cd2+and Zn2+on EDTA-Fe3+reductase activ ity in root p lasm a lemm a of E ichho rn ia crassipes(Mar t.)Solm s(±SD)1)
1)同列中不同的小写字母表示差异显著(P≤0.05)D ifferent small letters in same column indicate the significant difference(P≤0.05).
浓度/mmol·L-1 Concentration Zn2+ Cd2+不同胁迫时间的酶活性/mmol·mg-1·m in-1 Enzyme activity atdifferent stress times20 h 20 d0.0 0.00 1.112±0.000a 0.858±0.021f0.5 0.00 1.043±0.025b 2.942±0.000a5.0 0.00 0.904±0.032c 2.652±0.048b0.0 0.05 0.427±0.015e 2.012±0.052c0.0 0.50 0.423±0.007e 1.107±0.027e0.5 0.05 0.368±0.032f 0.712±0.050g0.5 0.50 0.612±0.052d 1.094±0.067e5.0 0.05 0.248±0.000g 1.241±0.011d5.0 0.50 0.426±0.027e 0.890±0.029f
研究结果表明,无论 Cd2+、Zn2+单一胁迫还是复合胁迫,胁迫处理20 d时凤眼莲根质膜 EDTA-Fe3+还原酶活性均显著高于胁迫处理20 h,这一变化趋势与凤眼莲根质膜NADH氧化酶和还原酶活性的变化趋势相似。
3 讨论和结论
实验结果表明,0.05或0.50mmo l·L-1Cd2+单一胁迫处理20 h可使凤眼莲根质膜NADH氧化酶、Fe(CN)63-还原酶和 EDTA-Fe3+还原酶活性显著低于对照,0.5或5.0mmol·L-1Zn2+单一胁迫处理20 h可导致凤眼莲根质膜NADH氧化酶和 EDTAFe3+还原酶活性也显著低于对照;但随胁迫时间的延长,凤眼莲根质膜氧化还原酶活性增加,无论是 Cd2+、Zn2+单一胁迫还是复合胁迫,胁迫20 d时凤眼莲根质膜氧化还原酶活性均显著高于胁迫处理20 h,可以认为凤眼莲根质膜氧化还原酶在抗 Cd2+、Zn2+胁迫生理过程中起重要作用。高活性的质膜氧化还原酶可以促进植物对铁的吸收利用、促进细胞壁的合成及H+的分泌、维持正常的膜电位、增强防御系统功能[18]。Cd2+和 Zn2+单一或复合胁迫影响凤眼莲根质膜氧化还原酶活性的原因可能有以下几个方面:1)植物细胞质膜具有电子载体和多种氧化还原酶,能进行电子传递、供体氧化和受体还原反应,氧化还原反应之间存在着直接的电子竞争[19],Cd2+和 Zn2+对电子传递链某一环节的影响必定对氧化还原反应之间存在的电子竞争关系造成影响;2)由于重金属离子的加入影响了细胞质膜的带电性,从而造成了质膜上与酶结合的底物浓度的变化[20];3)在抗 Cd2+、Zn2+胁迫过程中,凤眼莲幼苗根质膜氧化还原酶可能通过电子传递产生的活性氧激发质膜上的自由基清除系统来适应外源重金属胁迫,这也体现了植物的氧化还原系统不但具有信号传导功能同时也受到已知信号传导途径的影响[21]。
对凤眼莲根质膜氧化还原酶而言,在胁迫处理20 h时,Cd2+与 Zn2+之间的联合作用关系较复杂,随浓度不同而呈现协同性或者拮抗性,并非是固定不变的作用关系。因此,在探索重金属复合污染环境下各重金属元素之间的相互作用关系时既要考虑共存元素的性质又要考虑浓度比例[22]。本研究结果显示, Cd2+、Zn2+联合作用效应与 Cd2+和 Zn2+的元素性质、浓度比例及胁迫时间均有关,表现较为一致的是:在胁迫20 d时 Zn2+对 Cd2+或者 Cd2+对 Zn2+的作用均体现出拮抗性,即 Cd2+与 Zn2+之间具有拮抗作用关系。由于 Zn2+能够与蛋白质中的巯基结合,而 Cd2+与巯基的结合产物比 Zn2+更稳定,因此,Cd2+可以把Zn2+从巯基中置换出来,表现为 Cd2+对 Zn2+的拮抗作用[3]。另外,通常情况下游离态的 Cd2+对生物体的毒性较大,但如果 Cd2+与蛋白质结合形成 Cd-硫蛋白,毒性就会明显降低,而凤眼莲体内 Zn2+含量较高,可对 Cd2+有较好的解毒效果,有助于凤眼莲对Cd2+的吸收,使凤眼莲在 Cd2+、Zn2+共存时对 Cd2+的耐受性增强,因此表现出拮抗作用关系。
[1]周启星,程 云,张倩茹,等.复合污染生态毒理效应的定量关系分析[J].中国科学:C辑,2003,33(6):566-573.
[2]陈学思,颜季琼,焦新之.植物质膜氧化还原作用[J].生物学通报,1996,3(10):4-7.
[3]李裕红.凤眼莲对水环境污染的净化作用研究概述[J].引进与咨询,2006(2):82-83.
[4]达良俊,陈 鸣.凤眼莲不同部位对重金属的吸收、吸附作用研究[J].上海环境科学,2003,22(11):765-767.
[5]蔡成翔,王华敏,张宗明.凤眼莲对铜、铅、镉、锌、铁等离子的短期净化机制研究[J].乐山师范学院学报,2004,19(5):69-72.
[6]戴树桂,车广为.凤眼莲对污水中重金属的净化[J].环境化学,1987,6(2):43-50.
[7]徐勤松,施国新,王 学,等.铅(Pb)在凤眼莲(Eichhornia crassipesSolm s)体细胞中分布的电镜观察[J].南京师大学报:自然科学版,2006,29(3):81-85.
[8]张宗明,蔡成翔,王华敏.凤眼莲对铜、铅和镉离子的耐受性及短期富集机制研究[J].宜春学院学报:自然科学,2004,26(2):7-9.
[9]李裕红,黄小瑜,林智勇.Pb2+对凤眼莲光合作用的影响[J].中国生态农业学报,2008,16(5):1338-1340.
[10]Sun SC,Wang H X,L iQ R.Prelim inary studieson physio logical changes and injurym echanism in aquatic vascular p lants treated with cadm ium[J].Acta Phytophysiologica Sinica,1985,11(2):113-121.
[11]Shu WS,Ye Z H,Lan C Y,et al.Lead,zinc and copper accumu lation and tolerance in populations ofPaspalumdistichumandCynodondactylon[J].Environm en tal Po llution,2002,120(2):445-453.
[12]Sandelius A S,Morre D J.Plasmamembrane isolation[M]∥ Larsson C,Moller IM.The Plant Plasm a Membrane.Berlin: Sp ringerVerlag,1990:44-75.
[13]L iY H,Yan C L,Liu JC,etal.Effects of lanthanum on redox system s in p lasmam embranes ofCasuarinaequisetifoliaseed lings under acid rain stress[J].Journal of Rare Earths,2003,21(5):577-581.
[14]陈 珈,王建华.玉米根细胞膜铁氰化钾还原酶[J].植物生理学报,1994,20(1):69-76.
[15]焦新之,李 琳,倪晋山.花生幼苗下胚轴质膜氧化还原系统[J].植物生理学报,1992,18(1):63-70.
[16]Bienfait H F.Mechanism s in Fe-efficiency reactions of higher p lants[J].Journal of PlantNutrition,1988,11:605-629.
[17]Simpson R J,Peters T J.Transport of Fe2+across lip id bilayers: possible role of free fatty acids[J].Biochim ica et Biophysica Acta:Biomembranes,1987,898(2):187-195.
[18]赵中秋.泌盐与非泌盐红树植物细胞质膜功能的比较研究[D].厦门:厦门大学生命科学学院,2001.
[19]洪剑明,鞠红玉,刘祥林.玉米根细胞质膜硝酸还原酶与EDTA-Fe3+还原酶活性的关系[J].首都师范大学学报:自然科学版,1999,20(1):61-65.
[20]Brüggemann W,Moog P R,Nakagawa H,et al.Plasma membrane-bound NADH:Fe3+-EDTA reductase and iron deficiency in tomato(Lycopersiconesculentum).Is there a Turbo reductase?[J].Physiologia Plantarum,1990,79(2):339-346.
[21]孙 玉,陈 珈.植物质膜氧化还原系统与信号传导[J].植物生理学通讯,1997,33(3):161-167.
[22]孙延东,原海燕,黄苏珍.Cd-Cu复合胁迫对黄菖蒲叶片及根系中Cd和Cu的积累及其迁移率的影响[J].植物资源与环境学报,2009,18(1):22-27.

