巴豆发酵品与生巴豆、巴豆霜中毒性成分的含量比较Δ
刘春美,吴晓峰,潘 扬,蒋亚平,张 弦(南京中医药大学药学院,南京市 210029)
巴豆(Crotonis Fructus)为大戟科植物巴豆Croton tiglium L.的成熟果实,载于现行《中国药典》中[1]。巴豆大毒,其毒性主要为两类成分,一类是脂肪油(巴豆油),含量达60%,既是毒性成分又是有效成分,口服后在肠内析出游离巴豆酸,使肠道分泌和蠕动增强,产生峻泻;另一类是蛋白质(巴豆毒素),能溶解红血球,使局部细胞坏死[2,3]。由于遇热可使这两类毒性成分含量降低或变性失活,因此目前通常采用取仁通过蒸、煮制熟后去油制霜(巴豆霜)的炮制方法,对缓和巴豆的毒性有积极意义[4,5]。但传统炮制法操作较烦琐,霜内含油量多少均凭经验观察,各地结果不一,差距很大,无法保证用药安全[6]。在应用巴豆制品治病的过程中,由于其有效剂量与中毒剂量比较接近,安全系数低,在无血药浓度监测的情况下,如用之不当或服用过量,不但起不到药物应发挥的作用,有时反而还可能引起中毒甚至有生命危险[7,8]。鉴于炮制对巴豆减毒存在的缺陷,有必要寻找新的解决这类问题的好途径。
“双向发酵”是南京中医药大学药用菌与中药生物技术研究所创立的一种使药用真菌与药材间组合进行固体发酵的方法[9],它为毒性中药减毒开辟了一条新途径[10,11]。本试验对灵芝菌与白僵菌2种巴豆发酵品与生巴豆及传统炮制品(巴豆霜)中毒性成分总蛋白和脂肪油含量及主要成分的含量进行比较,结果表明,巴豆经灵芝菌和白僵菌发酵后,其毒性成分脂肪油和总蛋白的含量明显降低,且均低于巴豆霜;经气相色谱-质谱(GC-MS)分析,巴豆发酵品、生巴豆和巴豆霜的脂肪油中共鉴定出48种成分。与生巴豆相比,2种发酵品脂肪油成分的组成和相对含量产生了明显变化;且出现了新成分,其中灵巴菌质和白巴菌质中各有5种。以上结果可为发酵对巴豆的“去毒存效”奠定物质基础。
1 仪器与材料
1.1 仪器
Agilent 6890N型GC仪、5973N型MS检测器、7683 serise自动进样器、Agilent色谱工作站配NIST05标准MS检索库(PaloAlto,CA,USA);UV-2401紫外分光光度计(日本岛津公司);AE 240电子天平(瑞士Mettler Toledo公司);HH-4数显恒温水浴锅(常州国华电器有限公司);202型台式恒温干燥箱(上海索谱仪器有限公司);THZ-D台式恒温振荡器(太仓市实验设备厂)。
1.2 试药
生巴豆产自云南,经南京中医药大学陈建伟教授鉴定为大戟科植物C.tiglium L.的果实,标本保存于南京中医药大学药用菌与中药生物技术研究所(批号:20081145);牛血清白蛋白(BSA,美国Sigma公司进口分装,批号:A8010);考马斯亮蓝G-250(美国Amresco公司进口分装,批号:0615);95%乙醇、磷酸均为分析纯。
1.3 菌种
灵芝菌[Ganoderma lucidum(Curtis:Fr.)P.Karst.]和白僵菌[Beauveria bassiana(Bals.)Vuill]均由南京中医药大学药用菌与中药生物技术研究所分离、贮藏和复壮。
2 方法
2.1 试液的配制
2.1.1 考马斯亮蓝G-250溶液的制备[12]精密称取考马斯亮蓝G-250 100 mg,加入95%乙醇50 mL,再加入85%(W/V)磷酸100 mL,用蒸馏水定容至1 000 mL,即得。2.1.2 牛血清白蛋白标准贮备液的制备 精密称取牛血清白蛋白100 mg,用少量蒸馏水溶解并定容至1 000 mL,即得浓度为0.1 mg·mL-1的牛血清白蛋白标准贮备液。
2.2 灵巴菌质和白巴菌质的制备
按固体发酵的生产工艺进行操作[13]。将生巴豆(果实)粉碎成粗粒(过10目筛),加适量水湿润,填装试管,混合均匀,扎口,121℃高压灭菌50 min,冷却;从菌种斜面上分别切取绿豆粒大小的灵芝菌和白僵菌菌丝体(带培养基)各1块,移入待发酵生巴豆的表面(使二者有接触),扎口,置培养箱中,于(27±2)℃下恒温培养,发酵30 d后分别掏取试管中的发酵物,60℃下干燥4~6 h,即分别得灵巴菌质和白巴菌质。
2.3 脂肪油含量测定
取上述各巴豆样品粗粒2 g,粉碎成粗粉(过20目筛),分别精密称定,置索氏提取器中,加乙醚100 mL,水浴回流提取至脂肪油提尽(约8 h),收集提取液,置已干燥至恒重的蒸发皿中,于水浴上低温挥去溶剂,100℃干燥1 h,移至干燥器中冷却30 min,精密称定,计算样品中脂肪油含量[1]。
2.4 总蛋白含量测定[12]
2.4.1 标准曲线的制备 精密吸取牛血清白蛋白标准贮备液0、0.2、0.4、0.6、0.8、1.0 mL,分别置10 mL刻度试管中,先用蒸馏水补足体积至1 mL,摇匀,加入考马斯亮蓝G-250显色剂5 mL,混匀,放置5 min。然后以第一份为空白对照,于593 nm波长处测定吸光度。以浓度(c,mg·mL-1)为横坐标,吸光度(A)为纵坐标,制备标准曲线,计算得回归方程为A=6.990 89c-0.000 91(r=0.999 6)。结果表明,总蛋白浓度在0.02~0.10 mg·mL-1范围内与吸光度呈良好的线性关系。
2.4.2 样品含量测定 精密称取各样品0.5 g,置50 mL容量瓶中,加20 mL蒸馏水,置震荡器中震荡提取2 h(150 r·min-1),3 600 r·min-1离心10 min,滤过,滤渣再加20 mL蒸馏水,置震荡器中震荡提取1 h(150 r·min-1),3 600 r·min-1离心10 min,合并滤液,定容至50 mL容量瓶中,即得样品溶液。精密吸取各样品溶液1.0 mL,按“2.4.1”项下方法操作,于593 nm波长处测定吸光度,代入标准曲线计算出样品中总蛋白含量(%)。
2.5 脂肪油的GC-MS测定
2.5.1 仪器工作条件 色谱柱:HP-5MS(30 m×0.25 mm×0.25 μm);进样口温度:250℃;载气:氦气(纯度99.99%),流速:1.0 mL·min-1;分流模式进样,分流比为20∶1;程序升温:初始温度设定为50℃,以5℃·min-1升至210℃,维持3 min,再以5℃·min-1升温至250℃,维持5 min。质谱电离方式:EI源;离子源温度:230℃;四级杆温度:150℃;接口温度:280℃;溶剂延迟时间:2.5 min;电子倍增器电压:1 623 V;质量扫描范围:m/z 40~500。
2.5.2 样品的GC-MS分析 精密称取巴豆油70 mg,加6 mL硫酸-甲醇(1∶10)混合溶液,于60℃水浴回流4 h(甲酯化),加10 mL水使样品液冷却,再加6 mL正己烷振荡萃取,分离上清液,过滤,无水硫酸钠干燥,低温浓缩至干。残渣加丙酮使溶解并定容至10 mL,有机相针式滤器(13 mm×0.45 μm)过滤,低温密闭保存。取样品溶液1 μL,按仪器工作条件注入色谱仪进行测定;对各样品总离子流图中化学色谱峰通过GC-MS分析工作站NIST标准图库进行检索并参照有关文献[14,15]进行初步鉴定,按峰面积归一化法计算各组分相对百分含量。
3 结果
3.1 脂肪油和总蛋白的含量测定
各样品中脂肪油测定结果表明:生巴豆>巴豆霜>灵巴菌质>白巴菌质;总蛋白测定结果表明:生巴豆>巴豆霜>白巴菌质>灵巴菌质。提示巴豆经灵芝菌和白僵菌发酵后,其毒性物质脂肪油和蛋白质的含量明显降低,且均低于巴豆霜,详见表1。
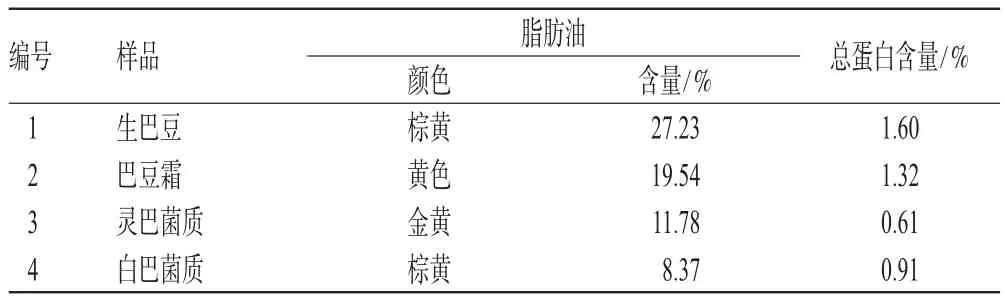
表1 生巴豆、巴豆霜、灵巴菌质和白巴菌质中脂肪油与总蛋白含量测定结果Tab 1 Fatty oil and total protein contents in crude C.tiglium,defatted C.tiglium seed powders,LBJZ and BBJZ
3.2 脂肪油成分的GC-MS分析
GC-MS分析结果显示,从生巴豆、巴豆霜、灵巴菌质、白巴菌质中分别鉴定出39、24、36、42种成分,其中归一化相对含量>1%的共有16种化合物:生巴豆占11种,巴豆霜有12种,灵巴菌质占8种,白巴菌质占13种。在2种发酵品中还发现有新出现的成分,其中灵巴菌质有5种,分别为4-癸烯酸甲酯、十五酸甲酯、7,10-十六碳二烯酸甲酯、7-十六碳烯酸甲酯、(Z)-9-十六碳烯酸甲酯;白巴菌质也有5种,分别为壬醛、4-癸烯酸甲酯、十四烷酸、十五酸甲酯、7-十六碳烯酸甲酯。而生巴豆中的十九(烷)酸甲酯则未在发酵品中发现。各样品脂肪油GC总离子流图见图1;各成分定性定量分析结果见表2。
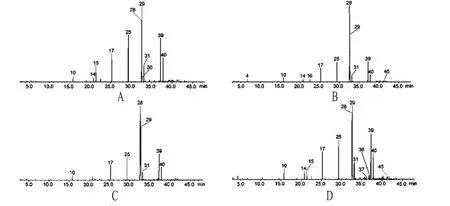
图1 各样品脂肪油GC的总离子流图(峰号参照表2)A.巴豆;B.巴豆霜;C.灵巴菌质;D.白巴菌质Fig 1 TIC of GC chromatograms of Fatty oil of samples(peak number referring to table 2)A.crude C.tiglium;B.defatted C.tiglium seed powders;C.LBJZ;D.BBJZ
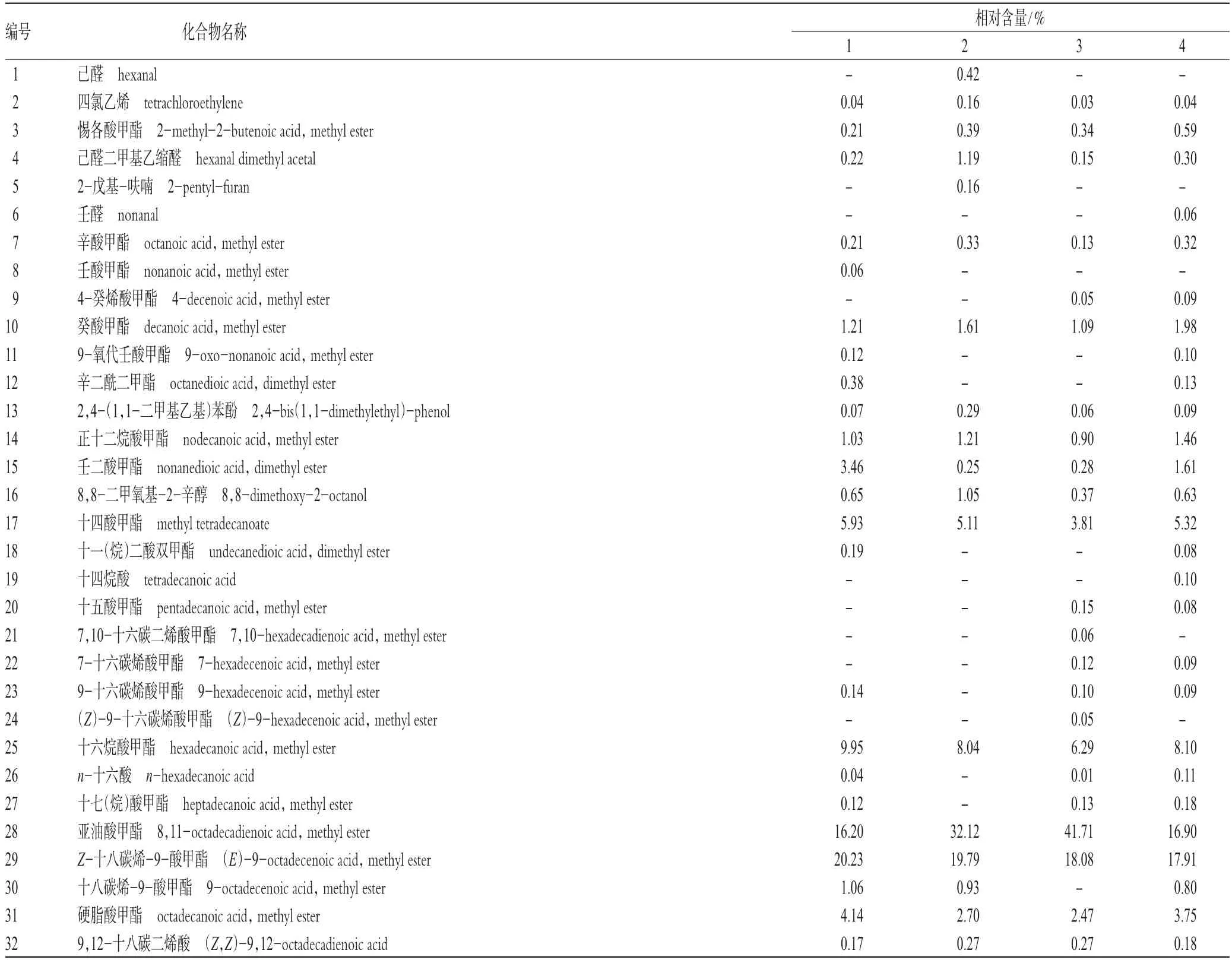
表2 生巴豆、巴豆霜、灵巴菌质和白巴菌质脂肪油成分的定性定量分析结果Tab 2 Qualitative and quantitative analysis of the fatty oils in crude C.tiglium,defatted C.tiglium seed powders,LBJZ and BBJZ

续表2Continued tab 2
4 讨论
巴豆经灵芝菌、白僵菌双向固体发酵后,其毒性成分脂肪油与总蛋白含量均有所下降,且低于巴豆传统炮制品巴豆霜。所得脂肪油甲酯化后经GC-MS法分析结果表明,灵巴菌质和白巴菌质与生巴豆及其炮制品相比,无论在脂肪油成分种类还是相对含量上均存在一定差异。这为进一步探讨巴豆发酵品“去毒存效”的物质基础提供了科学依据。至于巴豆中脂肪油与蛋白质组成成分变化同其药效之间的相关性及其生物转化的机制有待于进一步研究。
[1] 国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:74-75.
[2] 夏丽英.现代中药毒理学[M].第1版.天津:天津科技翻译出版公司,2005:204.
[3] 江苏新医学院.中药大辞典(上册)[M].第1版.上海:上海科学技术出版社,1977:503.
[4] 徐楚江,叶定江.中药炮制学(供中药专业用)[M].第1版.上海:上海科学技术出版社,1985:176.
[5] 张静修,王 毅.生、熟巴豆对比实验[J].中药材,1992,15(9):29.
[6] 天津市药材公司中药研究室.巴豆霜制法的研究[J].中草药通讯,1974,3:27.
[7] 时霄霄.巴豆过敏性休克1例[J].中国中药杂志,1994,19(9):569.
[8] 孙云成.腹腔注入巴豆冰片液致死1例[J].北华大学学报(自然科学版),1994,14(2):4.
[9] 庄 毅,潘 扬,张李阳,等.药用真菌“双向发酵”的起源、发展及其优势与潜力[J].中国食用菌,2007,26(2):3.
[10] 涂 霞,潘 扬.双向发酵——毒性中药炮制减毒的新途径[J].菌物研究,2010,8(1):52.
[11] 王身艳,潘 扬,蒋亚平,等.双向发酵对川乌指纹图谱及乌头碱类成分含量的影响[J].中国药房,2010,21(39):3 712.
[12] 赵英永,戴 云,崔秀明,等.考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量[J].云南民族大学学报(自然科学版),2006,15(3):235.
[13] 徐锦堂.中国药用真菌学[M].第1版.北京:北京医科大学中国协和医科大学联合出版社,1997:230.
[14] 胡 静,高文远,凌宁生,等.巴豆和巴豆霜挥发性成分的GC-MS分析[J].中国中药杂志,2008,33(4):464.
[15] 梁 英,潘英明.巴豆种子油的GC-MS分析[J].光谱实验室,2002,19(6):748.

