外源ABA和GA对番茄果实成熟发育中糖苷酶活性的影响
赫崇慧,李景富,王傲雪
(东北农业大学园艺学院,哈尔滨 150030)
番茄(Lycopersicon esculentum Mill.)是一种世界性蔬菜,种植面积居所有蔬菜作物之首,在蔬菜生产上占有举足轻重的地位。果实成熟时呈现出许多生理生化变化,除呼吸上升、乙烯合成、色素转变和风味物质形成外,软化也是许多果实成熟过程中的重要现象[1]。果实组织变软主要是由细胞胞间层结构改变、细胞壁总体结构破坏及细胞壁物质降解等引起的[2]。其中细胞壁水解酶起着关键性的作用。近年来,越来越多的研究者认为多种水解酶参与了细胞壁的降解而引起果实软化,糖苷酶是其中重要的一种细胞壁降解酶。研究表明,番茄、西瓜、苹果、甜樱桃、李子、杏、桃及猕猴桃中的半乳糖苷酶、甘露糖苷酶和葡萄糖苷酶等在果实成熟软化中起了重要作用[3]。
植物激素是细胞之间的第一信使,它在果实衰老进程中起着重要的调控作用。脱落酸是广泛存在于植物体内的另一重要激素,它可以刺激乙烯的产生,催促果实成熟,抑制脱氧核糖核酸和蛋白质的合成[4]。GA促进细胞分裂和茎的伸长和生长,低浓度下可以刺激茎的伸长和生长,使植株明显增高,并促进某些植物坐果和单性结实、延缓叶片衰老,诱导开花,打破种子休眠,促进雄花分化和提高结实率,刺激种子贮藏淀粉酶,诱导雌雄异株的雄花的发育[5-6]。其作用机理是促进基因表达,增加植物水解酶的合成,增进植物细胞壁的伸展性,刺激钙离子从细胞壁中释放,从而促进茎伸长和生长[7]。
利用激素突变体研究植物激素的合成、代谢、生理作用和调节机理是近年来植物生理学研究的重要进展之一。突变体的优点是:①其表型能提供激素在植物生理和发育方面的直观信息;②可用于研究有关激素合成及作用的内在生化机理;③在某些植物突变体中还可能分离和鉴别出与激素作用过程相关的基因[8]。本试验以GA突变体果实为试材,研究激素通过调节细胞壁降解酶来调控果实的成熟衰老进程途径和方式,为果实成熟软化奠定理论基础。
1 材料与方法
1.1 材料
以LA2895(GA突变体)为试材(由东北农业大学番茄研究所提供),其特点是含有gib-3基因。在土壤条件和管理情况完全相同的条件下种植番茄,选择生长良好的无病虫害的番茄植株进行采样。同时对激素处理过的番茄果实采取上述相同的方法采样。
1.2 方法
1.2.1 果实成熟期划分
具体划分标准见表1。

表1 果实不同成熟期划分标准Table 1 Criteria for the classification of different fruit ripeness
1.2.2 激素处理
在绿熟期前期用10 μmol·L-1的GA和ABA对LA2895番茄果实进行喷雾处理,保持果实表面滴水滴状态约0.5 h,每隔7 d进行一次相同的处理,共处理4次,其中以未经激素处理的GA突变体为对照。
1.2.3 番茄果实硬度的测定
取不同成熟度的果实进行硬度指标的测定。每个品种5个果实,采用手持式果实硬度计(GY-1,托普仪器有限公司),沿番茄果实赤道线中部(即果实最大横径处)对着心室腔随机取三点测试硬度,取平均值。
1.2.4 番茄中可溶性固形物含量的测定
采用阿贝折射仪法测定。将盖板掀开用蒸馏水1~2滴置于阿贝折射仪的折光棱镜面上,合上盖板测定其零点,然后用脱脂棉擦净,之后取番茄汁液1~2滴置于棱镜上盖上盖板观察,视野里明暗分界线相对应的刻度值即为固形物的含量,每测定一次需用脱脂棉将汁液擦净,重复3次,取平均值。
1.2.5 糖苷酶的测定
取0.1 g番茄果肉,在液氮下研磨,再用1mL的50 mmol·L-1MES的缓冲液继续研磨,将匀浆转移到1.5 mL的离心管在4℃,15 000 r·min-1条件下离心15 min,上清液为待测的酶液。对于β-半乳糖苷酶,β-D-木糖苷酶,α-L-阿拉伯糖苷酶的酶活测定参照Hruba和Itai1等的方法[9-10],β-甘露糖苷酶测定参照Bewley等方法[11],并略有改动。酶的活性单位是指在相应的试验条件下,以每克每分钟水解生成1 nmol的对硝基酚定义为一个酶活性单位,并以标准品对硝基酚绘制标准曲线。
2 结果与分析
2.1 GA和ABA对果实硬度和可溶性固形物含量的影响
果实硬度是反映果实质地的一个重要指标,同时也是反应果实软化的一个重要指标。由图1可知,未经激素处理的GA突变体的果实(对照)硬度随着不同的时期表现出逐渐下降的趋势,整个过程可分为三个阶段,对照组和处理组均都表现为前期下降较慢,中期快,后期又变慢的特点,且对照在不同时期之间差异显著,红果期采收的仅为刚采收时的33.5%。经GA和ABA处理番茄的果实,分别加速了番茄果实的软化进程,GA处理过的果实在绿熟期、破色期和淡红期同对照组差异不显著、其他时期差异显著,在粉红期GA的促进效果最大。ABA处理使整个时期果实的硬度得到显著降低。

图1 GA和ABA对番茄果实硬度的影响Fig.1 Effect of GA and ABA on fruit firmness of tomato
由图2可知,伴随着果实硬度的下降,对照组与处理组的果实中可溶性固形物的含量则不断上升。这可能是因为果实成熟过程中,多糖类不断转化为可溶性小分子碳水化合物,如葡萄糖、果糖等,原果胶分解成可溶性果胶溶于果汁造成的。GA和ABA处理均能促进果实可溶性固形物含量的增加,且ABA处理与GA处理在转色期和红果期差异不显著。

图2 GA和ABA对可溶性固形物含量的影响Fig.2 Effect of GA and ABA on soluble solid content of tomato
2.3 ABA和GA对糖苷酶活性的影响
由图3可知,未经激素处理的GA突变体的果实(对照)中β-甘露糖苷酶的活性呈现先下降后上升再下降趋势。且在转色期之前活性缓慢下降后迅速上升,在粉红色达到最大值。ABA处理在破色期β-甘露糖苷酶活性最小,之后逐渐上升到淡红期达到最大值后又表现出迅速下降。GA处理的β-甘露糖苷酶的活性表现出先上升后下降再上升的过程。在绿熟期最小,而在红果期酶的活性最大。ABA处理显著的高于对照,而GA处理显著低于对照。

图3 ABA和GA对β-甘露糖苷酶的影响Fig.3 Effect of ABA and GA on β-mannosidase activity of tomato
由图4可知,未经激素处理的GA突变体的果实(对照)中的α-L-阿拉伯糖苷酶的活性呈现出先下降后上升之后又下降的趋势。在绿熟期之后迅速下降,粉红色达到最小值,之后迅速上升,在淡红期达到最大值,之后α-L-阿拉伯糖苷酶的活性下降。ABA处理与对照变化趋势基本上一致,ABA处理的α-L-阿拉伯糖苷酶的活性显著高于对照,且最小值出现在绿熟期。GA对果实前期有一定的促进作用,而在红果期后又起到了抑制作用,但总体提高了酶的活性。
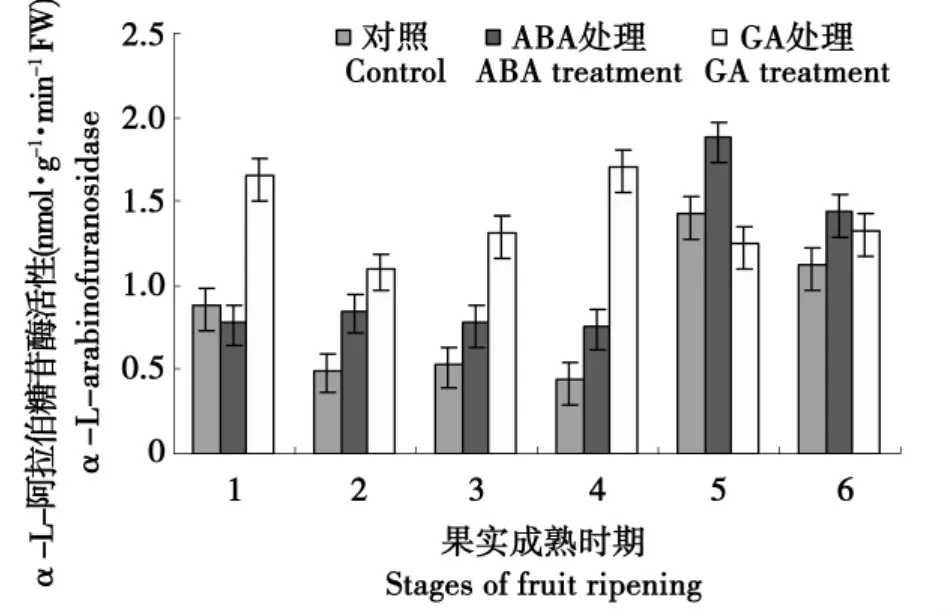
图4 GA和ABA对α-L-阿拉伯糖苷酶的影响Fig.4 Effect of GA and ABA on α-L-arabinofuranosidase activity of tomato
由图5可知,未经激素处理的GA突变体(对照)的β-半乳糖苷酶的活性呈现出先下降在粉红期达到最小值,之后上升达到最大值,达到最大值之后又开始迅速下降。ABA处理也表现出前期活性大,到转色期β-半乳糖苷酶活性最小,之后迅速上升,在淡红期达到最大值。GA处理的绿熟期活性最大,之后缓慢下降,在粉红期达到最小值,之后迅速上升。ABA和GA处理的β-半乳糖苷酶活性显著高于对照。

图5 GA和ABA对β-半乳糖苷酶的影响Fig.5 Effect of GA and ABA on β-galactosidase activity of tomato
由图6可知,未经激素处理的GA突变体的果实(对照)β-D-木糖苷酶的活性呈现先下降后上升的变化趋势,在绿熟期的活性最大。ABA处理的也表现出和对照酶活变化相同的趋势,但最大值出现在淡红期。GA处理的β-D-木糖苷酶的活性上升后下降,最小值在绿熟期出现,最大值同ABA处理的在同一时期。ABA和GA处理要显著高于对照组酶活性,且GA的促进效果显著的高于ABA。

图6 GA和ABA对β-D-木糖苷酶的影响Fig.6 Effect of GA and ABA on β-D-xylosidase activity of tomato
3 讨论与结论
3.1 糖苷酶与果实软化的关系
软化是果实成熟的重要标志,是一个复杂而有序的过程,其中涉及一系列生理生化反应。在果实中存在许多不同的细胞壁调节酶,由于不同类型的果实其细胞壁结构不同,而且在成熟过程中其结构的改变程度也不同,造成了不同品种果实质地改变和软化方式千差万别[12]。参与果实软化的细胞壁降解酶主要有多聚半乳糖醛酸酶,果胶甲酯酶,纤维素酶,糖苷酶(α-L-阿拉伯糖苷酶,β-D-木糖苷酶,β-甘露糖苷酶,β-半乳糖苷酶),甘露聚糖酶等[13]。其中,国内资料对糖苷酶的报道较少,国外学者认为果实成熟软化期间糖苷酶可能参与了细胞壁的代谢,但在不同种类和品种的果实上活性表现不同[14]。苹果、芒果、番木瓜、甜樱桃、鳄梨、猕猴桃、青梅等果实的硬度下降与半乳糖苷酶有密切的关系[15-16]。
本试验结果表明,通过GA处理的α-L-阿拉伯糖苷酶,β-D-木糖苷酶,β-半乳糖苷酶的活性显著提高。相对于果实硬度而言,经GA处理的显著低于未经激素处理;经ABA处理的α-L-阿拉伯糖苷酶,β-D-木糖苷酶,β-半乳糖苷酶的酶活得到了显著提高,果实的硬度低于未经激素处理的,且差异显著。由此可知,α-L-阿拉伯糖苷酶,β-D-木糖苷酶,β-半乳糖苷酶在番茄果实软化中扮演一定的角色。ABA在β-甘露糖苷酶的活性提高上起到一定的作用而GA则降低了β-甘露糖苷酶的活性,且经ABA处理的果实硬度显著低于经GA处理,也说明β-甘露糖苷酶在果实的软化中起到一定的作用。
3.2 GA与糖苷酶活性的关系
大量研究表明,对于跃变型果实,GA处理可以显著增加果肉硬度,降低呼吸强度,抑制内源乙烯的释放,减少ABA的累积,有效抑制果实的后熟软化,抑制细胞壁降解酶的活性[17-19]。而在研究甘露聚糖酶在番茄种子发芽中的作用中,以GA突变体(gib-1)的种子为试材,研究GA如何通过调控甘露聚糖酶进而调节种子发芽这一机理[20],GA促进了甘露聚糖酶的活性的提高。
本试验结果表明,经GA处理过的果实,α-L-阿拉伯糖苷、β-半乳糖苷酶和β-D-木糖苷酶的活性显著提高。且GA促进α-L-阿拉伯糖苷和β-半乳糖苷酶活性结果与Sozzi结果一致[21]。同时说明GA对α-L-阿拉伯糖苷、β-半乳糖苷酶和β-D-木糖苷酶起到正调控且放大酶信号的作用。GA促进酶活性的增加可能是因为GA在果实的成熟过程和后熟过程中所起到的角色不同。
同时,经GA处理后β-甘露糖苷酶的活性显著的下降,说明GA对β-甘露糖苷酶具有负调控作用,同时也说明GA对不同糖苷酶的调节机制不同,需要进一步的深入研究探讨。
3.3 ABA与糖苷酶活性的关系
脱落酸(ABA)与果实成熟的关系密切。ABA处理能促进草莓[22]、葡萄[23]和荔枝[24]等非乙烯跃变型果实提前成熟,还能促进苹果[25]、香蕉[26]等跃变型果实的成熟软化。不同的激素有可能通过调控相同的下游基因的表达来控制相同生理过程。例如,CYCD3(Cyclin D3)能被细胞分裂素诱导,参与细胞周期调控,而用BR处理同样可以诱导CYCD3的表达并且在愈伤组织培养实验中可以用BR替代细胞分裂素维持细胞的分裂[27]。多个激素也可以协同作用调节同一生理过程,如生长素和BR都可以调控编码乙烯合成限速酶的基因ACS4的表达,并且这两种激素对乙烯的合成有叠加效应[28-29]。
在本试验中经ABA处理的果实,α-L-阿拉伯糖苷酶,β-D-木糖苷酶,β-甘露糖苷酶,β-半乳糖苷酶活性均得到显著的提高,ABA可能是通过替代GA在果实软化中的作用或者两种激素以一种网络的协同形式调控这几种酶活进而影响果实的成熟软化,同时也说明ABA对不同的糖苷酶的调节机制相同,这仍需要进一步的深入研究。
[1]陆胜民,金勇丰,张耀洲,等.果实成熟过程中细胞壁组成的变化[J].植物生理学通讯,2001,37(3):246-249.
[2]马锋旺,关军锋,袁军伟,等.京白梨果实后熟软化过程中细胞壁代谢及其调控[J].中国农业科学,2009,42(8):2987-2996.
[3]薛炳烨,毛志泉,束怀瑞.草莓果实发育成熟过程中糖苷酶和纤维素酶活性及细胞壁组成变化[J].植物生理与分子生物学学报,2006,32(3):363-368.
[4]沈嘉祥,丹羽,利夫.脱落酸(Abscisic acid,ABA)对映异构体的生物活性比较[J].云南农业大学学报,1994,9(4):207-212.
[5]潘瑞炽主编.植物生理学[M].北京:高等教育出版社,2001:169-172.
[6]希尔T A著.内源植物生长物质[M].北京:科学出版社,1986,1-11.
[7]余叔文,汤章城.植物生理与分子生物学[M].北京:科学技术出版社,1998:421-422.
[8]缪颖,伍炳华,陈德海,等.植物激素研究中的遗传学和分子生物学方法[J].植物生理学通讯,2000,36(3):281-288.
[9]Hruba P,Honys D,Twell D,et al.Expression of β-galactosidase and β-xylosidase genes during microspore and pollen development[J].Planta,2005,220:931-940.
[10]Itail A,Ishihara K,Bewley J D.Characterization of expression and cloning of b-D-xylosidase and a-L-arabinofuranosidase in developing and ripening tomato(Lycopersicon esculentum Mill.)fruit[J].JournalofExperimentalBotany,2003,54(393):2615-2622.
[11]Bewley J D,Banik M,Bourgault R,et al.Endo-b-mannanase activity increases in the skin and outer pericarp of tomato fruits during ripening[J].Journal of Experimental Botany,2000,51:529-538.
[12]Huber D J.The role of cell wall hydrolases in fruit softening[J].Hortic Rev,1983(5):169-219.
[13]张丙秀,王傲雪,李景富.番茄细胞壁水解酶研究进展[J].东北农业大学学报,2009,40(1):128-132.
[14]Pressy R.β-galactosidases in ripening tomatoes[J].Plant Physiol,1983,71:132-135.
[15]陆胜民,席芳,张耀洲.梅果采后软化与细胞壁组分及其降解酶活性的变化[J].中国农业科学,2003,36(5):595-598.
[16]陈昆松,张上隆,Ross G.β-半乳糖苷酶基因在猕猴桃果实成熟过程的表达[J].植物生理学报,2000,26(2):117-122.
[17]田建文,贺普超,许明宪.植物激素与柿子后熟的关系[J].园艺学报,1994,21(3):217-221.
[18]李明启.果实生理[M].北京:科学出版社,1989:142-144.
[19]Lomanie A W.Gibberellin acid and CO2additive effect in retarding postharvest sencence of parsley[J].Journal of Food Science,1998,63(1):66-68.
[20]王傲雪,张丙秀,李景富.β-1,4-甘露聚糖内切酶在番茄发育中的作用[J].园艺学报,2006,33(5):1157-1161.
[21]Sozzi G O,Trinchero G D,Fraschina A A.Ethylene and glycosidase promotion in GA3-treated and IAA-treated tomato fruit(Lycopersicon esculentum Mill.)[J].J Plant Growth Regul,2000,19:359-368.
[22]吴有梅,顾采琴,邰根福,等.ABA和乙烯在草莓采后成熟衰老中的作用[J].植物生理学报,1992,18(2):167-172.
[23]张大鹏,徐雪峰,张子连,等.葡萄始熟机理的研究:缓慢生长期外施激素和环剥的效应[J].园艺学报,1997,24(1):1-7.
[24]尹金华,高飞飞,胡桂兵,等.ABA和乙烯对荔枝果实成熟和着色的调控[J].园艺学报,2001,28(1):65-67.
[25]陈尚武,张大鹏.ABA和Fluridone对苹果果实成熟的影响[J].植物生理学报,2000,26(2):123-129.
[26]Jiang Y,Joyce D C,Macnish A J.Effect of abscisic acid on banana fruit ripening in relation to the role of ethylene[J].J Plant Growth Regul,2000,19:106-111.
[27]Hu Y,Bao F,Li J.Promotive effect of brassinosteroids on cell divisioninvolvesadistinct CycD3-induction path way in Arabidopsis[J].Plant J,2000,24:693-701.
[28]Nemhauser J L,Mockler T C,Chory J.Interdependency of brassinosteroid and auxin signaling in Arabidopsis[J].Plos Biol,2004(2):E258.
[29]Goda H,Sawa S,Asami T,et al.Comprehensive comparison of auxin-regulatedand brassinosteroid-regulatedgenesin Arabidopsis[J].Plant Physiol,2004,134:1555-1573.
- 东北农业大学学报的其它文章
- 不同基因型大豆GS1基因的克隆与分析
- SYBR Green I荧光检测痕量宿主DNA

