川芎嗪对大鼠重症急性胰腺炎的实验研究
周春立,顾振纶,梁中琴,庞 智
(1.苏州市立医院北区,江苏 苏州 215008;2.苏州大学医学院,江苏 苏州 215123)
重症急性胰腺炎(SAP)是常见的内外科急症,其发病机制复杂,发展过程凶险,常导致多器官功能障碍,严重威胁生命健康。胰酶自身消化学说虽然是SAP发生发展的核心,但近年大量的研究表明该病的发生发展受诸多因素的影响,胰腺微循环障碍、细胞因子和炎症介质等起着重要作用。本文采用手术造成重症急性胰腺炎大鼠模型,给药后观察血清淀粉酶、C-反应蛋白、IL-6、IL-10、TNF-α、腹水量、胰腺组织病理形态学变化,以探讨川芎嗪对重症急性胰腺炎的治疗作用及其机制,为临床使用川芎嗪治疗重症急性胰腺炎提供理论依据和实验基础。
1 实验材料
1.1 药物与试剂
牛磺胆酸钠购自Sigma公司;TNF-α、IL-6试剂盒购自美国T&B克隆公司;IL-10试剂盒购自美国Endogen公司;肝肾功能、血清AMY、CRP测定试剂盒购自上海科华东陵诊断用品有限公司;川芎嗪注射液系上海第一生化药业公司生产,批号:020501;丹参注射液系上海第一生化药业公司生产,批号:971002。
1.2 仪器
电子显微镜,H-600型,日立株式会社;全自动生化分析仪,7060型,日立株式会社;双目光学显微镜,BX-50型,奥林巴斯光学株式会社;DG5031型酶联免疫检测仪,上海医疗仪器设备厂。
1.3 实验动物
健康Wistar大鼠180只,雄性,体质量180~250 g,由苏州大学医学院实验动物中心提供,动物合格证号:苏动(环)98008 ,苏动(质)98018。
1.4 统计学分析
2 实验方法与结果
2.1 动物分组
将实物动物随机分为6组,每组30只,分别为:(1)假手术组:NS 0.4 mL/100 g。(2)SAP模型组:NS 0.4 mL/100 g。(3)川芎嗪(TMP)大剂量组:160 mg/kg。(4)川芎嗪(TMP)中剂量组:80 mg/kg。(5)川芎嗪(TMP)小剂量组:40 mg/kg。(6)丹参注射液组:10 000 mg/kg。
参照Chetty[1]方法并加以改良。大鼠禁食、不禁水12 h后,以2.5%戊巴比妥钠溶液腹腔注射麻醉,上腹正中切口进腹,提起胃、十二指肠炎,找到胰管开口,于开口处下约15 mm处切开十二指肠,植入塑料管,于胰管开口远端、近端分别结扎,十二指肠切口远端结扎,造成20 mm长十二指肠闭袢。向闭袢内注入5%牛磺胆酸钠溶液0.3 mL,使闭袢充盈并反流至胰管内,关腹,术后限量饮水。假手术组:打开腹腔,轻轻翻动胰腺后关腹。各组均在关腹30 min后进行腹腔注射给药,给药体积为0.4 mL/100g。
2.2 实验方法
2.2.1 血肝肾功能、淀粉酶、C反应蛋白的测定 给药后3 h、6 h、12 h每组随机选取大鼠10只,以2.5%戊巴比妥钠溶液腹腔注射麻醉,腹主动脉取血,分离血清后测定C-反应蛋白、淀粉酶。
2.2.2 细胞因子的测定 给药后3 h、6 h、12 h每组随机选取大鼠10只,以2.5%戊巴比妥钠溶液腹腔注射麻醉,腹主动脉取血,分离血清后,测定细胞因子IL-6、IL-10、TNF-α。
2.2.3 腹水观察和胰腺组织形态学检查及评分 给药后3 h、6 h、12 h每组随机选取大鼠10只,以2.5%戊巴比妥钠溶液腹腔注射麻醉,开腹,观察腹水形状和量;吸取腹水、计量,观察颜色与浑浊度;胰腺组织以10%福尔马林溶液固定,经石蜡包埋、切片,常规HE染色后,光镜下观察,按照Kusske法作胰腺组织病理评分。
2.3 实验结果
2.3.1 TMP对SAP大鼠血清淀粉酶、C反应蛋白的影响 模型组在造模后3 h、6 h、12 h三个时间点模型组血清中AMY明显增高,与假手术组比较差异有统计学意义(P<0.01);TMP 80、160 g/kg剂量组给药后3 h、6 h、12 h三个时间点均能显著降低血清AMY水平,与模型组比较差异有统计学意义(P<0.01)。模型组在造模药后3 h、6 h、12 h血清中模型组CRP明显增高,与假手术组比较差异有统计学意义(P<0.01);TMP 80、160 g/kg剂量组给药后6 h、12 h两个时间点均能显著降低血清CRP水平,与模型组比较差异有统计学意义(P<0.05,P<0.01),结果见表1。
表1 TMP对SAP大鼠淀粉酶、C-反应蛋白的影响(,n=10)

表1 TMP对SAP大鼠淀粉酶、C-反应蛋白的影响(,n=10)
注:与假手术组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
假手术组3 1 674±241 23.5±0.4— 6 1 854±178 24.0±0.4 12 1 793±134 24.9±0.7 SAP模型组3 5 738±727△△ 14.9±3.5△△— 6 9 534±814△△ 25.4±6.5△△12 8 478±853△△ 37.4±6.8△△TMP小剂量3 5 494±671 15.4±4.8 40 6 9 315±903 24.1±6.7 12 7 954±831 34.3±7.1 TMP中剂量3 4 934±598** 12.6±4.7 80 6 6 957±457** 18.2±4.3* 12 4 593±324** 17.3±4.8** TMP大剂量3 5 157±713** 13.1±3.9 160 6 6 761±531** 17.8±5.3* 12 4 763±401** 15.7±5.1** 3 4 875±654** 12.9±4.1 10 000 6 6 491±571** 18.5±5.7* 12 4 671±354** 16.7±4.3**丹参组
2.3.2 TMP对SAP大鼠炎症因子表达的影响 从表2可知,模型组在造模后3 h、6 h、12 h三个时间点血清中炎症因子IL-6、TNF-α、IL-10明显增加,与假手术组比较差异有统计学意义(P<0.01)。TMP 80、160 mg/kg剂量组在3 h、6 h、 12 h三个时间点均能降低IL-6、TNF-α含量降低,与模型组比较差异有统计学意义(P<0.01),此外,TMP各剂量组血清IL-10水平略高于模型组。结果见表2。
2.3.3 TMP对SAP大鼠不同时间腹水量的影响 从表3中可知假手术组无明显腹水积聚,模型组在造模后3 h、6 h、12 h三个时间点均可见到淡黄色腹水,TMP 80、160 mg/kg剂量组在给药后3 h、6 h、12 h三个时间点均能减少SAP大鼠腹水量,与模型组比较差异有统计学意义(P<0.01)。
表2 TMP对SAP大鼠炎症因子表达的影响,n=10)
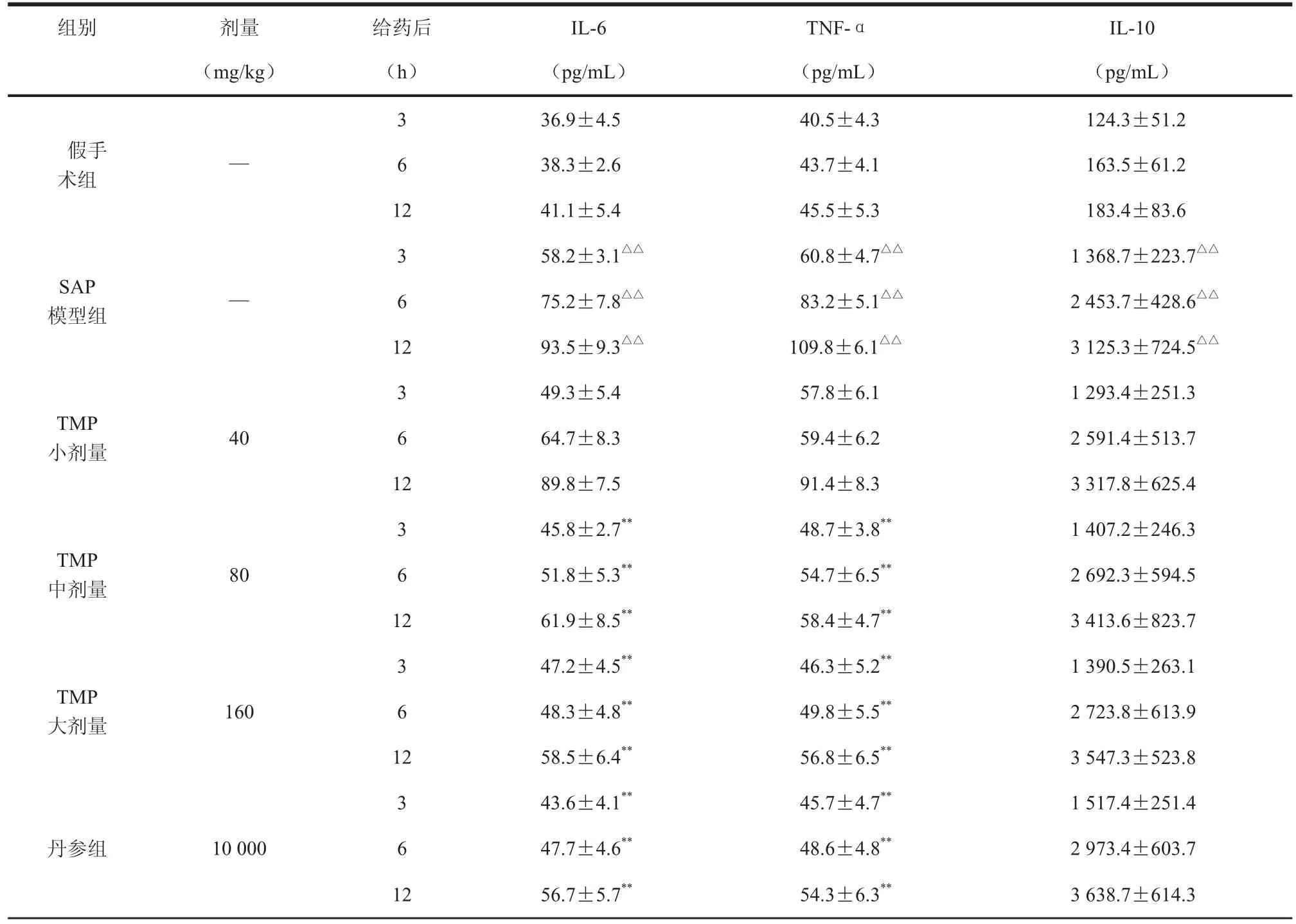
表2 TMP对SAP大鼠炎症因子表达的影响,n=10)
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01。
组别 剂量 给药后 IL-6 TNF-α IL-10(mg/kg) (h) (pg/mL) (pg/mL) (pg/mL)假手术组36.9±4.5 40.5±4.3 1 124.3±51.2—6 38.3±2.6 43.7±4.1 1 163.5±61.2 12 41.1±5.4 45.5±5.3 1 183.4±83.6 3 58.2±3.1△△ 60.8±4.7△△ 1 368.7±223.7△△6 75.2±7.8△△ 83.2±5.1△△ 2 453.7±428.6△△12 93.5±9.3△△ 109.8±6.1△△ 3 125.3±724.5△△3 SAP模型组 —TMP小剂量49.3±5.4 57.8±6.1 1 293.4±251.3 40 6 64.7±8.3 59.4±6.2 2 591.4±513.7 12 89.8±7.5 91.4±8.3 3 317.8±625.4 3 TMP中剂量45.8±2.7** 48.7±3.8** 1 407.2±246.3 80 6 51.8±5.3** 54.7±6.5** 2 692.3±594.5 12 61.9±8.5** 58.4±4.7** 3 413.6±823.7 3 TMP大剂量47.2±4.5** 46.3±5.2** 1 390.5±263.1 160 6 48.3±4.8** 49.8±5.5** 2 723.8±613.9 12 58.5±6.4** 56.8±6.5** 3 547.3±523.8 3丹参组43.6±4.1** 45.7±4.7** 1 517.4±251.4 10 000 6 47.7±4.6** 48.6±4.8** 2 973.4±603.7 12 56.7±5.7** 54.3±6.3** 3 638.7±614.3 3
表3 TMP对SAP大鼠不同时间腹水量的影响(,n=10)

表3 TMP对SAP大鼠不同时间腹水量的影响(,n=10)
注:与假手术组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别剂量 腹水量(mL)(mg/kg) 3 h 6 h 12 h假手术组 — 0 0 0 SAP模型组 — 3.59±1.31△△ 4.21±1.37△△ 4.93±1.62△△TMP小剂量 40 3.47±1.43 4.19±1.52 4.67±1.53 TMP中剂量 80 2.03±1.52* 2.79±1.13* 3.01±1.48* TMP大剂量 160 2.08±1.34* 2.57±1.25* 2.68±1.51**丹参组 10 000 2.33±1.04 3.05±1.13 3.55±1.31
2.3.4 胰腺组织形态学检查及评分 假手术组:胰腺组织在肉眼及光镜下观察基本正常,无明显出血及坏死。SAP模型组:随时间推移病理改变程度加重。在3 h、6 h、12 h表现分别以胰腺间质、被膜下水肿,充血;胰腺结构破坏,大量炎症细胞浸润,胰腺腺泡出现出血坏死;大片胰腺腺泡结构消失,胰周脂肪坏死。TMP各剂量组均能减轻胰腺组织的水肿、炎症、出血及坏死。造模及给药12 h后胰腺组织Kusseke病理评分见表4。
3 讨论
川芎嗪化学名为四甲基吡嗪,为伞型科藁本属川芎和姜科植物莪术根茎及大戟科植物通风麻风树茎中的主要化学成分之一,具有行气活血、散风止痛之功效。药理研究结果表明TMP具有钙离子拮抗样作用,有较强的扩血管、降低血液粘滞度、改善血流变、增加脏器微循环血流量的作用,抑制血栓素A2(TXA2)和炎性细胞因子和炎性递质的释放[2]。
表4 造模后12 h胰腺组织Kusseke病理评分(,n=10)
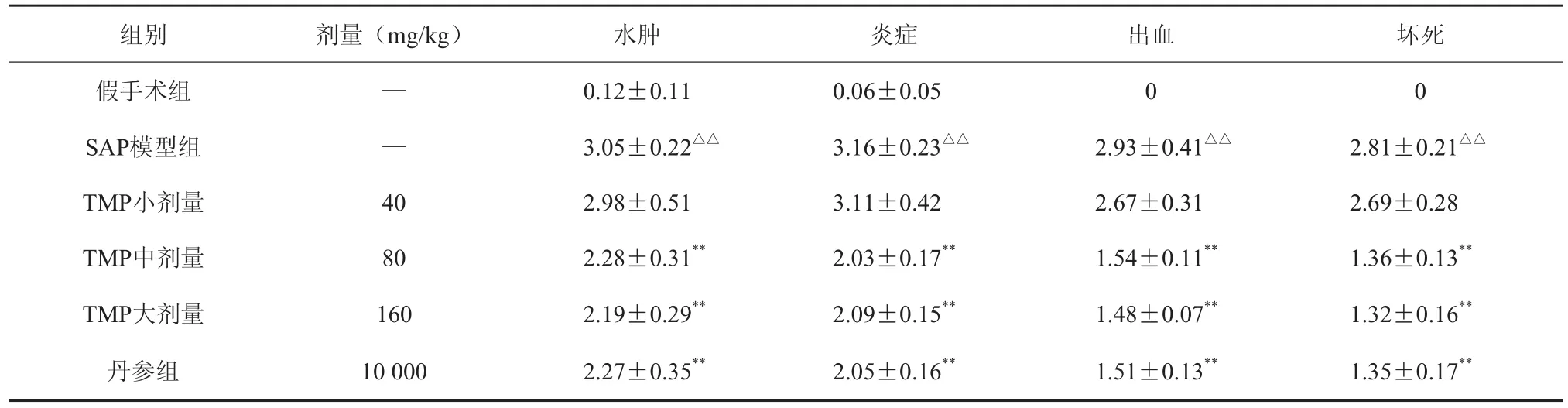
表4 造模后12 h胰腺组织Kusseke病理评分(,n=10)
注:与假手术组比较,△△P<0.01;与模型组比较,**P<0.01。
组别 剂量(mg/kg) 水肿 炎症 出血 坏死假手术组 — 0.12±0.11 0.06±0.05 0 0 SAP模型组 — 3.05±0.22△△ 3.16±0.23△△ 2.93±0.41△△ 2.81±0.21△△TMP小剂量 40 2.98±0.51 3.11±0.42 2.67±0.31 2.69±0.28 TMP中剂量 80 2.28±0.31** 2.03±0.17** 1.54±0.11** 1.36±0.13** TMP大剂量 160 2.19±0.29** 2.09±0.15** 1.48±0.07** 1.32±0.16**丹参组 10 000 2.27±0.35** 2.05±0.16** 1.51±0.13** 1.35±0.17**
急性胰腺炎(AP)是临床上常见的急腹症。临床上分为轻症急性胰腺炎(MAP)和重症急性胰腺炎(SAP)。MAP 经积极内科治疗一般在1周内可好转甚至可自愈;而SAP起病急,病情重,并发症多,常累及全身多个重要脏器,并释放大量的炎症介质和细胞因子进入血循环,促发炎症介质瀑布样级联反应, 导致全身炎症反应综合征甚至多器官功能障碍综合征,最后导致死亡。因此炎症介质在SAP的发生发展中起着关键作用[3]。
急性胰腺炎发展中的炎症介质主要包括促炎性细胞因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、抗炎性因子白细胞介素-10(IL-10)等。TNF-α主要由活化的单核巨噬细胞产生,是细胞因子网络的启动因子[4],可诱发IL-6、IL-8等促炎因子的产生,介导胰腺局部和全身炎症反应。IL-6被认为是引起局部胰腺和全身器官损伤的重要促炎细胞因子[5],有研究表明[6]IL-6预测AP严重度的时间较C-反应蛋白(CRP)更早,可作为预测胰腺病理变化的重要指标。IL-10是由单核巨噬细胞释放的一种重要抗炎因子[7],主要通过抑制巨噬细胞表达和呈递抗原,从而抑制TNF-α、IL-6、IL-8等促炎细胞因子的合成,具有重要的负调节机制,对于阻止AP的发生、发展发挥着重要的作用。
急性胰腺炎时,由于胰管堵塞或胰腺外分泌突然增加,使胰管内压力升高,腺泡破裂,大量胰酶释放入间质,部分被吸收入血,引起血清淀粉酶升高。有研究表明在胰腺炎发病早期,胰腺尚未广泛坏死之前,血清淀粉酶水平高低可以反应胰腺炎的严重程度。C-反应蛋白(CRP)是一种由肝细胞合成的急性时相反应蛋白,当机体组织受损时,会出现急性时相反应,从而导致CRP升高,研究显示血清CRP水平与胰腺炎的预后密切相关[8]。
本实验研究结果显示,SAP组在术后3 h、6 h、12 h血清TNF-α、IL-6和IL-10水平明显高于假手术组,且随时间延长逐渐增高,于12小时到达高峰。川芎嗪各剂量组相同时相的血清TNF-α、IL-6水平则较SAP组明显降低(P<0.05),而IL-10水平略高于SAP组。此外,川芎嗪可降低升高的血清AMY、CRP的水平,减少腹水的生成,并改善SAP时胰腺的水肿、炎症、出血及坏死。表明川芎嗪一方面能降低SAP大鼠TNF-α、IL-6水平,同时能升高血清抗炎因子IL-10水平,抑制巨噬细胞释放促炎因子,减轻TNF-α诱发的瀑布样级联反应,另一方面能降低SAP大鼠AMY、CRP的水平和改善胰腺组织形态,减轻胰腺的病变,从而达到治疗SAP的目的。
[1] Chetty U,Gilmour HM,Taylor TV. Experimental acute pancreatitis in the rat-a new model[J].Gut,1980,21(2):115-117.
[2] 都本敏,荆进红.川芎嗪的临床应用[J].现代中西医结合杂志, 2006,15(10):1 398- 1 399.
[3] Bhatla M,Brady M,Shokuhi S,et al.Inflammatory mediators in acute pancreatitis[J].J Pathol,2000,190(2):117-125.
[4] Mews P,Phillips P,Fahmy R.Pancreatic stellate cells respond to inflammatory cytokines:potential role in chronic pancreatitis[J]. Gut,2002,50(4):535-541.
[5] 姜 琳,朱金水.急性胰腺炎预后与细胞免疫因子相关研究新进展[J].世界华人消化杂志,2002,10:1 045-1 047.
[6] Riche FC,Cholley BP,Laisne MJ.Inflammatory cytokines,C reactive protein,and procalcitonin as early predictors of necrosis infection in acute necrotizing pancreatitis[J].Surgery,2003,133(3):257-262.
[7] 王 健,易继林.白介素-10 治疗急性胰腺炎的实验研究[J].中国危重病急病急救医学,2002,14(6):371-374.
[8] 徐天放,周嘉良.急性胰腺炎时C-反应蛋白变化的临床意义[J].苏州医学院学报,2001,21(3):296-297.
- 湖南中医药大学学报的其它文章
- 高频通气山莨菪碱救治儿童急性呼吸窘迫综合征

