茉莉花愈伤组织诱导及悬浮细胞培养
庄哲煌,蔡汉权,陈丹生
(韩山师范学院生物系,广东潮州,521041)
茉莉花愈伤组织诱导及悬浮细胞培养
庄哲煌,蔡汉权,陈丹生
(韩山师范学院生物系,广东潮州,521041)
以茉莉花(Jasminum sambac)花瓣为外植体在不同培养基上诱导出愈伤组织,通过对其类型的筛选从中选择疏松愈伤组织进行悬浮培养后,初步建立悬浮细胞培养系。结果表明,不同激素可诱导出疏松型(CA)、泥状型(CB)和绿色块状型(CC)愈伤组织,其分化方向也不同。用CA型和CB型愈伤组织均能建立悬浮细胞培养系,其中以泥状愈伤组织为起始材料较佳,大约11 d可建立初步的悬浮细胞培养系。
茉莉花;愈伤组织;悬浮细胞培养
茉莉花 (Jasminum sambac)属木犀科素馨属植物,常绿攀缘灌木,茉莉鲜花瓣中含芳香油0.2%~0.3%,主要成分是苯甲醇及其酯类,可以制作香精并应用于日常化妆品、洗涤用品和食用香精中[1]。因市场需求提高,从而带动了人们对茉莉花的栽培和香精油提取的研究,如《茉莉栽培浅谈》[2]、《茉莉花的化学成分》[3],其产品市场已趋成熟。但是,目前各种提取方法都需将整朵花进行破坏,茉莉花香精油提炼效率较低[1]并受季节限制,制约了茉莉香精提取业的发展。如果能运用细胞工程手段,利用细胞大量培养及代谢产物分离,提高茉莉花香精油的提取效率,同时避免盛花季节对工业生产带来的影响,那么将对今后茉莉花的生产与利用具有重要的意义。
通过悬浮细胞培养产生代谢产物以促进工业化生产,是现代生物工程技术迅速发展的一个方向。目前至少已在200种植物上生产500种以上的有用成分[4],如白雪芳等[5]、蔡汉权等[6]、林龙云等[7]、李玲等[8]、Chen等[9]、Liang等[10]、Tang等[11]分别在三尖杉、罗勒、太子参、野葛、烟草(tobacoo)、苦楝树(neem tree)、人参(panax ginseng)等植物的悬浮培养中阐述了愈伤组织的形成、悬浮培养系的建立及其产物的研究。茉莉花组织培养方面的研究很少,江明等[12]在1994年报道了《大花茉莉的组织培养和植株再生》,而茉莉花瓣诱导愈伤组织及其悬浮细胞培养则未见报道。因此本文通过研究茉莉花花瓣诱导愈伤组织和建立茉莉花悬浮细胞培养系的方法,为进一步应用于原生质体分离、细胞培养、次级代谢产物生产等研究打下基础。
1 材料与方法
1.1 试验材料
茉莉花(Jasminum sambac)花苞内层的花瓣。
1.2 试验方法
①取材和消毒 从校园花圃采集茉莉花花苞,将整个花苞连同花托、花柄一起剪下,于肥皂水中浸泡30 min。接种前将花托去掉、整个花苞置于0.1%的HgCl2溶液中浸泡8 min,后将花苞捞出,用无菌水清洗3~4次,置于无菌吸水纸上。接种时将花苞切开,除去外2层花瓣,取内部花瓣平贴于培养基上,每瓶接种3~4个花瓣。
②愈伤组织的诱导 将花瓣接入诱导培养基(BK1、BK2、BK3、BK4、BK5、BK6),诱导出愈伤组织后选择BK5培养基继代培养2 w。调整激素配比,用分化培养基(F1、F2、F3、F4、Y1、Y2、Y3、Y4)诱导并筛选各种类型的愈伤组织。
诱导培养基BK1:MS+6-BA 0 g/L+NAA 0 g/L;BK2:MS+6-BA 0.2 g/L+NAA 0.2 g/L;BK3:MS+6-BA 0.5 g/L+NAA 0.2 g/L;BK4:MS+6-BA 1 g/L+NAA 0.2 g/L;BK5:MS+KT 1 g/L+2,4-D 1 g/L;BK6:MS+KT 1 g/L+2,4-D 2 g/L。继代培养基BK5:MS+KT 1 g/L+2,4-D 1 g/L。分化培养基F1:MS+KT 0.5 g/L+2,4-D 0.2 g/L;F2:MS+ KT 0.5 g/L+2,4-D 0.5 g/L;F3:MS+KT 0.5 g/L+2,4-D1 g/L;F4:MS+KT 0.5 g/L+2,4-D 2 g/L。Y1:MS+6-BA 0.2 g/L+NAA 0.2 g/L;Y2:MS+6-BA 0.5 g/L+NAA 0.2 g/L;Y3:MS+6-BA 1 g/L+NAA 0.2 g/L;Y4:MS+6-BA 2 g/L+ NAA 0.2 g/L。

表1 诱导培养基上愈伤组织的诱导情况
培养基配制条件:附加蔗糖30 g,琼脂9.2 g/L,pH值5.8~6.0,121℃高压灭菌20 min。
外植体培养条件:温度23~27℃,光照强度1 500 lx,光周期12 h/d。
③茉莉花花瓣悬浮细胞系的建立 经过分化培养基的培养,愈伤组织出现了不同的生长、分化情况,其中F3培养基能诱导出泥状愈伤组织。将F3培养基去除琼脂,其液体培养基F5作为悬浮细胞的培养基。
F5:MS+KT 0.5 g/L+2,4-D 1 g/L的液体培养基,其蔗糖浓度为30 g/L,pH值5.8~6.0,配制后分装于100 mL三角锥形瓶中,每瓶装培养基20 mL,121℃灭菌20 min,备用。
将CA、CB和CC 3种类型的愈伤组织分别接入F5培养基,接种量为每瓶0.3~0.5 g,每种材料接种8瓶。将其在超净工作台上无菌接种后置于摇床上进行液体振荡培养,培养条件为温度28℃,弱光150 lx,光周期12 h/d,振荡速度为120 r/min。接种5 d后第一次镜检,并进行继代,即吸取浑浊但无较大组织块的液体培养基接入新鲜F5培养基继代培养,直至形成分散、快速生长的悬浮细胞系。
2 结果与分析
2.1 愈伤组织的诱导与分化结果
①不同诱导培养基上愈伤组织的诱导茉莉花瓣在BK1~BK66种培养基的诱导下,开始出现变化,20 d后统计其愈伤组织的诱导数,结果见表1。
BK1~BK4这4种培养基中的花瓣于12 d后开始出现膨大,瓣沿出现颗粒状鼓起,后颜色由白转黄,停止变化,最终启动失败,无愈伤组织出现。
表1中BK5于10~12 d后开始出现乳白色愈伤组织,且细胞扩展迅速。BK6于15 d后开始出现白色愈伤组织,扩展速度一般。而将BK5继代10~12 d后接入8种分化培养基进行诱导,愈伤组织出现绿色、黄绿色、浅绿色、乳白色、黄白色和褐色;块状、泥状、粒状等不同分化类型(表2)。在继代过程中,CA型与CB型部分出现黄色分泌物(图1),初步推测为其代谢产物,这与本试验的研究目的与方向相符。也由此说明,激素类型的选择与搭配对愈伤组织的诱导有显著影响,KT与2,4-D的组合明显优于6-BA与NAA的组合。BK5:MS+KT 1 g/L+2,4-D 1 g/L是茉莉花瓣愈伤组织诱导的适宜培养基。

图1 愈伤组织产生的黄色代谢产物
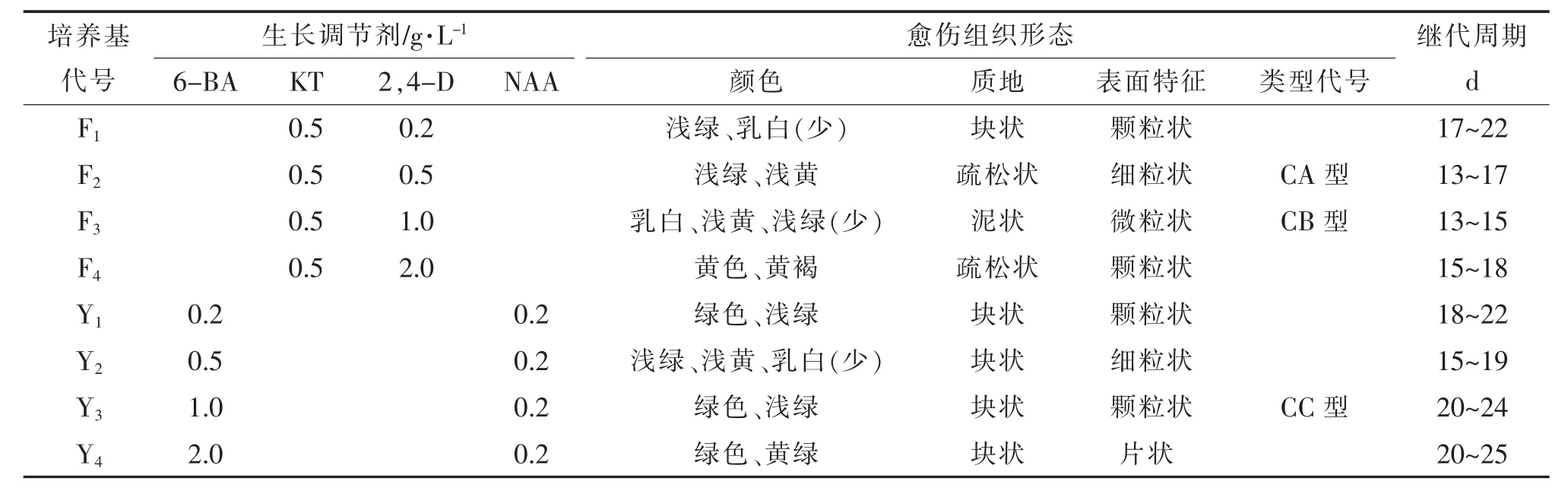
表2 不同培养基下愈伤组织的分化情况

图2 CB型愈伤组织涂片:分散的单细胞及小细胞团

图3 CB型悬浮细胞:分散性良好

图4 CB型悬浮细胞:分散性好,分裂快
②愈伤组织类型的分化。选择BK5培养出的愈伤组织,接入8种分化培养基中进行诱导,经过30 d进行统计,结果出现CA型、CB型和CC型3种具有代表性的愈伤组织(表2)。
CA型为疏松型愈伤组织,以黄色为主,少数浅绿色、松散易夹碎,含有一定水分,亦称沙状。
CB型为泥状愈伤组织,以乳白色为主,表面湿润。其细胞活力强、生长迅速,非常松散,含水分最多。继代培养时在固体培养基上将其平铺摊开,再挑去大块的愈伤组织,经过2~3次继代后就能得到微粒状愈伤组织,即是泥状。将此愈伤组织在玻片上作涂片,可见单细胞及小细胞团(图2)。
CC型为块状愈伤组织,绿色或黄绿色,难夹碎需用刀切开,水分很少,表面有绿色颗粒状突起,有诱导芽的能力,试验过程中已从CC型愈伤组织诱导出根。
3种愈伤组织相比,CB型愈伤组织最为松散,适合作为建立悬浮细胞系的起始材料,CA型和CC型则作为对比材料。
由此可见,激素类型和浓度对愈伤组织的生长、分化有明显影响,低浓度(F1,Y1)下愈伤组织生长慢,继代周期较长,状态为粒状和块状;高浓度(F4,Y4)下愈伤组织易出现变褐、变硬等老化现象。说明F3:MS+KT 0.5 mg/L+2,4-D 1 mg/L适宜愈伤组织培养及分化。
2.2 茉莉花愈伤组织类型对悬浮细胞系建立的影响
分别将已继代的CA型、CB型和CC型愈伤组织接入20 mL的F5培养液,每瓶0.3~0.5 g,比较愈伤组织类型对悬浮细胞建立的影响。
结果表明,在接入CB型愈伤组织5 d后,悬浮液中有较多的单细胞和小细胞团出现。此时,尽量避免大块愈伤组织,吸取部分浑浊液接入相同的新鲜培养液继续振荡培养,6 d后可获得分散性良好的悬浮细胞系(图3)。镜检表明,CB型愈伤组织所建立的悬浮细胞系需时较短,大概11 d,细胞分裂快、分散性好,整体生长迅速(图4)。相比较之下,接入CA型愈伤组织振荡培养5 d后,悬浮液的主要组成还是细胞团,继代5 d后再镜检,才看到少数的单细胞和较多的小细胞团。而CC型愈伤组织是块状愈伤组织,只能切取其表面的颗粒状愈伤组织接入,培养10 d后镜检,只出现极少的小细胞团,再经过10 d的培养,也只能得到少数的几个单细胞,培养液中依旧为大块培养物,悬浮培养失败。
由此可见,愈伤组织类型对建立悬浮细胞系有明显影响,CA型和CB型愈伤组织均可建立悬浮培养系,以CB型培养基为佳,而CC型为块状愈伤组织,不适合作为悬浮培养的起始材料。
3 小结与讨论
3.1 影响愈伤组织成功诱导的因素
本试验能成功诱导出愈伤组织,进而完成后边一系列试验,与培养基激素密切相关,同时外植体的取材和消毒也十分重要。
①培养基激素类型 吕冬霞等[13]认为,多数情况下,单独使用2,4-D就可以成功诱导愈伤组织的发生,但容易受浓度高低的影响。生长素和细胞分裂素对保持愈伤组织的快速生长是非常必要的,特别是二者有效结合时,能更强烈地刺激愈伤组织的形成。本试验证明,激素类型的选择与搭配对愈伤组织的诱导有显著影响,KT与2,4-D的组合是成功诱导愈伤组织形成的关键。而从2,4-D浓度的选择及结果来看,与张素勤等[14]对非洲菊叶片愈伤组织的诱导试验结果相同,诱导愈伤组织因生长素种类不同,所需浓度也不同。2,4-D以1.0 mg/L诱导效果最好,浓度升高,产生的愈伤组织量减少,而浓度降低,诱导率则下降。
②取材与消毒 在采集茉莉花花苞时,应尽量选择膨大的即将开放的色泽乳白或米黄,无破损或裂缝的花苞,若破损或裂缝易受到污染或因消毒而被破坏。幼小花苞的花瓣容易枯萎或褐变,不宜作为外植体。消毒过后要用无菌水冲洗彻底,避免切开花苞后残余消毒液对内层花瓣的伤害,导致外植体褐变或枯萎。
3.2 茉莉花悬浮细胞系建立的关键因素
本试验能在10~11 d成功建立茉莉花悬浮细胞系,原因在于诱导出了CB型泥状愈伤组织。CB型愈伤组织松散度高,细胞分裂快、生长快,是建立悬浮细胞系的较佳材料。另一个成功因素则是选择了合适的培养基。液体培养基F5是从F3培养基去掉琼脂而来,而F3培养基培养出了泥状愈伤组织,说明其成分适合泥状愈伤组织的生长,因此,F5也适用于悬浮培养中继续培养泥状愈伤组织,让其更松散地生长和分裂。
3.3 CA型、CB型产生的黄色物质
在CA型、CB型愈伤组织的继代、培养过程中,部分组织块切口出现黄色物质,经镜检并非外侵细菌,因此初步推测为其次生代谢产物,由细胞分泌出来。当然,在建立悬浮细胞系的过程中,液体培养基本是无色透明的,在接入愈伤组织5~6 d后亦会变浑浊同时淡黄化。这种现象除细胞团的增多外,也与分泌出的黄色物质融于培养基中有关。这些次生代谢物是不是试验最终想得到的茉莉花油,其含量又如何,有待进一步的研究和检验。
[1]张新发,肖希和,丁冬.茉莉花香料的提取及其应用的研究[J].武汉工业学院学报,2000(1):18-20.
[2]房兆军.茉莉栽培浅谈[J].农业知识,2004(2):33.
[3]刘海洋,倪伟,袁敏惠,陈昌祥.茉莉花的化学成分[J].云南植物研究,2004(6):687-690.
[4]曹有龙,许兴,赵军,等.麻黄愈伤组织细胞的悬浮培养[J].应用与环境生物学报,2000,6(1):36-38.
[5]白雪芳,王靖楣,卜宗式,等.三尖杉悬浮细胞的培养及抗癌生物碱的产生[J].中国生化药物杂志,1999,20(3):139-142.
[6]蔡汉权,赖钟雄,林珊珊,等.罗勒(Ocimum basilicum)悬浮细胞系的建立与保持[J].热带作物学报,2006,27(1):44-48.
[7]林云龙,周以飞,潘大仁.太子参细胞悬浮培养及其皂苷含量分析[J].热带亚热带植物学报,2005,13(6):499-504.
[8]张春荣,李玲.野葛幼叶细胞悬浮培养生产葛根素等异黄酮类化合物的研究[J].中草药,2003(7):653-657.
[9]Chen H M,Yan C H,Jiang X F,et al.Apoptosis in suspension culture of tobacco cells induced by heat shock[J].Chinese Science Bulletin,1999,12:1 101-1 106.
[10]Liang J,Wei G,Lv Q,et al.Cell suspension culture of neem tree[J].Chinese Forestry Science and Technology, 2003,2:16-21.
[11]Tang W,Wu J Y,Zhang L M.Influences of plant growth regulators,basal media and carbohydrate levels on cell suspension culture of panax ginseng [J].Journal of Northeast Agricuitural University,1995,1:62-65.
[12]江明,谢文申.大花茉莉的组织培养和植株再生[J].植物生理学通讯,1994,30(6):436-437.
[13]吕冬霞,曲长福.植物生长调节剂对愈伤组织培养的影响[J].北方园艺,2004(5):68.
[14]张素勤,邹志荣,耿广东,等.培养基和植物激素对非洲菊叶片愈伤组织诱导的研究[J].西北农林科技大学学报:自然科学版,2004,32(10):29-32.
Jasminum sambacCallus Induction and Suspension Cell Culture
ZHUANG Zhehuang,CAI Hanquan,CHEN Dansheng
(Department of Biology,Hanshan Normal University,Chaozhou,Guangdong 521041)
Petals of Jasminum sambacwere induced and cultured callus on the media with different phytohormones concentration.The preliminary stable suspension culture system was established after choosing the loose callus from different types for cell suspension culture.The results indicated that different phytohormones could form three types of callus,CA, CB and CC which had diverse polarization direction.Both the CA and CB callus could be used as initial materials for establishing suspensions,and it took about 11 days to establish cell suspensions from the better callus,CB callus.
Jasminum sambac;Callus;Cell suspension culture
10.3865/j.issn.1001-3547.2011.08.007
韩山师范学院重点科研项目(2005-413545)
庄哲煌(1984-),男,助教,本科,从事植物组织培养的教学与研究工作,电话:0768-2317422,E-mail:zzh@hstc.edu.cn
2011-03-15

